减压病是机体所处环境压力下降过快(不当减压)时, 体内血管或组织中溶解的惰性气体脱饱和形成气泡引发的一系列病理生理学过程[1-2]。减压病的症状随病情严重程度而变化, 包括但不局限于关节疼痛、腹部放射痛、感觉异常、呼吸困难、认知障碍、心肺功能障碍以及死亡[3-4], 是影响潜水人员生命安全的重要因素。目前减压病详细的致病机制仍不完全明确, 其防治措施仍是各类水下活动的核心问题。而减压病发病条件特殊, 相较于其他临床常见疾病, 病例数极少, 且个体对减压病易感性差异较大[5], 常需要以动物模型作为研究载体。采用动物模型可有效研究减压病的发病机制、防治措施, 然后再转化为临床应用。目前已有多种动物用于减压病的研究, 如猴、猪、羊、狗等大型动物, 以及小鼠、豚鼠、大鼠等小型动物。小型动物价格低廉、操作方便, 但生理构造与人类差异较大。大型动物在基因水平、生理构造上与人类具有相似性, 但价格昂贵、不易操作。而兔体型和价格适中, 具有大小型动物模型的诸多优势[6], 且其耳缘静脉表浅, 便于多次、足量采血, 减少小型动物多批次、多时间点采血产生的个体差异, 适宜用作动物模型的研究。本研究旨在建立兔空气潜水减压病模型以及系统、全面的模型指标评估体系。
1 材料和方法 1.1 实验动物新西兰白兔31只, 雄性, 体质量为(2.24±0.21)kg, 购于上海生旺实验动物养殖有限公司[实验动物生产许可证号SCXK(沪)2018-0001]。饲养于海军军医大学(第二军医大学)实验动物中心, 在任何实验操作前均适应性饲养1周, 饮食、饮水不限。将动物随机分为2组:正常对照组(n=6, 将新西兰白兔置于加压舱内常压通气)和高气压暴露组(n=25, 对新西兰白兔进行高气压暴露并快速减压)。
1.2 实验设备DWC150型动物实验加压舱, 购于上海701所杨园医用氧舱厂。MyLab 30CV型彩色超声成像系统(LA435超声探头), 购于意大利百胜集团公司。BC-2800 Vet型全自动动物血液细胞分析仪, 购于深圳迈瑞生物医疗电子股份有限公司。XL1000e系列全自动凝血测试仪, 购于北京众驰伟业科技发展有限公司。
1.3 高气压暴露与减压方案以100 kPa/min的速率压缩空气加压(所有压强单位均表示表压), 在500 kPa暴露60 min。暴露期间持续通风(通气量为1 L/min), 舱底铺碱石灰进一步吸收残留CO2, 舱内温度维持在23~25 ℃。高气压暴露结束后以200 kPa/min匀速减至常压。出舱后置于平坦地面上自由活动, 环境温度为(24±1)℃, 相对湿度为(55±5)%。
1.4 观察指标 1.4.1 气泡量出舱后10、20、30、40、60、90 min时行超声检查, 观察流经右心室的气泡量1 min并计数。根据Eftedal-Brubakk评分方法[7]对气泡量评分:未观测到气泡记0分; 偶尔出现气泡记1分; 每4个心动周期至少出现1个气泡记2分; 每个心动周期至少出现1个气泡记3分; 视野中气泡个数为1/cm2记4分; 满屏气泡, 无法辨认单个气泡记5分。
1.4.2 整体行为学(1) 肢体运动功能。出舱后90 min内观察肢体运动功能并根据改良Tarlov法[8]评价后肢功能状态:后肢完全瘫痪记0分; 可察觉的后肢关节运动记1分; 后肢可自由运动, 但无法站立记2分; 能够站立, 但无法跳动记3分; 可齐足跳动, 但不够灵活记4分; 后肢功能正常记5分。(2)呼吸指标。出舱后90 min内观察新西兰白兔的呼吸变化, 根据Atkins等[9]描述的方法, 按呼吸困难严重程度分别评分:呼吸正常记0分; 呼吸急促、轻度呼吸困难记1分; 烦躁不安、呼吸暂停、中度呼吸困难记2分; 严重呼吸困难、仰卧位呼吸记3分; 呼吸衰竭、昏迷、死亡记4分。
1.4.3 肺湿干质量比出舱后24 h过量麻醉, 取右侧肺组织, 用冰生理盐水漂洗去除表面的残血, 肺表面用滤纸吸干, 称湿质量; 置于60 ℃烤箱中连续烘烤48 h, 称干质量。计算肺湿干质量比。
1.4.4 组织学观察出舱后24 h使用过量氯胺酮麻醉处死动物, 解剖观察肺和脊髓组织大体病理学, 以及各脏器血管内气泡生成情况。然后摘取部分肺和脊髓组织, 采用10%甲醛固定, 制作H-E染色切片于显微镜下观察。(1)肺脏镜下病理表现[10]。观察肺泡阻塞、出血、白细胞浸润、透明膜形成等情况, 并进行肺损伤评分:正常肺组织记0分, 肺组织有损伤但损伤范围<25%记1分, ≥25%且<50%记2分, 50%~75%记3分, >75%记4分。(2)脊髓镜下病理表现。参照Kaptanoglu等[11]描述的方法, 于200倍视野下观察脊髓组织, 对脊髓出血、阻塞、坏死、水肿、神经元丢失、炎症6项指标的严重程度分别进行评分:较轻记0分; 轻度记1分; 中度记2分; 重度记3分。将6项指标评分的平均值定义为脊髓损伤的严重程度评分。
1.4.5 血液学指标高气压暴露前和出舱后1、6、12 h经耳缘静脉取静脉血2 mL进行血常规和凝血功能检测。(1)血常规:采用BC-2800 Vet型全自动动物血液细胞分析仪对血液样本进行白细胞、红细胞、血小板计数。(2)凝血功能:采用XL1000e系列全自动凝血测试仪检测凝血酶原时间和纤维蛋白原水平。
1.5 统计学处理采用SPSS 21软件进行统计学分析。呈正态分布的计量资料以x±s表示, 重复测量资料的比较采用单因素重复测量资料的方差分析, 两相关样本比较采用配对样本t检验, 两组间比较采用两独立样本t检验, 有序多分类资料的比较采用Wilcoxon秩和检验。检验水准(α)为0.05。
2 结果 2.1 模型发病率采用25只新西兰白兔制备减压病模型, 发病率为76%(19/25), 死亡率为28%(7/25)。其中Ⅰ型减压病发病率为12%(3/25), Ⅱ型减压病发病率为64%(16/25)。动物多在减压后5~20 min内发病, Ⅰ型减压病新西兰白兔仅出现躁动不安、呼吸加快、不正常的舔啃动作; Ⅱ型减压病动物出现仰卧位呼吸、肢体瘫痪, 甚至死亡, 一般由Ⅰ型减压病发展而来, 常伴随Ⅰ型减压病症状。不同严重程度减压病的发病率见表 1。
|
|
表 1 新西兰白兔不同严重程度减压病的发病率 Tab 1 Incidence of different severities of decompression sickness in New Zealand white rabbits |
2.2 新西兰白兔减压病模型大体标本观察结果
采用500 kPa暴露60 min后以200 kPa/min匀速减压方案造模的25只新西兰白兔中, 7只动物在观测周期24 h内死亡。解剖观察大体标本, 死亡动物气泡负荷均过大, 静脉系统(皮下静脉、肠系膜静脉、膀胱静脉、胃静脉、肾静脉、冠状静脉、脊髓静脉、下腔静脉)内可见大量气泡和泡沫状血(图 1)。
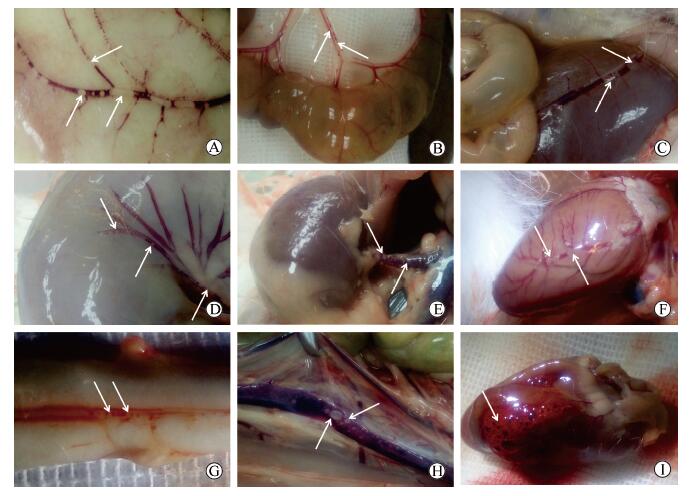
|
图 1 新西兰白兔减压病模型不同静脉中存在气泡(箭头所示) Fig 1 Gas bubbles (arrows) in different veins of New Zealand white rabbits with decompression sickness A:Subcutaneous vein; B:Mesenteric vein; C:Urinary bladder vein; D:Gastric vein; E:Renal vein; F:Coronary vein; G:Dorsal spinal vein; H:Inferior vena cava; I:Bloody foam |
2.3 新西兰白兔减压病模型行为学、组织学指标观察结果
与正常对照组比较, 超声检查发现减压病模型新西兰白兔的静脉气泡量评分、呼吸功能评分、肺损伤评分、脊髓损伤评分、肺湿干质量比均增加, Tarlov评分降低, 差异均有统计学意义(P均<0.05, 表 2)。减压后24 h, 新西兰白兔肺组织可见肺泡腔出血、肺泡间隔增厚, 脊髓组织可见空泡样改变(图 2)。
|
|
表 2 减压病(DCS)模型新西兰白兔的行为学、组织学变化 Tab 2 Behavior and histopathology of New Zealand white rabbits with decompression sickness (DCS) |

|
图 2 正常对照组和减压病模型组新西兰白兔肺和脊髓组织H-E染色结果 Fig 2 H-E staining of lung and spinal cord of New Zealand white rabbits in normal control and decompression sickness groups A:Normal lung tissue and alveolar space of normal control rabbit; B:Lung tissue of decompression sickness rabbit having bleeding in alveolar space and thickened alveolar wall (arrows); C:Normal spinal cord tissue and neurons of normal control rabbit; D:Spinal cord tissue of decompression sickness rabbit having vacuolar degeneration (arrows).Original magnification:×200 |
2.4 新西兰白兔减压病模型血液学指标检测结果
与高气压暴露前比较, 减压出舱后6 h、12 h减压病新西兰白兔的白细胞计数增加(t=3.933、2.838, P=0.003、0.019), 减压后1 h红细胞计数、红细胞比容均减少(t=-2.606、-2.481, P=0.031、0.038);血小板呈先降后升的趋势, 减压后12 h时与高气压暴露前比较差异有统计学意义(t=2.545, P=0.031)。凝血酶原时间、纤维蛋白原水平均呈升高趋势, 但与高气压暴露前相比差异均无统计学意义(P均>0.05)。见表 3。
|
|
表 3 快速减压后血液学指标的变化 Tab 3 Changes of blood parameters after fast decompression |
3 讨论 3.1 兔减压病模型的优缺点
兔作为最常用的实验动物之一, 与大鼠[12]、猪[13]等动物相比, 更易诱导发生脊髓型减压病。目前已有很多关于兔减压病的研究报道, 国内多采用500 kPa暴露60 min后3~5 min减至常压, 重型减压病发病率为50%~60%, 表现为单侧或双侧后肢一过性或永久性瘫[14]; 国外采用的500 kPa暴露40 min后5 min减至常压, 重型减压病发病率较低[15]。本研究采用了与国内常用方案相同的暴露压力和暴露时间, 但加快减压速度, 以200 kPa/min匀速减压, 获得较高发病率的脊髓型减压病, 与既往研究模型[16]相比, 脊髓型减压病发病率更高, 脊髓损伤更为严重。本研究探索了在更大的减压速度下减压病的发病情况, 为后续减压病研究扩大了模型选择范围。此外, 既往的研究往往以单一指标对模型的严重程度进行评价, 本研究则从行为学、组织学、血液学以及气泡生成等方面, 对模型进行了系统评估。同时采用多时间点取材检测减压前后血液学指标变化, 客观地反映了快速减压导致的机体血液指标变化规律。而兔可多次采血的特点, 使其可做到血液学指标的个体自身对照; 与小型动物相比, 兔避免了因处理前后或多时间节点比较时使用多组动物产生的组间差异; 而与大型动物相比, 又可显著降低实验成本。
然而兔具有夜行性和嗜眠性, 白天表现十分安静, 运动较少, 采用相同的高气压暴露方案, 减压病发病率和严重程度稍低于人类, 实验研究中应考虑这一差异。另外, 兔体表为毛发覆盖, 难以观察减压病产生的皮肤症状, 不宜用于皮肤型减压病的研究; 兔对环境影响亦很敏感, 具有耐寒、不耐热的特性, 实验应用中应考虑季节性差异, 需严格控制环境温度。
3.2 影响减压病模型发病率的因素减压病模型发病严重程度主要取决于高气压暴露方案, 即暴露压力、时间以及减压速率。发病率通常随着暴露压力的升高、暴露时间延长、减压速率加快而升高, 可通过调整3个因素以获取不同发病率的模型。结合前期预实验模拟不同方案高气压暴露的结果, 本研究最终选用的500 kPa暴露60 min后以200 kPa/min匀速减压方案, 制备了较高发病率、较低死亡率的减压病模型。既往研究以相同的暴露压力、时间和3~5 min减压, 脊髓型减压病的发病率为50%~60%[16-17]。因此可以推测, 以相同的暴露压力、暴露时间和200 kPa/min匀速减压方案, 可诱导产生60%~80%发病率的脊髓型减压病。实验中可根据不同目的调整暴露压力、时间及减压速率, 从而获得期望严重程度的减压病模型, 但为避免产生氮麻醉效应暴露压力不宜超过600 kPa[18]。本研究采用的减压速率相比既往研究[14, 16]稍快, 重型减压病发病率明显升高, 发病时间提前, 推测减压速度以100~200 kPa/min为宜, 不宜超过200 kPa/min, 避免产生过高的死亡率。
在相同的暴露方案下, 动物状态、环境温度、体质量等均会对减压病发病率产生一定程度的影响。动物状态差(如进食量减少、运动减少)时减压病的发病率、死亡率均会升高。环境温度与减压病发病率之间关系复杂, 有研究认为减压后低温环境会增加减压病的发病率[19], 也有研究发现潜水和减压后高、中、低温9种温度组合与减压病发病率无显著关系[20], 实验中应尽可能减少环境温度变化对实验的影响。体质量高的动物减压病发病率明显升高[12]。此外, 个体对减压病易感性差异较大[21], 可能与免疫系统及血管内皮系统相关[22]。
3.3 模型检测指标的选择与意义兔减压病的诊断主要依据症状学表现, 可分为Ⅰ型、Ⅱ型减压病, Ⅰ型减压病症状较轻, 主要表现为肢体屈曲、躁动、不正常的舔啃动作[16]; Ⅱ型减压病表现为一个或多个肢体瘫痪, 严重的心肺症状, 甚至死亡。国内也有学者用家兔制备减压病模型, 主要依据行为学、病理学判断减压病的严重程度[14, 16]。随着技术发展和实验目的需要, 减压病动物模型需要更精细、客观的评价体系评估疾病的严重程度。
减压导致机体中产生的气泡是减压病的主要致病因素[23], 通过超声技术检测右心气泡量, 是判断减压后体内气泡负荷最直观的手段。血管内气泡可引起内皮损伤[24], 促使机体炎性水平、凝血功能发生改变, 因此通过多时间点血常规、凝血功能检测可客观反映血液学指标变化。
气泡经右心室进入肺毛细血管床内, 导致肺毛细血管通透性增加等一系列病理反应, 引起肺动脉压升高、呼吸困难和肺水肿, 可通过呼吸功能、肺组织显微病理改变反映肺损伤的严重程度[25]。
神经系统特别是脊髓富含脂质, 是减压病重要的靶器官[26]; Ⅱ型减压病可出现脊髓损伤, 表现为肢体运动及感觉功能障碍, 可通过行为学量化评分, 评估肢体运动功能; 通过脊髓显微病理亦可反映脊髓损伤的严重程度[27]。
在经过筛选的系列检测指标中, 气泡量负荷是反映模型整体减压负荷最直观、最有效的评价指标, 在评估疾病模型严重程度中具有重要意义。呼吸功能评分客观反映减压后动物的呼吸系统变化。肺脏显微病理和肺湿干质量比可进一步评估呼吸系统损伤的严重程度。血液白细胞计数和血清炎性因子检测可用于评估减压导致的炎症反应; 而血小板计数、凝血酶原时间和纤维蛋白原等凝血功能指标检测可从不同方面反映减压后动物的纤溶凝血功能状态。改良Tarlov评分和脊髓显微病理可判断模型中脊髓损伤的严重程度。
综上所述, 本研究成功建立了新西兰白兔减压病模型, 该模型中动物肢体瘫痪率较高, 可用于脊髓型减压病研究。后续研究可根据实验目的, 调整高气压暴露的压力、时间及减压速率以制备出预期严重程度的减压病动物模型。建立的指标评价体系能比较全面地反映动物模型的发病情况, 可根据不同的实验需要选择部分或全部指标评价干预措施的效能。
| [1] |
PAPADOPOULOU V, EVGENIDIS S, ECKERSLEY R J, MESIMERIS T, BALESTRA C, KOSTOGLOU M, et al. Decompression induced bubble dynamics on ex vivo fat and muscle tissue surfaces with a new experimental set up[J]. Colloids Surf B Biointerfaces, 2015, 129: 121-129. DOI:10.1016/j.colsurfb.2015.03.027 |
| [2] |
MAZUR A, LAMBRECHTS K, BUZZACOTT P, WANG Q, BELHOMME M, THERON M, et al. Influence of decompression sickness on vasomotion of isolated rat vessels[J]. Int J Sports Med, 2014, 35: 551-558. |
| [3] |
GRØNNING M, AARLI J A. Neurological effects of deep diving[J]. Neurol Sci, 2011, 304: 17-21. DOI:10.1016/j.jns.2011.01.021 |
| [4] |
HOWLE L E, WEBER P W, HADA E A, VANN R D, DENOBLE P J. The probability and severity of decompression sickness[J/OL]. PLoS One, 2017, 12: e0172665. doi: 10.1371/journal.pone.0172665.
|
| [5] |
GOLDING F C, GRIFFITHS P, HEMPLEMAN H V, PATON W D, WALDER D N. Decompression sickness during construction of the Dartford Tunnel[J]. Br J Ind Med, 1960, 17: 167-180. |
| [6] |
MILANI-NEJAD N, JANSSEN P M. Small and large animal models in cardiac contraction research:advantages and disadvantages[J]. Pharmacol Ther, 2014, 141: 235-249. DOI:10.1016/j.pharmthera.2013.10.007 |
| [7] |
EFTEDAL O, BRUBAKK A O. Agreement between trained and untrained observers in grading intravascular bubble signals in ultrasonic images[J]. Undersea Hyperb Med, 1997, 24: 293-299. |
| [8] |
KERTMEN H, GÜRER B, YILMAZ E R, SANLI A M, SORAR M, ARIKÖKA T, et al. The protective effect of low-dose methotrexate on ischemia-reperfusion injury of the rabbit spinal cord[J]. Eur J Pharmacol, 2013, 714(1/2/3): 148-156. |
| [9] |
ATKINS C E, LEHNER C E, BECK K A, DUBIELZIG R R, NORDHEIM E V, LANPHIER E H. Experimental respiratory decompression sickness in sheep[J]. J Appl Physiol (1985), 1988, 65: 1163-1171. DOI:10.1152/jappl.1988.65.3.1163 |
| [10] |
BELPERIO J A, KEANE M P, BURDICK M D, LONDHE V, XUE Y Y, LI K, et al. Critical role for CXCR2 and CXCR2 ligands during the pathogenesis of ventilator-induced lung injury[J]. J Clin Invest, 2002, 110: 1703-1716. DOI:10.1172/JCI0215849 |
| [11] |
KAPTANOGLU E, PALAOGLU S, SURUCU H S, HAYRAN M, BESKONAKLI E. Ultrastructural scoring of graded acute spinal cord injury in the rat[J]. J Neurosurg, 2002, 97(1 Suppl): 49-56. |
| [12] |
范丹峰, 康志敏, 张荣佳, 蔡志宇, 徐伟刚. 空气潜水减压病大鼠模型的建立[J]. 环境与健康杂志, 2009, 26: 1018-1020. |
| [13] |
庆龙, 衣洪杰, 周全, 王烨炜, ARIYADEWA D K, 徐佳俊, 等. 潜水减压病猪模型的建立及评估[J]. 第二军医大学学报, 2016, 37: 626-630. QING L, YI H J, ZHOU Q, WANG Y W, ARIYADEWA D K, XU J J, et al. Establishment and evaluation of a swine model of diving decompression sickness[J]. Acad J Sec Mil Med Univ, 2016, 37: 626-630. |
| [14] |
高光凯, 吴镝, 石永亮, 杨鹰, 王淑欣, 鲍新平. 快速减压对家兔脊髓组织学的影响[J]. 中华航海医学与高气压医学杂志, 2006, 13: 257-258. DOI:10.3760/cma.j.issn.1009-6906.2006.05.001 |
| [15] |
TANOUE K, MANO Y, KUROIWA K, SUZUKI H, SHIBAYAMA M, YAMAZAKI H. Consumption of platelets in decompression sickness of rabbits[J]. J Appl Physiol (1985), 1987, 62: 1772-1779. DOI:10.1152/jappl.1987.62.5.1772 |
| [16] |
王艳军, 冀仲义, 胡开员. 建立新西兰白兔减压病模型的研究[J]. 中国养兔, 2002(1): 36-37. DOI:10.3969/j.issn.1005-6327.2002.01.018 |
| [17] |
王翠翠, 刘晓红, 毛蕊琪, 曹永成, 毕利泉, 耿明. 减压病兔脑和脊髓组织损伤机制及高压氧疗效[J]. 中华航海医学与高气压医学杂志, 2014, 21: 7-10. DOI:10.3760/cma.j.issn.1009-6906.2014.01.002 |
| [18] |
XU W G, TAO H Y, LIU Y, SUN X J, JIANG C L. Immune function in rats following repetitive exposures to 7 ATA air[J]. Aviat Space Environ Med, 2007, 78: 368-373. |
| [19] |
TOBIAS C A, LOOMIS W F, LAWRENCE J H. Studies on skin temperature and circulation in decompression sickness[J]. Am J Physiol, 1947, 149: 626-633. |
| [20] |
FAHLMAN A, KAYAR S R. Nitrogen load in rats exposed to 8 ATA from 10-35 degrees C does not influence decompression sickness risk[J]. Aviat Space Environ Med, 2006, 77: 795-800. |
| [21] |
BAI Y, MAHON R T, WHITE J C, BRINK P R, CHON K H. Impairment of the autonomic nervous function during decompression sickness in swine[J]. J Appl Physiol (1985), 2009, 106: 1004-1009. DOI:10.1152/japplphysiol.91246.2008 |
| [22] |
FAHLMAN A. Allometric scaling of decompression sickness risk in terrestrial mammals; cardiac output explains risk of decompression sickness[J/OL]. Sci Rep, 2017, 7: 40918. doi: 10.1038/srep40918.
|
| [23] |
NI X X, CAI Z Y, FAN D F, LIU Y, ZHANG R J, LIU S L, et al. Protective effect of hydrogen-rich saline on decompression sickness in rats[J]. Aviat Space Environ Med, 2011, 82: 604-609. DOI:10.3357/ASEM.2964.2011 |
| [24] |
YU X, XU J, HUANG G, ZHANG K, QING L, LIU W, et al. Bubble-induced endothelial microparticles promote endothelial dysfunction[J/OL]. PLoS One, 2017, 12: e0168881. doi: 10.1371/journal.pone.0168881.
|
| [25] |
王前进, 黄奕江, 陈友东, 叶长青, 邵先安, 徐长江, 等. 血必净对兔水下冲击伤致急性肺损伤的治疗作用[J]. 中华创伤杂志, 2017, 33: 945-948. DOI:10.3760/cma.j.issn.1001-8050.2017.10.016 |
| [26] |
AHARON-PERETZ J, ADIR Y, GORDON C R, KOL S, GAL N, MELAMED Y. Spinal cord decompression sickness in sport diving[J]. Arch Neurol, 1993, 50: 753-756. DOI:10.1001/archneur.1993.00540070065017 |
| [27] |
刘伟, 陈武桂, 孙靖, 杨思振, 李松涛, 张莹, 等. 完全性脊髓损伤后脊髓组织病理学变化及其意义[J]. 中华创伤杂志, 2018, 34: 138-144. DOI:10.3760/cma.j.issn.1001-8050.2018.02.008 |
 2018, Vol. 39
2018, Vol. 39


