2. 上海交通大学医学院附属新华医院药学部, 上海 200092;
3. 海军军医大学(第二军医大学)东方肝胆外科医院药材科, 上海 200438
2. Department of Pharmacy, Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China;
3. Department of Pharmacy, Eastern Hepatobiliary Surgery Hospital, Navy Medical University(Second Military Medical University), Shanghai 200438, China
抑郁症是一种与应激密切相关的情感障碍性精神疾病, 其发病机制可能与脑内神经递质功能紊乱相关。5-羟色胺(5-hydroxytryptamine)是一种单胺类神经递质, 与抑郁症的发生最为密切, 其合成、释放、转运、再摄取过程中的异常会导致抑郁症的发生[1-2]。5-羟色胺能神经元广泛存在于中枢神经系统, 由于血脑屏障的作用, 脑脊液中的5-羟色胺只能来自于中枢神经系统, 包括组织间液间接进入和神经元直接释放进入, 但不能来自于外周神经系统[3]; 与血浆相比, 脑脊液中的5-羟色胺及其代谢产物5-羟吲哚乙酸(5-hydroxyindoleacetic acid, 5-HIAA)的含量更能反映其在大脑皮质中的水平。目前常用测定体内5-羟色胺和5-HIAA浓度的方法主要是质谱法[4-5]、高效液相色谱法[6]、电化学法[7]和酶联免疫法[8], 而同时定量抑郁大鼠脑脊液中两种成分的方法鲜有报道。本研究建立一种灵敏、快速、准确的超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem quadrupole mass spectrometry, UPLC-MS/MS)定量方法, 可同时检测大鼠脑脊液中2种成分的含量, 为检测抑郁症指标提供一种有效的方法。
1 材料和方法 1.1 仪器Agilent 1290 InfinityⅡ液相色谱仪, Agilent 6470三重四级杆质谱仪(美国Agilent Technologies公司); 低温高速离心机(德国Thermo公司); XW 80A型涡旋混合器(上海医大仪器有限公司); Mettler AE240十万分之一电子天平(瑞士Mettler Toledo公司); Millipore-Q超纯去离子水净化仪(美国Millipore公司)。
1.2 试剂对照品5-羟色胺(批号:091M5163V)、5-HIAA(批号:BCBG7644V)和内标异丙基去甲肾上腺素(批号:BCBN8508)均购自美国Sigma公司(纯度>99%)。乙腈和甲酸购自美国Sigma公司, 水为超纯去离子水, 其他试剂为市售分析纯。
1.3 动物分组、造模与给药方法雄性SD大鼠24只, 体质量为(160±20)g, 由海军军医大学(第二军医大学)实验动物中心提供, 动物生产许可证号为SCXK(沪)2012-0003。将大鼠随机分为对照组、模型组和氟西汀治疗组, 每组8只。对照组4只/笼饲养, 模型组和氟西汀组单笼饲养, 正常饮食和饮水。采用慢性不可预知温和应激模型作为实验动物模型, 该模型与人类抑郁症临床特征相似, 是迄今为止较为理想的抑郁动物模型[1]。适应3 d后, 按参考文献[9], 使大鼠在35 d内接受以下7种刺激:(1)倾斜45° 24 h; (2)4 ℃冰水游泳5 min; (3)禁食和禁水24 h; (4)夹尾2 min; (5)潮湿垫料24 h; (6)拥挤24 h(12只大鼠/笼); (7)束缚应激6 h。每天给予1种刺激, 顺序随机, 避免大鼠预料下次刺激发生, 共持续35 d。造模第22天开始, 氟西汀治疗组给予2.5 mg/kg氟西汀(含0.5%羧甲基纤维素钠), 其余2组给予等量溶剂, 持续14 d。
1.4 行为学测定造模35 d后进行行为学测定, 包括旷场实验和糖水偏爱实验。(1)旷场实验:将大鼠放入自发活动箱中, 底面有25个10 cm×10 cm的小方格, 从正上方摄像观察, 5 min内大鼠穿越底面的方格数为水平活动得分(4爪均进入的方格才计数), 直立次数作为垂直活动得分(双侧前肢离地1 cm以上), 水平和垂直活动综合得分为总评分。(2)糖水偏爱实验:应激实验结束禁食、禁水12 h后, 单笼饲养大鼠, 给予每只大鼠1瓶2%蔗糖水和1瓶纯净水, 持续4 h, 中途对换两瓶水的位置避免大鼠对饮水位置的偏爱; 按下式计算动物的糖水偏爱百分比:糖水偏爱百分比(%)=糖水消耗量(mL)/总液体消耗量(mL)×100%。
1.5 脑脊液采集行为学实验结束后处死大鼠, 沿硬脑膜易被刺破区域的上缘正中刺入延髓池[10], 抽取脑脊液, 于-80 ℃冰箱保存待用。
1.6 色谱条件色谱柱:ACE C18-PFP(4.6 mm×150 mm, 3 µm); 流动相:A相为乙腈, B相为0.2%甲酸水; 梯度洗脱, 洗脱程序如下:0~2.5 min A:B=20:80, 2.5~4 min A:B=60:40;流速为0.4 mL/min; 平衡时间为2 min; 柱温为25 ℃; 进样量为2 µL。
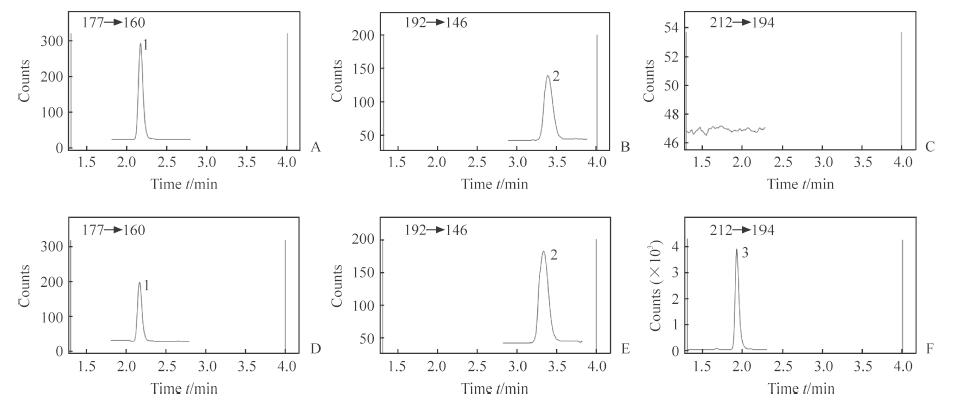
1.7 质谱条件采用AJS ESI正离子模式、动态多反应监测(dynamic multiple reaction monitoring, DMRM)模式进行二级扫描, 离子源参数设置:干燥气温度为350 ℃; 干燥气流速为10 L/min; 雾化器压力为40 psi(1 psi=6 894.7 Pa); 鞘气温度为350 ℃; 鞘气流速为11 L/min; 毛细管电压为4 000 V; 喷嘴电压为2 000 V。DMRM的参数设置:5-羟色胺检测参数177→160, 碎片电压为75 V, 碰撞能量为10 eV; 5-HIAA检测参数192→146, 碎片电压为80 V, 碰撞能量为15 eV; 异丙基去甲肾上腺素(内标)检测参数212→194, 碎片电压为85 V, 碰撞能量为10 eV。5-羟色胺保留时间为2.2 min, 5-HIAA保留时间为3.4 min, 内标保留时间为1.9 min。色谱图如图 1所示。
|
图 1 大鼠脑脊液待测物的动态多反应监测色谱图 Fig 1 Dynamic multiple reaction monitoring chromatogram of analytes in cerebrospinal fluid of rats A-C:Blank cerebrospinal fluid sample; D-F:Authentic sample.1:5-Hydroxytryptamine; 2:5-Hydroxyindoleacetic acid; 3:Internal standard |
1.8 溶液的配制与样品溶液的制备
精密称取5-羟色胺、5-HIAA、异丙基去甲肾上腺素(内标)各10.00 mg, 置于10 mL容量瓶中, 加乙腈(含2%甲酸)溶解并稀释至刻度, 摇匀, 即得3种对照品储备液, 质量浓度均为1.00 mg/mL。分别取适量对照品储备液, 混合置于10 mL容量瓶中, 加乙腈(含2%甲酸)定容, 得混合对照品储备液。再用乙腈(含2%甲酸)依次逐级稀释。配成混合对照品工作溶液, 5-羟色胺质量浓度为2.00、4.00、10.00、20.00、40.00、200.00、400.00、1 000.00、1 600.00、2 000.00 ng/mL, 5-HIAA质量浓度为20.00、40.00、100.00、200.00、400.00、2 000.00、4 000.00、10 000.00、16 000.00、20 000.00 ng/mL, 内标工作液质量浓度为10.00 ng/mL, 保存于4 ℃冰箱待用。
将10份来自不同大鼠的空白脑脊液均匀混合, 分别取10 μL对照品工作液, 加到190 μL空白脑脊液(含内源性待测物)中, 配成5-羟色胺与5-HIAA系列浓度含药脑脊液, 外源性5-羟色胺的质量浓度分别为0.10、0.50、1.00、2.00、10.00、20.00、100.00 ng/mL, 随行质控样品中外源性5-羟色胺的低、中、高质量浓度分别为0.20、50.00、80.00 ng/mL, 外源性5-HIAA的质量浓度分别为1.00、5.00、10.00、20.00、100.00、200.00、1 000.00 ng/mL, 随行样品溶液中外源性5-HIAA的低、中、高质量浓度分别为2.00、500.00、800.00 ng/mL。方法学验证中, 标准曲线、精密度、回收率、稳定性考察均同时平行处理5份空白脑脊液。
1.9 脑脊液样品前处理脑脊液样品采用蛋白沉淀法前处理。精密吸取30 μL样品溶液于1.5 mL EP管中, 加入30 μL内标和30 μL乙腈沉淀剂(含2%甲酸), 涡旋1 min, 4 ℃条件下13 200×g离心10 min; 取上清进样, 进样量为2 µL。
1.10 方法学验证 1.10.1 线性范围按1.8和1.9项的方法制备标准曲线, 平行操作5份, 同时平行处理5份空白脑脊液样品作为测定本底值, 按1.6和1.7项的UPLC-MS/MS条件连续进样分析, 以对照品浓度(X)为横坐标, 5-羟色胺和5-HIAA扣除本底后的峰面积与内标的峰面积比值(Y)为纵坐标拟合回归方程。
1.10.2 精密度与准确度按1.8和1.9项的方法制备低、中、高3种浓度的样品溶液, 平行操作5份, 连续3 d, 根据标准曲线回归方程计算扣除本底峰面积后的实测浓度。
1.10.3 基质效应与提取回收率取空白脑脊液30 µL, 按1.9项方法操作, 制备5份, 以其待测物的峰面积均值作为Set0。另按1.8和1.9项的方法制备低、中、高3种浓度的样品溶液, 平行操作5份, 其待测物的峰面积作为Set3;取处理后的空白脑脊液溶液, 加入一定量质控浓度对照品储备溶液, 使其浓度与Set3的待测理论浓度一致, 分别制备5份, 以其峰面积作为Set2。将待测化合物的混合标准溶液用乙腈稀释, 使之与Set3扣除本底后的待测理论浓度一致, 进样5次, 其峰面积作为Set1。基质效应计算公式为(Set2-Set0)/Set1, 提取回收率计算公式为(Set3-Set0)/(Set2-Set0), 考察内标的基质效应和提取回收率除不用扣除本底, 其余操作步骤同上。
1.10.4 稳定性考察制备低、中、高3个浓度的标准含药脑脊液, 分别考察室温放置6 h后处理, 处理后室温放置24 h, 3次冻融循环以及-80 ℃保存30 d的稳定性, 按1.9项方法测定样品浓度, 并计算相对标准偏差(relative standard deviation, RSD)及相对偏差(relative deviation), 相对偏差=(实测值-真实值)/真实值×100%。
1.11 统计学处理应用SPSS 19.0软件进行统计学分析。呈正态分布的计量资料以x±s表示, 多组间比较采用单因素方差分析, 两组间比较采用LSD法。检验水准(α)为0.05。
2 结果 2.1 行为学结果造模35 d后, 模型组大鼠食欲减退、活动减少、反应迟钝, 而氟西汀组大鼠上述症状明显改善。与对照组比较, 模型组大鼠水平得分、垂直得分、糖水偏爱百分比均降低(P均<0.01);与模型组比较, 氟西汀组大鼠水平得分、垂直得分、糖水偏爱百分比均升高(P均<0.05), 以上结果提示造模成功。见表 1。
|
|
表 1 抑郁大鼠行为学指标的变化 Tab 1 Changes of behavior indicators in depression rats |
2.2 线性范围与最低定量限
5-羟色胺线性回归方程为:Y=0.009 1X-0.003 9, r=0.999, 线性范围为0.10~100.00 ng/mL, 最低定量限为0.10 ng/mL; 5-HIAA线性回归方程为:Y=0.000 6X+0.003 2, r=0.999, 线性范围为1.00~1 000.00 ng/mL, 最低定量限为1.00 ng/mL。
2.3 精密度与准确度实验精密度用RSD表示, 如表 2所示, 5-羟色胺和5-HIAA日内精密度RSD均≤10.08%、日间精密度RSD均≤8.82%;准确度以相对回收率表示, 结果表明5-羟色胺和5-HIAA日内、日间准确度范围在97.83%~113.00%。
|
|
表 2 待测物在大鼠脑脊液中的日间、日内精密度和准确度 Tab 2 Intra- and inter-day accuracy and precision of analytes in cerebrospinal fluid of rats |
2.4 基质效应与提取回收率
低、中、高3种浓度5-羟色胺和5-HIAA待测物及内标提取回收率在86.86%~98.49%, 基质效应在89.80%~95.25%, 见表 3。
|
|
表 3 大鼠脑脊液中待测物及IS的提取回收率和基质效应 Tab 3 Extraction recoveries and matrix effects of analytes and IS in cerebrospinal fluid of rats |
2.5 稳定性考察
5-羟色胺和5-HIAA待测物测定结果的相对偏差范围为-3.90%~8.90%, RSD均<15.00%, 表明样本稳定性良好。
2.6 样品测定结果对抑郁大鼠脑脊液内的5-羟色胺和5-HIAA进行含量测定, 结果见表 4。与对照组比较, 模型组大鼠脑脊液中5-羟色胺的含量降低, 5-HIAA含量上升, 差异均有统计学意义(P均<0.01);与模型组比较, 氟西汀组大鼠脑脊液中5-羟色胺含量上升, 5-HIAA含量降低, 差异均有统计学意义(P均<0.01)。
|
|
表 4 抑郁大鼠脑脊液中5-羟色胺与5-HIAA的含量 Tab 4 Concentrations of 5-hydroxytryptamine and 5-HIAA in cerebrospinal fluid of depression rats |
3 讨论
本实验建立了可同时测定脑脊液样品中5-羟色胺及其代谢产物5-HIAA的UPLC-MS/MS分析方法, 该方法准确度高、操作简单、样品需要量小。由于5-羟色胺为强极性化合物, 在普通C18反相色谱柱中保留较差, 易受样品中杂质干扰而无法获得很好的实验结果。为了避免杂质的干扰, 我们采用了PFP型色谱柱, 延长了样品成分的出峰时间。5-羟色胺易降解, 在流动相和蛋白沉淀剂中加入适量甲酸可增加样品前处理和分析时的稳定性。同时, 流动相采用梯度比例使5-HIAA提前出峰, 降低了单针样品的分析时间。
5-羟色胺和5-HIAA均为内源性物质, 难以获得不含5-羟色胺和5-HIAA的空白脑脊液, 因此在方法学验证和制备随行标准曲线时, 必须将大鼠空白脑脊液中待测物的峰面积作为本底扣除, 以排除内源性物质的干扰。不同大鼠脑脊液中待测物浓度可能不同, 将多只大鼠脑脊液均匀混合作为空白脑脊液, 能避免个体差异对测定结果的影响。本文中的大鼠脑脊液均为同一时间段采集, 可以忽略节律对待测物浓度的影响。
本实验采用目前较为公认的慢性、不可预见性温和刺激抑郁模型, 造模35 d后, 模型组大鼠糖水消耗量、穿越格子数和直立次数均明显减少, 表明造模成功; 氟西汀治疗组大鼠糖水消耗量、穿越格子数和直立次数均明显增加, 表明氟西汀可以改善该造模方法造成的快感丧失和精神运动衰减等抑郁状态。采用UPLC-MS/MS法测定大鼠脑脊液中的5-羟色胺及其代谢产物5-HIAA的水平, 结果表明氟西汀可以增加抑郁模型大鼠脑脊液中5-羟色胺的含量、降低5-HIAA的含量, 表明氟西汀可以通过调节脑内5-羟色胺和5-HIAA的水平达到抗抑郁的作用, 与既往报道[11]一致。
本研究采用UPLC-MS/MS法同时测定慢性不可预见性温和应激模型大鼠脑脊液样品中5-羟色胺和5-HIAA的浓度, 该方法简单、快速, 可用于脑脊液中5-羟色胺和5-HIAA的含量测定。
| [1] |
ZHANG Y, GE J F, WANG F F, LIU F, SHI C, LI N. Crassifoside H improve the depressive-like behavior of rats under chronic unpredictable mild stress:possible involved mechanisms[J]. Brain Res Bull, 2017, 135: 77-84. DOI:10.1016/j.brainresbull.2017.09.015 |
| [2] |
PESARICO A P, SARTORI G, BRÜNING C A, MANTOVANI A C, DUARTE T, ZENI G, et al. A novel isoquinoline compound abolishes chronic unpredictable mild stress-induced depressive-like behavior in mice[J]. Behav Brain Res, 2016, 307: 73-83. DOI:10.1016/j.bbr.2016.03.049 |
| [3] |
蒋文旭, 张励才. 大鼠脑实质内远位触液神经元中5-HT1A受体的分布及其在神经病理性痛中的表达[J]. 生理学报, 2008, 60: 243-248. DOI:10.3321/j.issn:0371-0874.2008.02.013 |
| [4] |
谢天发, 刘长安, 刘健. HPLC-MS/MS检测小鼠脑部组胺和5-羟色胺[J]. 合肥工业大学学报(自然科学版), 2018, 41: 124-128. DOI:10.3969/j.issn.1003-5060.2018.01.023 |
| [5] |
卢金莲, 胡维民, 曹卫群, 陶怡, 张旭敏. 超高效液相色谱-串联质谱法联合衍生化测定大鼠脑透析液中多巴胺和5-羟基色胺[J]. 生物化工, 2017, 13: 35-39. DOI:10.3969/j.issn.2096-0387.2017.06.010 |
| [6] |
吴方园, 华永庆, 郭建明, 丁爱华, 洪敏, 戴岳. 微透析结合柱前衍生化HPLC法动态观察大鼠下丘脑中5-HIAA的变化[J]. 中药药理与临床, 2012, 28: 108-111. |
| [7] |
赵晓蒙, 苏松坤. 高效液相色谱-电化学法检测蜜蜂脑部单胺类神经递质及其酸性代谢产物含量[J]. 福建农林大学学报(自然科学版), 2016, 45: 668-672. |
| [8] |
徐玥, 何昊, 郑蕾, 孙艳平, 陈志雄, 张雅月, 等. 健脾摄血方对ITP小鼠血清神经递质表达影响研究[J]. 世界中西医结合杂志, 2017, 12: 928-932. |
| [9] |
LU Y, HO C S, MCINTYRE R S, WANG W, HO R C. Effects of vortioxetine and fluoxetine on the level of brain derived neurotrophic factors (BDNF) in the hippocampus of chronic unpredictable mild stress-induced depressive rats[J]. Brain Res Bull, 2018, 142: 1-7. DOI:10.1016/j.brainresbull.2018.06.007 |
| [10] |
富宏, 陶迎红, 王学美, 杨金霞, 刘庚信. 经皮穿刺延髓池抽取兔和大鼠脑脊液的方法[J]. 中国比较医学杂志, 2006, 16: 684-687. DOI:10.3969/j.issn.1671-7856.2006.11.014 |
| [11] |
杨帅, 潘晔, 宋彦奇, 高杉, 蔡雪朦, 高树明, 等. 交泰丸对抑郁大鼠行为学及脑内单胺类神经递质的影响[J]. 中草药, 2016, 47: 4218-4223. |
 2018, Vol. 39
2018, Vol. 39


