2. 解放军总医院第六医学中心医务部, 北京 100048;
3. 北部战区陆军参谋部门诊部, 济南 250002;
4. 解放军 91126 部队医院, 大连 116041;
5. 海军军医大学(第二军医大学)长海医院生殖医学中心, 上海 200433
2. Department of Medical Service, Sixth Medical Center, General Hospital of PLA, Beijing 100048, China;
3. Department of Outpatient, Army Staff of PLA Northern Theater Command, Jinan 250002, Shandong, China;
4. No. 91126 Hospital of PLA, Dalian 116041, Liaoning, China;
5. Department of Reproductive Medicine, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China
随着核能在军事、工业、医疗等领域的广泛应用,电离辐射正越来越多地造福于人类,与此同时,其对人类健康的潜在威胁也逐渐成为公众关注的一大问题。在所有类型的辐射损伤中,小剂量电离辐射与人类接触的机会最大,造成的影响也最为广泛。相对于大剂量辐射损伤而言,目前国际上对小剂量电离辐射损伤防护的研究较少,因此该方面研究成为辐射防护领域研究的重中之重,是放射医学界亟待解决的重点、难点问题之一。
根据联合国原子辐射效应科学委员会1986年的报告,低线性能量转移(linear energy transfer,LET)电离辐射按照剂量和剂量率分为2类,即低水平电离辐射(<0.2 Gy且<0.05 mGy/min)和高水平电离辐射(上述条件之外)[1]。低水平电离辐射作用于生物体会产生旁效应[2]、适应性反应[3]、远隔效应[4]、兴奋效应[5]等复杂的生物学效应,对机体往往产生一系列特殊保护作用。而在高水平电离辐射范围内,电离辐射通过直接、间接效应对机体造成损伤,且通常情况下其损伤程度随着吸收剂量的增加而加重,并受到辐射剂量率、组织类型等因素的影响。因此,开展≥0.2 Gy的小剂量电离辐射损伤防护的研究有重要意义。
雄性生殖系统由于增殖、分化旺盛,对小剂量电离辐射极为敏感。而当今社会生活节奏的加快和生活环境的变化使男性生殖健康受到严峻挑战[6],不孕不育发生率持续升高。近年的多项研究显示,全球平均不孕不育患病率超过15%,有些发展中国家甚至超过了30%,其中超过50%由男性因素导致[7-9]。因此,重视并加强对男性生殖系统辐射的防护十分重要。
自从2007年Ohsawa等[10]发现氢分子具有良好的选择性抗氧化能力以来,氢气受到生物医学界的广泛重视。本课题组在国际上首先发现并证明分子氢具有广泛的辐射防护效应,能显著减轻大剂量低LET γ射线对免疫系统、造血系统及心肌组织等造成的损伤[11]。此外,本课题组前期研究又发现分子氢对睾丸组织急性、亚慢性大剂量辐射损伤具有良好的组织学防护作用,并且该作用与提高机体内源性抗氧化水平有关[12-13]。本研究重点验证分子氢对雄性生殖系统急性高水平小剂量辐射损伤是否具有防护作用,并且进一步从性激素调节、DNA损伤修复两个方面探讨分子氢发挥生殖系统辐射防护效应的新机制。
1 材料和方法 1.1 实验对象与分组体外实验以小鼠精原细胞系GC-1 spg细胞为研究对象,细胞购自美国典型培养物保藏中心(ATCC)。细胞培养条件:采用含10%胎牛血清(美国HyClone公司)和1%青霉素-链霉素双抗(美国Gibco公司)的DMEM培养液(美国Gibco公司)于37 ℃、5% CO2、饱和湿度条件下培养。将生长状态良好的对数期细胞分为对照组、加氢组、4 Gy照射组和4 Gy照射加氢组。动物实验采用6~8周龄雄性BALB/c小鼠72只,体质量为(21±2)g,购自中国科学院上海实验动物中心[动物生产许可证号:SCXK(沪)2002-0010]。首先将小鼠在海军军医大学(第二军医大学)海军医学系舰船辐射医学防护教研室动物培养房适应性饲养1周,摄食、饮水自由,随后随机分为6组:对照组、加氢组、0.25 Gy照射组、0.25 Gy照射加氢组、0.5 Gy照射组、0.5 Gy照射加氢组,每组12只。
1.2 氢气处理综合应用多种方法进行氢分子给药处理。对于细胞实验,采用改进的富氢溶液培养法[14]:用加压装置将充入纯氢气的无菌DMEM培养液加压(0.4 MPa)4 h以上,使其饱和溶解,制作富氢培养液。利用氢气浓度测试电极检测富氢培养液中的氢浓度达到过饱和浓度(0.814 mmol/L)。照射前,加氢组和照射加氢组细胞以富氢培养液孵育1 h,而对照组和照射组细胞以普通DMEM培养液同时孵育1 h,随后进行照射。对于动物实验,采用饮用富氢水联合呼吸高浓度氢气法:以产氢棒(上海水素环保科技有限公司)连续制备富氢水,小鼠自由摄取;利用氢氧呼吸器(AMS-H-01氢氧气雾化机,上海潓美医疗科技有限公司)使小鼠每天定时呼吸1 h高浓度氢气(66%)。
1.3 照射处理应用海军军医大学(第二军医大学)海军医学系辐照中心60Co γ辐照源进行照射。细胞实验照射剂量为4 Gy,剂量率为0.96 Gy/min,照射时间为250 s;动物实验照射剂量、剂量率分别为0.25 Gy、4.17 mGy/min和0.5 Gy、8.33 mGy/min,照射时间均为1 h。将小鼠放置于通风良好的塑料鼠笼内进行照射,照射期间小鼠短暂禁食、禁水,完成照射后立即放回原来鼠笼内,自由摄食、饮水。
1.4 细胞凋亡检测采用流式细胞术结合膜联蛋白Ⅴ(annexin Ⅴ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒(北京全式金生物技术有限公司)检测GC-1 spg细胞的凋亡情况。细胞照射处理后24 h用磷酸盐缓冲液(phosphate buffer saline, PBS)润洗,用不含乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)的胰酶消化重悬制备单细胞悬液(约2×105~2×106个细胞),再次润洗、离心后以100 μL 1×结合缓冲液重悬,加入5 μL的annexin Ⅴ-FITC轻轻混匀,室温下避光孵育15 min。上机检测前,加入5 μL PI轻轻混匀,然后加入400 μL 1×annexin Ⅴ-FITC结合缓冲液轻轻吹打混匀,用流式细胞仪(美国Beckman Coulter公司)检测荧光信号。
1.5 组织病理学染色分析各组小鼠经相应处理后24 h,每组取6只小鼠经内眦静脉取血后以颈椎脱臼法处死,分离双侧睾丸用PBS润洗,4%多聚甲醛溶液4 ℃下摇床过夜固定。次日用PBS润洗后浸入70%乙醇保存。制片和染色:依次进行梯度乙醇脱水(每个梯度浓度1 h)、二甲苯透明、浸蜡、石蜡包埋、切片(4 μm厚度)、粘片、脱蜡和H-E染色,最后于光学显微镜(日本Olympus公司BX51型)下拍照、分析。
1.6 小鼠性激素检测照射后24 h,各处理组取6只小鼠,经内眦静脉取血,静置、离心,分离血清样本待测。采用酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测小鼠促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)、卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)以及血清睾酮(testosterone)的含量,按照ELISA试剂盒(上海西唐生物科技有限公司)说明书进行上述指标含量测定。
1.7 小鼠精子彗星电泳实验用彗星电泳实验检测小鼠照射损伤后分子氢对其精子DNA损伤的保护作用,采用“玻片双层凝胶法”以中性细胞裂解液开展进行(精子DNA在碱性条件下极易断裂而造成干扰,故不适合碱性细胞裂解液电泳)。提前以磨砂载玻片铺单层0.75%的正熔点胶制备底胶载玻片。照射后4周的小鼠经颈椎脱臼法处死,分离双侧附睾,于PBS中剪3~4刀后置于37 ℃下使精子游出。随后,用200目钢筛过滤,得到精子悬液,置于37 ℃下待用。取400 μL精子悬液与等量的37 ℃ 0.5%的低熔点胶混匀后在底胶载玻片上铺片,加盖玻片,4 ℃凝固5~8 min。去掉盖玻片后,先后经过裂解(4 ℃,3 h)、润洗、解旋(4 ℃,20 min),最后进行彗星电泳(4 ℃,25 min,25 V,300 mA)。电泳完毕后润洗2次,避光染色10 min(2 μg/mL的PI,以PBS溶解)。润洗后于荧光显微镜下拍照,以CaspLab软件进行定量分析[15]。
1.8 统计学处理应用Excel、SPSS 21.0软件进行数据处理,采用GraphPad Prism 6.0软件绘图。实验数据以x±s表示,两组间比较采用两独立样本t检验。双侧检验,检验水准(α)为0.05。
2 结果 2.1 体外培养GC-1 spg细胞照射后的凋亡率加氢组体外培养GC-1 spg细胞照射后24 h的凋亡率与对照组相比未见明显变化,差异无统计学意义(P>0.05);当给予4 Gy照射组细胞4 Gy急性照射后,24 h的凋亡率较对照组升高,差异有统计学意义(t=8.914,P<0.01);而4 Gy照射加氢组细胞24 h凋亡率较4 Gy照射组下降,差异有统计学意义(t=7.186,P<0.01)。见图 1。

|
图 1 分子氢处理降低电离辐射导致的小鼠精原细胞系GC-1 spg的凋亡 Fig 1 Molecular hydrogen decreases irradiation-induced apoptosis of mouse spermatogonia-derived cell line GC-1 spg A: Descriptive outcome; B: Quantitative data.**P < 0.01 vs control group; △△P < 0.01 vs 4 Gy radiation group. n=3, x±s |
2.2 小鼠睾丸组织学分析结果
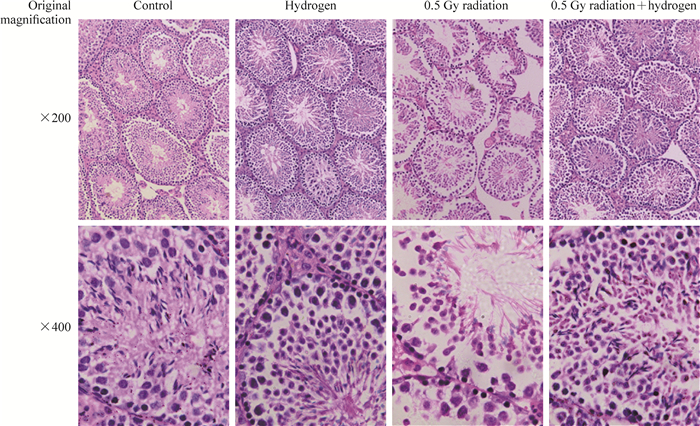
H-E染色结果(图 2)显示,0.5 Gy照射即可引起小鼠睾丸组织损伤。与对照组相比,0.5 Gy照射组睾丸曲精小管内各级生精细胞密度降低,生精上皮变薄,空泡数目增加,间质细胞数目降低,结构紊乱;而0.5 Gy照射加氢组上述损伤情况明显缓解,镜下结构与对照组相似。
|
图 2 分子氢减轻小剂量辐射导致的小鼠睾丸组织损伤(H-E染色) Fig 2 Molecular hydrogen alleviates low-dose irradiation-induced histological damage of mouse testis (H-E staining) |
2.3 小鼠性激素检测结果
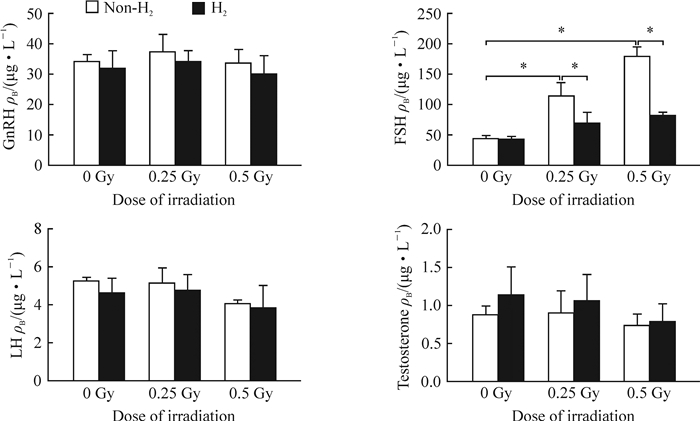
小鼠性激素检测结果显示,小剂量电离辐射引起FSH水平呈剂量依赖性升高,而分子氢处理可改善各剂量组照射后FSH的升高状态,差异均有统计学意义(t0.25 Gy=3.195 8,P0.25 Gy=0.019;t0.5 Gy=10.723 4,P0.5 Gy<0.05)。但小剂量电离辐射对GnRH、LH和睾酮均无明显影响,且分子氢处理对三者也未见明显干扰。见图 3。
|
图 3 分子氢对小剂量电离辐射导致的雄性小鼠激素水平紊乱的调节作用 Fig 3 Molecular hydrogen adjusts disturbances of mouse androgenic hormone caused by low-dose irradiation GnRH: Gonadotropin-releasing hormone; FSH: Follicle-stimulating hormone; LH: Luteinizing hormone. *P < 0.05. n=6, x±s |
2.4 小鼠精子彗星电泳实验结果
如图 4A所示,0.25 Gy γ射线即引起小鼠精子DNA彗星拖尾程度明显增加,0.5 Gy照射组其拖尾程度更严重;而给予分子氢处理后,DNA彗星拖尾程度明显减轻。用CaspLab软件对彗星图像进行定量分析,结果(图 4B)显示,各定量指标(尾部面积、尾部DNA含量、尾部DNA百分含量、尾长、尾矩、Olive尾矩)随着照射剂量(0.25、0.5 Gy)的增加而增加,与对照组比较差异均有统计学意义(尾部面积:t0.25 Gy=44.009 4,t0.5 Gy=69.544 8;尾部DNA含量:t0.25 Gy=28.767 6,t0.5 Gy=59.318 7;尾部DNA百分含量:t0.25 Gy=61.621 8,t0.5 Gy=73.249 0;尾长:t0.25 Gy=27.883 8,t0.5 Gy=38.303 6;尾矩:t0.25 Gy=47.157 3,t0.5 Gy=70.787 7;Olive尾矩:t0.25 Gy=54.736 5,t0.5 Gy=66.889 6;P均<0.05);并且在0.25 Gy和0.5 Gy剂量组中,分子氢处理均能抑制上述指标的升高,与照射组相比差异均有统计学意义(尾部面积:t0.25 Gy=16.592 3,t0.5 Gy=15.891 5;尾部DNA含量:t0.25 Gy=11.296 5,t0.5 Gy=13.785 0;尾部DNA百分含量:t0.25 Gy=26.834 0,t0.5 Gy=10.325 7;尾长:t0.25 Gy=16.865 4,t0.5 Gy=15.441 2;尾矩:t0.25 Gy=26.979 4,t0.5 Gy=13.174 2;Olive尾矩:t0.25 Gy=24.752 4,t0.5 Gy=6.896 1;P均<0.05)。

|
图 4 分子氢减轻了小剂量辐射导致的小鼠精子DNA损伤 Fig 4 Molecular hydrogen alleviates sperm DNA damage induced by low-dose irradiation A: Representative pictures; B-G: A series of quantitative indicators of comet assay. *P < 0.05. n=6, x±s |
3 讨论
精子发生(spermatogenesis)是一个受到精密调控的复杂过程,其大致可分为3个阶段:精原细胞增殖期、精母细胞减数分裂期以及精子形成期。而按照从睾丸曲精小管管壁到管腔中央的空间顺序,一个精子的形成要经历从精原细胞(spermatogonia)、精母细胞(spermatocyte)、精子细胞(spermatid)到精子(spermatozoa)4个阶段[16]。研究表明,剂量低至0.025 Gy的电离辐射即可造成睾丸生殖细胞尤其是精原细胞的快速凋亡[17]。本课题组前期实验结果显示电离辐射显著增加了精子畸形率、降低了精子数目,而氢气则很好地扭转了这些损伤[13]。由于精子细胞和精子对电离辐射相对耐受,而精原细胞对电离辐射敏感性高[18]。因此,我们推测射线通过杀伤精原细胞导致了相应精子发育周期之后的精子损伤(小鼠周期约35 d)。本实验中,我们首先检测了体外培养的小鼠精原细胞系GC-1 spg受高水平小剂量(4 Gy)照射之后的凋亡损伤情况。结果显示照射后GC-1 spg细胞24 h凋亡率升高(P<0.01),且能够被分子氢有效降低(P<0.01),说明分子氢很可能通过减少照射后精原细胞凋亡而发挥对生殖系统尤其是精子的防护作用,从而进一步验证了分子氢对雄性生殖系统的辐射防护作用,深化了对其作用机制的理解。
为确证分子氢对睾丸急性高水平小剂量辐射损伤的防护效果,我们开展了体内动物实验。H-E染色结果显示0.5 Gy照射引起了小鼠睾丸组织的明显损伤,而分子氢减弱了该损伤情况,说明分子氢在体内水平对睾丸组织有良好的防护效果。然而,在0.25 Gy照射组,我们并未发现睾丸组织H-E染色明显异常(未展示图片),推测其原因并非一定是0.25 Gy急性照射未造成睾丸组织的损伤,而可能由于H-E染色实验本身的敏感性不够所致。对该部分实验,我们后期还要继续改进实验方法,选用更敏感的实验手段对其进行检测。
睾丸属于辐射高度敏感器官,而生精上皮又是睾丸组织中对射线最敏感的组织结构,受到电离辐射后极易引起生殖内分泌功能障碍[19]。我们通过对下丘脑GnRH,垂体FSH、LH,以及性腺分泌的睾酮分别进行检测,较为完整地反映了下丘脑-垂体-性腺轴在辐射损伤及氢分子辐射防护作用中充当的重要角色。精子发生是在下丘脑-垂体-性腺轴的调控下进行的:下丘脑通过分泌GnRH作用于垂体,使其分泌FSH和LH,前者对生精过程起到始动作用,后者通过睾酮发挥调节功能,具有维持生精的作用。由于FSH主要作用于生精细胞和支持细胞,而LH主要作用于间质细胞,因此,当对射线相对敏感的生精细胞、支持细胞受损后,支持细胞分泌的抑制素水平下降,失去对垂体的负反馈调节作用,导致血清FSH水平升高;而间质细胞对射线相对耐受,因此LH和睾酮等水平波动不大。文献报道血清中FSH水平的升高程度与睾丸中生精上皮辐射损伤的程度呈正相关,而LH水平的升高程度则与间质细胞辐射损伤程度呈正相关[20];本实验中,照射后小鼠血清FSH水平升高(P<0.05),且能被分子氢缓解(P<0.05);而LH、睾酮水平无明显变化,与既往报道一致。说明分子氢通过保护生精上皮纠正照射后雄激素水平失衡,从而发挥对雄性生殖系统的辐射防护作用。
众所周知,电离辐射对生物体造成损伤主要是通过直接、间接效应发挥的,2/3的电离辐射生物学效应由后者导致[21],主要通过射线能量沉积致使毒性自由基和活性氧增多,造成蛋白质、核酸等生物大分子损伤,而其中DNA双链损伤与辐射导致的细胞凋亡等严重生物学事件关系最为密切[22]。精子DNA损伤与男性不育关系密切,并且能够增加后代罹患遗传性疾病的风险[23]。彗星电泳实验能够很好地反映细胞DNA物理损伤情况,相对53BP1/γH2AX焦点检测等更能避免其他因素对损伤修复过程造成的干扰而引起误差[21]。因此,结合文献报道[24-25],我们选用中性单细胞凝胶电泳实验检测了小鼠精子的DNA损伤情况。结果显示,小剂量的电离辐射(0.25 Gy、0.5 Gy)即引起照射后小鼠精子DNA拖尾程度增加,各定量指标(尾部面积、尾部DNA含量、尾部DNA百分含量、尾长、尾矩、Olive尾矩)均升高(P均<0.05);而分子氢改善了这些损伤状况(P均<0.05)。实验结果再次显示了小剂量电离辐射对雄性生殖系统严重的损伤能力,并且提示分子氢可以很好地促进小剂量电离辐射造成的生精细胞DNA损伤修复,减弱DNA结构的物理损坏,减轻精子DNA辐射损伤。
血睾屏障由处于曲细精管管腔和间质毛细血管腔之间的毛细血管、淋巴管的内皮细胞和基底膜、肌样细胞、曲细精管基底膜和支持细胞等多种结构构成。血睾屏障在正常精子发生过程中承担着重要作用,是保证精子发生微环境、形成免疫屏障等关键生理作用的核心结构。而血睾屏障的存在也在一定程度上降低了相关药物进入曲细精管管腔的浓度,影响药效。分子氢是自然界中结构最简单的分子,其穿透性极强,具备穿透血睾屏障、血脑屏障等生物学组织的特性,可直接作用于曲细精管管腔内细胞而充分发挥选择性抗氧化、抗炎等生物学效应。本实验重点观察了分子氢对高水平小剂量急性辐射损伤的防护作用,并且揭示其可能通过减轻照射后精原细胞凋亡、调节FSH失衡、促进精子DNA损伤修复等方式达到其防护作用的新机制,为分子氢用作男性生殖系统小剂量电离辐射损伤防护剂提供了理论参考和实验支撑。然而,由于本实验检测指标尚不够完全,研究深度亦有待提高,因此,在今后的研究中,我们将进一步开展相关实验对其机制进行深入探索。
| [1] |
METTLER F A, SINCLAIR W K, ANSPAUGH L, EDINGTON C, HARLEY J H, RICKS R C, et al. The 1986 and 1988 UNSCEAR (United Nations Scientific Committee on the Effects of Atomic Radiation) reports:findings and implications[J]. Health Phys, 1990, 58: 241-250. DOI:10.1097/00004032-199003000-00001 |
| [2] |
SETH I, SCHWARTZ J L, STEWART R D, EMERY R, JOINER M C, TUCKER J D. Neutron exposures in human cells: bystander effect and relative biological effectiveness[J/OL]. PLoS One, 2014, 9: e98947. doi: 10.1371/journal.pone.0098947.
|
| [3] |
SEONG J, KIM S H, PYO H R, CHUNG E J, SUH C O. Effect of low-dose irradiation on induction of an apoptotic adaptive response in the murine system[J]. Radiat Environ Biophys, 2001, 40: 335-339. DOI:10.1007/s00411-001-0122-7 |
| [4] |
GOLDEN E B, DEMARIA S, SCHIFF P B, CHACHOUA A, FORMENTI S C. An abscopal response to radiation and ipilimumab in a patient with metastatic non-small cell lung cancer[J]. Cancer Immunol Res, 2013, 1: 365-372. DOI:10.1158/2326-6066.CIR-13-0115 |
| [5] |
YU H S, LIU Z M, YU X Y, SONG A Q, LIU N, WANG H. Low-dose radiation induces antitumor effects and erythrocyte system hormesis[J]. Asian Pac J Cancer Prev, 2013, 14: 4121-4126. DOI:10.7314/APJCP.2013.14.7.4121 |
| [6] |
BONDE J P. Male reproductive organs are at risk from environmental hazards[J]. Asian J Androl, 2010, 12: 152-156. DOI:10.1038/aja.2009.83 |
| [7] |
BOISSONNAS C C, JOUANNET P, JAMMES H. Epigenetic disorders and male subfertility[J]. Fertil Steril, 2013, 99: 624-631. DOI:10.1016/j.fertnstert.2013.01.124 |
| [8] |
OMBELET W, COOKE I, DYER S, SEROUR G, DEVROEY P. Infertility and the provision of infertility medical services in developing countries[J]. Hum Reprod Update, 2008, 14: 605-621. DOI:10.1093/humupd/dmn042 |
| [9] |
INHORN M C, PATRIZIO P. Infertility around the globe:new thinking on gender, reproductive technologies and global movements in the 21st century[J]. Hum Reprod Update, 2015, 21: 411-426. DOI:10.1093/humupd/dmv016 |
| [10] |
OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688-694. DOI:10.1038/nm1577 |
| [11] |
YANG Y, LI B, LIU C, CHUAI Y, LEI J, GAO F, et al. Hydrogen-rich saline protects immunocytes from radiation-induced apoptosis[J]. Med Sci Monit, 2012, 18: BR144-BR148. |
| [12] |
CHUAI Y, GAO F, LI B, ZHAO L, QIAN L, CAO F, et al. Hydrogen-rich saline attenuates radiation-induced male germ cell loss in mice through reducing hydroxyl radicals[J]. Biochem J, 2012, 442: 49-56. DOI:10.1042/BJ20111786 |
| [13] |
GUO J, ZHAO D, LEI X, ZHAO H, YANG Y, ZHANG P, et al. Protective effects of hydrogen against low-dose long-term radiation-induced damage to the behavioral performances, hematopoietic system, genital system, and splenic lymphocytes in mice[J/OL]. Oxid Med Cell Longev, 2016, 2016: 1947819. doi: 10.1155/2016/1947819.
|
| [14] |
郭佳铭, 杨彦勇, 刘文, 高福, 蔡建明, 赵华林, 等. 富H2溶液对人肾小管上皮细胞辐射损伤的防护作用[J]. 第二军医大学学报, 2014, 35: 963-967. GUO J M, YANG Y Y, LIU W, GAO F, CAI J M, ZHAO H L, et al. Protective effects of hydrogen-rich saline against γ-ray irradiation-induced injury in kidney epithelial HK-2 cells[J]. Acad J Sec Mil Med Univ, 2014, 35: 963-967. |
| [15] |
GUO J, CHEN Y, LEI X, XU Y, LIU Z, CAI J, et al. Monophosphoryl lipid a attenuates radiation injury through TLR4 activation[J]. Oncotarget, 2017, 8: 86031-86042. |
| [16] |
刘光伟.低剂量电离辐射对小鼠睾丸生精细胞凋亡的影响及其基因调控[D].长春: 吉林大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10183-2004100145.htm
|
| [17] |
OTALA M, SUOMALAINEN L, PENTIKÄINEN M O, KOVANEN P, TENHUNEN M, ERKKILÄ K, et al. Protection from radiation-induced male germ cell loss by sphingosine-1-phosphate[J]. Biol Reprod, 2004, 70: 759-767. DOI:10.1095/biolreprod.103.021840 |
| [18] |
GLIKI G, EBNET K, AURRAND-LIONS M, IMHOF B A, ADAMS R H. Spermatid differentiation requires the assembly of a cell polarity complex downstream of junctional adhesion molecule-C[J]. Nature, 2004, 431: 320-324. DOI:10.1038/nature02877 |
| [19] |
GRIGNARD E, GUÉGUEN Y, GRISON S, DUBLINEAU I, GOURMELON P, SOUIDI M. Testicular steroidogenesis is not altered by 137 cesium Chernobyl fallout, following in utero or post-natal chronic exposure[J]. C R Biol, 2010, 333: 416-423. DOI:10.1016/j.crvi.2010.02.003 |
| [20] |
廖黎黎, 黄永汉, 何磊, 梁小丽, 徐杰伟. 无精子症患者睾丸生精功能与血清性激素水平的相关性分析[J]. 中国优生与遗传杂志, 2015, 23: 108-109. |
| [21] |
KURASHIGE T, SHIMAMURA M, NAGAYAMA Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/γH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine[J]. J Radiat Res, 2016, 57: 312-317. DOI:10.1093/jrr/rrw001 |
| [22] |
陈倩倩, 汪黎, 尚增甫, 刘晓丹, 王豫, 郑红, 等. 香兰素衍生物VN D3207对α粒子辐射诱发人成纤维细胞基因组DNA损伤的防护研究[J]. 科技导报, 2010, 28: 31-36. |
| [23] |
ZINI A, BIELECKI R, PHANG D, ZENZES M T. Correlations between two markers of sperm DNA integrity, DNA denaturation and DNA fragmentation, in fertile and infertile men[J]. Fertil Steril, 2001, 75: 674-677. DOI:10.1016/S0015-0282(00)01796-9 |
| [24] |
李红, 杨学农, 李文平. 精子DNA损伤的研究进展及临床价值[J]. 中国计划生育学杂志, 2008, 16: 575-576. DOI:10.3969/j.issn.1004-8189.2008.09.025 |
| [25] |
BERTOLLA R P, CEDENHO A P, HASSUN FILHO P A, LIMA S B, ORTIZ V, SROUGI M. Sperm nuclear DNA fragmentation in adolescents with varicocele[J]. Fertil Steril, 2006, 85: 625-628. DOI:10.1016/j.fertnstert.2005.08.032 |
 2018, Vol. 39
2018, Vol. 39


