2. 江苏大学生命科学研究院, 镇江 212013
2. Institute of Life Sciences, Jiangsu University, Zhenjiang 212013, Jiangsu, China
肝癌是我国常见的恶性肿瘤之一,其发病率和病死率均较高,严重威胁着国民的健康。肝癌发病机制复杂,其中蛋白质丝氨酸/苏氨酸激酶AKT信号转导通路的过度活化在肝癌的发生中起着至关重要的调控作用[1]。同时,AKT信号通路在肿瘤细胞周期调控、增殖、凋亡、能量代谢等多种细胞生命活动中均发挥重要作用[1-2]。有研究报道,AKT抑制剂能有效抑制肿瘤细胞的生长,同时促使其凋亡,具有广阔的临床应用前景[3-4]。GSK2141795是一种AKT广谱抑制剂,能有效抑制AKT活性。本研究选取人肝癌细胞株Huh7进行体外实验,初步探讨不同GSK2141795浓度及作用时间对Huh7细胞的生物学效应,为后续实验中AKT抑制剂的使用提供参考。
1 材料和方法 1.1 材料与仪器人肝癌细胞株Huh7为海军军医大学(第二军医大学)长海医院实验诊断科保存;DMEM培养基和胎牛血清均购自美国Gibco公司;AKT抑制剂GSK2141795购自美国MCE公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自上海博光生物科技有限公司;AKT(货号A3154)、磷酸化AKTS473(p-AKTS473,货号AP0655)、Bad(货号A0741)、Bcl-2(货号A0208)、Caspase-9(货号A2636)和GAPDH(货号AC027)抗体均购自武汉爱博泰克生物科技有限公司;流式细胞仪(BD FACSCantoTM Ⅱ Flow Cytometer)及细胞凋亡检测试剂盒购自美国BD Biosciences公司。
1.2 细胞培养及实验分组人肝癌细胞株Huh7用含10%胎牛血清的DMEM培养液在37 ℃、5% CO2培养箱中培养。取对数生长期的细胞接种于6孔细胞培养板中,待细胞融合度达60%时,实验组分别加入终浓度为0.3、1、3、10、30 μmol/L的GSK2141795,对照组(0 μmol/L)加入等体积的DMSO,继续培养24 h,检测各组细胞凋亡和相关蛋白与基因的表达情况。另取对数生长期的细胞接种于6孔细胞培养板中,实验组加入终浓度为10 μmol/L的GSK2141795分别培养2、6、12、24和48 h,对照组(0 h)加入等体积的DMSO培养,检测各组细胞凋亡和相关蛋白与基因的表达情况。
1.3 流式细胞术检测细胞凋亡收集贴壁和悬浮细胞,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤2次,根据流式细胞术商品化试剂盒的使用说明进行膜联蛋白Ⅴ(annexinⅤ)/碘化丙啶(propidium iodide,PI)染色后,上机检测。
1.4 蛋白质印迹法检测相关蛋白表达收集细胞,加入200 μL蛋白裂解液,用BCA法检测蛋白浓度。取等量蛋白上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。将蛋白转移至聚偏氟乙烯膜上,用5%脱脂奶粉溶液封闭1 h后,分别加入相应抗体(稀释比例为1:1 000),于4 ℃下孵育过夜。用TBST洗涤后加入相应二抗,室温孵育1 h后加入化学发光试剂,利用ImageQuant LAS 4000化学发光成像仪进行显像。
1.5 qPCR检测相关基因的表达收集细胞,使用RNAfast200总RNA快速抽提试剂盒(上海飞捷生物技术有限公司)提取总RNA,按照PrimeScriptTM RT Master Mix试剂盒(日本TaKaRa公司)操作说明,反转录合成cDNA。以β-actin为内参基因,使用SYBR® Premix Ex TaqTMⅡ试剂盒(日本TaKaRa公司)在LightCycle 480 qPCR系统(美国Roche公司)中进行扩增。采用2-ΔΔCt法对目标基因表达水平进行相对定量分析。引物序列:Bad上游5′-CGA GTG AGC AGG AAG ACT CC-3′,下游5′-CAC CAG GAC TGG AAG ACT CG-3′;Bcl-2上游5′-TGT GTG TGG AGA GCG TCA AC-3′,下游5′-GAA ATC AAA CAG AGG CCG CAT-3′;Caspase-9上游5′-TCA CAG ACC TTG AGA CCC GA-3′,下游5′-GAC GGG TCC AGC TTC ACT A C-3′;内参β-actin上游5′-CAT GTA CGT TGC TAT CCA GGC-3′,下游5′-CTC CTT AAT GTC ACG CAC GAT-3′。
1.6 统计学处理应用SPSS 19.0软件进行数据分析。所有数据均以x±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 GSK2141795呈剂量依赖性诱导Huh7细胞凋亡与对照组(0 μmol/L)相比,不同浓度GSK2141795处理Huh7细胞24 h后,细胞形态发生明显改变,细胞发生皱缩、变形,细胞膜完整,胞内出现空泡,同时部分贴壁细胞变圆、脱落,漂浮于培养液表面。随着GSK2141795浓度的增加,细胞形态变化趋势越明显,提示GSK2141795处理能诱导Huh7细胞凋亡。蛋白质印迹分析结果(图 1A)显示,与对照组相比,随着GSK2141795浓度的增加,实验组细胞中AKT蛋白的表达水平逐渐降低,p-AKTS473蛋白表达水平逐渐升高,呈一定的剂量依赖性。终浓度为30 μmol/L的GSK2141795处理24 h后细胞出现大量凋亡,无法提取蛋白,故未行相关蛋白表达水平的检测。流式细胞术检测结果见图 1B。终浓度为0.3 μmol/L的GSK2141795处理Huh7细胞24 h后,其细胞凋亡比例与对照组比较差异无统计学意义[(4.19±0.85)% vs(4.50±0.28)%,P>0.05];终浓度为1 μmol/L时,细胞凋亡比例开始增加[(9.17±1.32)%];终浓度为3 μmol/L时,细胞凋亡比例达到(17.64±3.11)%;终浓度为10、30 μmol/L时,细胞凋亡比例均超过50.00%,分别为(62.70±8.57)%、(61.75±6.09)%。终浓度为1、3、10、30 μmol/L时的细胞凋亡比例与对照组比较差异均有统计学意义(P均<0.05)。qPCR(图 1C)与蛋白质印迹检测结果(图 1D)显示,不同浓度GSK2141795处理24 h后,Huh7细胞中Bad和Caspase-9在mRNA和蛋白水平上表达均升高,Bcl-2在mRNA和蛋白水平上表达水平均降低,呈一定的剂量依赖性,提示GSK2141795可能通过Bad-Bcl-2通路诱导Huh7细胞发生凋亡。

|
图 1 不同终浓度的GSK2141795作用人肝癌细胞株Huh7 24 h后对细胞凋亡的影响 Fig 1 Effects of GSK2141795 at different concentrations on apoptosis of human hepatocellular carcinoma cell line Huh7 after 24 h treatment A: Protein expression of AKT and AKT phosphorylation on Ser-473 (p-AKTS473) by Western blotting; B: Apoptosis of Huh7 cells by flow cytometry; C: mRNA expression of Bad, Bcl-2 and Caspase-9 by qPCR; D: Protein expression of Bad, Bcl-2 and Caspase-9 by Western blotting. AKT: A kind of protein serine/threonine kinase. *P < 0.05, **P < 0.01 vs 0 μmol/L (control) group. n=3, x±s |
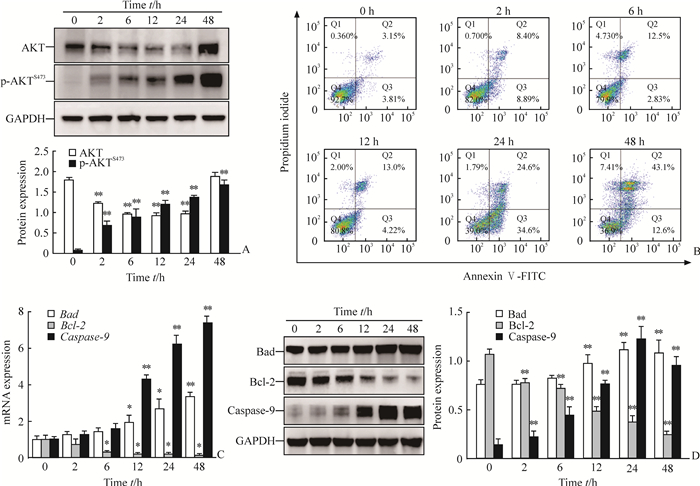
2.2 GSK2141795呈时间依赖性诱导Huh7细胞凋亡
以10 μmol/L GSK2141795分别处理Huh7细胞不同时间,蛋白质印迹分析结果(图 2A)显示,0~24 h时AKT蛋白的表达水平呈逐渐降低趋势,p-AKTS473蛋白的表达水平呈逐渐升高趋势;48 h时AKT蛋白的表达水平上升,且较对照组(0 h)明显升高,p-AKTS473蛋白的表达水平也升高。流式细胞术检测结果见图 2B。10 μmol/L GSK2141795处理Huh7细胞2、6、12 h后,细胞凋亡比例分别为(17.29±2.13)%、(15.33±1.59)%、(17.22±3.06)%,与对照组比较差异均有统计学意义(P均<0.05);处理细胞24、48 h后,细胞凋亡比例进一步升高,分别达(59.20±5.72)%、(55.70±7.16)%,与对照组比较差异均有统计学意义(P均<0.01),虽然24 h和48 h两组间细胞凋亡比例差异无统计学意义(P>0.05),但药物处理48 h后晚期细胞凋亡比例高于药物处理24 h后的晚期细胞凋亡比例[(43.1±2.77)% vs(24.6±1.52)%,P<0.05]。结果提示随着药物作用时间的延长,细胞凋亡逐渐加重,从早期凋亡向晚期凋亡发展。qPCR(图 2C)与蛋白质印迹分析结果(图 2D)显示,随着GSK2141795作用时间的延长,Huh7细胞中Bad、Caspase-9的mRNA及蛋白表达水平逐渐升高,Bcl-2的mRNA及蛋白表达水平逐渐下降,呈一定的时间依赖性。
|
图 2 10 μmol/L GSK2141795作用不同时间后对人肝癌细胞株Huh7凋亡的影响 Fig 2 Effect of 10 μmol/L GSK2141795 on apoptosis of human hepatocellular carcinoma cell line Huh7 at different time points A: Protein expression of AKT and AKT phosphorylation on Ser-473 (p-AKTS473) by Western blotting; B: Apoptosis of Huh7 cells by flow cytometry; C: mRNA expression of Bad, Bcl-2 and Caspase-9 by qPCR; D: Protein expression of Bad, Bcl-2 and Caspase-9 by Western blotting. AKT: A kind of protein serine/threonine kinase. *P < 0.05, **P < 0.01 vs 0 h (control) group. n=3, x±s |
3 讨论
AKT家族包含AKT1、AKT2和AKT3 3个亚型,其中AKT1主要参与细胞增殖[5],AKT2与胰岛素信号通路相关[6],AKT3则在大脑发育中具有重要作用[7]。AKT及其下游相关分子异常活化是肝癌中重要的信号通路之一[1],对肿瘤患者的病程进展及后续治疗起到至关重要的作用[8-10]。针对AKT信号通路,研究人员目前已研发出多种类型的抑制剂,并开展了临床研究[11]。如哌立福辛为烷基磷胆碱磷脂衍生物,其不仅能抑制AKT相关信号通路,对丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)通路也有一定的抑制作用[12],已有多项临床试验表明哌立福辛对实体肿瘤及恶性血液系统疾病具有治疗作用[13-16]。GSK2141795为一种广谱AKT抑制剂,能有效抑制AKT1/2/3的活性,已开展相关临床研究[17]。近期有研究人员通过招募伴有AKT突变的子宫内膜癌或前列腺癌患者,对GSK2141795的推荐Ⅱ期剂量进行探索,结果显示肿瘤患者每日服用75 mg GSK2141795是安全耐受的[17]。但GSK2141795作为一种潜在的抗肿瘤药物,其在体外肿瘤细胞中的应用及药物效应尚未见报道。
本研究在体外培养的人肝癌细胞株Huh7中加入AKT抑制剂GSK2141795,观察不同药物浓度和不同作用时间后Huh7细胞的形态变化及凋亡情况。结果显示随着GSK2141795浓度的增加,细胞形态逐渐发生变化,细胞凋亡比例增加,同时AKT表达下降,AKT蛋白磷酸化水平升高,与既往研究结果[18-19]一致。Han等[19]研究证实AKT抑制剂导致AKT蛋白磷酸化升高的机制是该信号通路中存在反馈环路,该反馈环路能迅速通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和哺乳动物雷帕霉素靶蛋白复合物2(mammalian target of rapamycin complex 2,mTORC2)通路促使AKT蛋白磷酸化。此外,本研究还发现Huh7细胞的凋亡比例和AKT蛋白磷酸化水平随药物作用时间的延长而逐渐升高,药物作用24 h后细胞明显凋亡。药物作用0~24 h时,AKT蛋白的表达随作用时间的延长而降低;作用48 h时,AKT蛋白表达再次升高。推测可能是因为AKT抑制剂能促使细胞中AKT蛋白磷酸化,而高度磷酸化的AKT蛋白反馈性削弱长期使用抑制剂的药物效果,从而导致AKT蛋白表达水平再次升高,这可能也是长期使用化学治疗药物而导致肿瘤耐药的原因之一。针对这一现象,我们后续将开展相关研究。
在细胞凋亡方面,既往研究发现AKT活化有助于细胞避免发生同源性磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)介导的细胞凋亡,同时降低肿瘤细胞对促凋亡因子的敏感性[20]。AKT失活能有效抑制肿瘤生长且特异性诱导AKT高度活化的肿瘤细胞发生凋亡[21];同时抑制肿瘤细胞AKT1和AKT2的活性则可显示更强大的促凋亡能力[20, 22]。AKT通路对细胞凋亡的影响可通过多种胞内途径发挥作用[23],其中Bcl-2为凋亡抑制蛋白,是细胞凋亡蛋白家族中最重要的调控分子。Bad为促凋亡蛋白,研究发现AKT是Bad的激酶之一,AKT活化后能促使Bad磷酸化,从而阻断细胞凋亡[24]。Caspase-9是细胞凋亡的启动者和效应者,而AKT活化也能促使Caspase-9磷酸化,抑制其促凋亡能力[25]。本研究发现随着GSK2141795作用浓度的增加及作用时间的延长,Huh7细胞凋亡比例逐渐增加,促凋亡蛋白Bad及凋亡效应分子Caspase-9的表达升高,而凋亡拮抗蛋白Bcl-2的表达水平降低,提示GSK2141795可通过下游Bad-Bcl-2凋亡通路诱导Huh7细胞发生凋亡。
综上所述,本研究首次在人肝癌细胞株Huh7中验证了AKT抑制剂GSK2141795的药物效应与其药物浓度及作用时间的关系,旨在为后续体外实验中合理使用GSK2141795提供理论依据,同时为进一步认识AKT相关信号通路及开发新的肝癌治疗手段提供参考。
| [1] |
MANNING B D, TOKER A. AKT/PKB signaling:navigating the network[J]. Cell, 2017, 169: 381-405. DOI:10.1016/j.cell.2017.04.001 |
| [2] |
YUAN T L, CANTLEY L C. PI3K pathway alterations in cancer:variations on a theme[J]. Oncogene, 2008, 27: 5497-5510. DOI:10.1038/onc.2008.245 |
| [3] |
WANG Q, YU W N, CHEN X, PENG X D, JEON S M, BIRNBAUM M J, et al. Spontaneous hepatocellular carcinoma after the combined deletion of Akt isoforms[J]. Cancer Cell, 2016, 29: 523-535. DOI:10.1016/j.ccell.2016.02.008 |
| [4] |
ALMHANNA K, STROSBERG J, MALAFA M. Targeting AKT protein kinase in gastric cancer[J]. Anticancer Res, 2011, 31: 4387-4392. |
| [5] |
CHEN W S, XU P Z, GOTTLOB K, CHEN M L, SOKOL K, SHIYANOVA T, et al. Growth retardation and increased apoptosis in mice with homozygous disruption of the Akt1 gene[J]. Genes Dev, 2001, 15: 2203-2208. DOI:10.1101/gad.913901 |
| [6] |
CHO H, MU J, KIM J K, THORVALDSEN J L, CHU Q, CRENSHAW E B 3rd, et al. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2(PKBβ)[J]. Science, 2001, 292: 1728-1731.
|
| [7] |
EASTON R M, CHO H, ROOVERS K, SHINEMAN D W, MIZRAHI M, FORMAN M S, et al. Role for Akt3/protein kinase Bγ in attainment of normal brain size[J]. Mol Cell Biol, 2005, 25: 1869-1878. DOI:10.1128/MCB.25.5.1869-1878.2005 |
| [8] |
YANG Z Z, TSCHOPP O, BAUDRY A, DÜMMLER B, HYNX D, HEMMINGS B A. Physiological functions of protein kinase B/Akt[J]. Biochem Soc Trans, 2004, 32(Pt 2): 350-354. |
| [9] |
LI H, ZENG J, SHEN K. PI3K/AKT/mTOR signaling pathway as a therapeutic target for ovarian cancer[J]. Arch Gynecol Obstet, 2014, 290: 1067-1078. DOI:10.1007/s00404-014-3377-3 |
| [10] |
BELLACOSA A, KUMAR C C, DI CRISTOFANO A, TESTA J R. Activation of AKT kinases in cancer:implications for therapeutic targeting[J]. Adv Cancer Res, 2005, 94: 29-86. DOI:10.1016/S0065-230X(05)94002-5 |
| [11] |
PAL S K, RECKAMP K, YU H, FIGLIN R A. Akt inhibitors in clinical development for the treatment of cancer[J]. Expert Opin Investig Drugs, 2010, 19: 1355-1366. DOI:10.1517/13543784.2010.520701 |
| [12] |
GILLS J J, DENNIS P A. Perifosine:update on a novel Akt inhibitor[J]. Curr Oncol Rep, 2009, 11: 102-110. DOI:10.1007/s11912-009-0016-4 |
| [13] |
CHEE K G, LONGMATE J, QUINN D I, CHATTA G, PINSKI J, TWARDOWSKI P, et al. The AKT inhibitor perifosine in biochemically recurrent prostate cancer:a phase Ⅱ California/Pittsburgh cancer consortium trial[J]. Clin Genitourin Cancer, 2007, 5: 433-437. DOI:10.3816/CGC.2007.n.031 |
| [14] |
MA Z, ZHU L, LUO X, ZHAI S, LI P, WANG X. Perifosine enhances mTORC1-targeted cancer therapy by activation of GSK3β in NSCLC cells[J]. Cancer Biol Ther, 2012, 13: 1009-1017. DOI:10.4161/cbt.20989 |
| [15] |
BENDELL J C, NEMUNAITIS J, VUKELJA S J, HAGENSTAD C, CAMPOS L T, HERMANN R C, et al. Randomized placebo-controlled phase Ⅱ trial of perifosine plus capecitabine as second- or third-line therapy in patients with metastatic colorectal cancer[J]. J Clin Oncol, 2011, 29: 4394-4400. DOI:10.1200/JCO.2011.36.1980 |
| [16] |
RICHARDSON P G, WOLF J, JAKUBOWIAK A, ZONDER J, LONIAL S, IRWIN D, et al. Perifosine plus bortezomib and dexamethasone in patients with relapsed/refractory multiple myeloma previously treated with bortezomib:results of a multicenter phase Ⅰ/Ⅱ trial[J]. J Clin Oncol, 2011, 29: 4243-4249. DOI:10.1200/JCO.2010.33.9788 |
| [17] |
AGHAJANIAN C, BELL-MCGUINN K M, BURRIS H A 3rd, SIU L L, STAYNER L A, WHELER J J, et al. A phase Ⅰ, open-label, two-stage study to investigate the safety, tolerability, pharmacokinetics, and pharmacodynamics of the oral AKT inhibitor GSK2141795 in patients with solid tumors[J]. Invest New Drugs, 2018, 36: 1016-1025.
|
| [18] |
JACOBSEN K, BERTRAN-ALAMILLO J, MOLINA M A, TEIXIDÓ C, KARACHALIOU N, PEDERSEN M H, et al. Convergent Akt activation drives acquired EGFR inhibitor resistance in lung cancer[J/OL]. Nat Commun, 2017, 8: 410. doi: 10.1038/s41467-017-00450-6.
|
| [19] |
HAN E K, LEVERSON J D, MCGONIGAL T, SHAH O J, WOODS K W, HUNTER T, et al. Akt inhibitor A-443654 induces rapid Akt Ser-473 phosphorylation independent of mTORC1 inhibition[J]. Oncogene, 2007, 260: 5655-5661. |
| [20] |
DEFEO-JONES D, BARNETT S F, FU S, HANCOCK P J, HASKELL K M, LEANDER K R, et al. Tumor cell sensitization to apoptotic stimuli by selective inhibition of specific Akt/PKB family members[J]. Mol Cancer Ther, 2005, 4: 271-279. |
| [21] |
JETZT A, HOWE J A, HORN M T, MAXWELL E, YIN Z, JOHNSON D, et al. Adenoviral-mediated expression of a kinase-dead mutant of Akt induces apoptosis selectively in tumor cells and suppresses tumor growth in mice[J]. Cancer Res, 2003, 63: 6697-6706. |
| [22] |
MAYER I A, ARTEAGA C L. The PI3K/AKT pathway as a target for cancer treatment[J]. Annu Rev Med, 2016, 67: 11-28. DOI:10.1146/annurev-med-062913-051343 |
| [23] |
TANG B, TANG F, WANG Z, QI G, LIANG X, LI B, et al. Upregulation of Akt/NF-κB-regulated inflammation and Akt/Bad-related apoptosis signaling pathway involved in hepatic carcinoma process:suppression by carnosic acid nanoparticle[J]. Int J Nanomedicine, 2016, 11: 6401-6420. DOI:10.2147/IJN |
| [24] |
FULDA S. Synthetic lethality by co-targeting mitochondrial apoptosis and PI3K/Akt/mTOR signaling[J]. Mitochondrion, 2014, 19 Pt A: 85-87. |
| [25] |
HU B, SUN M, LIU J, HONG G, LIN Q. The preventative effect of Akt knockout on liver cancer through modulating NF-κB-regulated inflammation and Bad-related apoptosis signaling pathway[J]. Int J Oncol, 2016, 48: 1467-1476. DOI:10.3892/ijo.2016.3383 |
 2018, Vol. 39
2018, Vol. 39


