2. 解放军 77626 部队医院药房, 拉萨 851400
2. Department of Pharmacy, No. 77626 Hospital of PLA, Lhasa 851400, Tibet Autonomous Region, China
肿瘤传统疗法主要包括手术、放射治疗和化学治疗,与其相比,光动力疗法(photodynamic therapy,PDT)具有微创性、安全性、良好的靶向性、对多种肿瘤有效以及可重复治疗等特点,已成为肿瘤治疗的一种新策略[1]。作为PDT的关键因素,光敏剂(photosensitizer)的研发一直是PDT的研究热点。自1996年美国FDA批准Photofrin(加拿大AXCAN公司生产)作为第1个抗癌光敏剂以来,陆续有同类仿制品如俄罗斯的Photogem、德国的Photosan等上市,这些药物介导的PDT在临床肿瘤治疗中取得了良好的效果。其中Photofrin因其具有安全有效、毒副作用小、可协同、可重复等优点脱颖而出,在食管癌、肺癌、乳腺癌、皮肤癌等数10类肿瘤包括数万例患者的治疗中取得较好的疗效,为中晚期肿瘤患者特别是无法或拒绝采用传统疗法的患者提供了一种可行的治疗手段。但上述光敏剂存在诸多不足:由多种卟啉类衍生物组成,有效成分不明确,无可控的质量标准;在皮肤中存留时间长达数周,易导致皮疹、水泡等皮肤光毒性作用,用药后1个月甚至更长的时间内患者需避免阳光直接照射等[2]。此外,Photofrin价格昂贵,我国临床至今尚未应用;我国首创的血卟啉注射液于2006年在国内上市,但其临床应用效果远不如Photofrin,而且同样具有皮肤光毒性作用大、有效成分不明等缺点,目前已处于停产状态。因此,开发新型高效低毒、具有我国自主知识产权的光敏剂具有重大意义。
方起程团队对Photofrin进行了系统研究,从20多个卟啉类衍生物中筛选得到光敏活性较强的3个卟啉二聚体盐异构体,并最终选择了产率较高、较易纯化、水溶性较大的华卟啉钠(sinoporphyrin sodium,DVDMS;结构式见图 1);与Photofrin相比,DVDMS有效成分明确,含量高达98%,质量标准可控,有效剂量仅为Photofrin的1/10,治疗后避光时间预计缩短为3~7 d,相关研究成果获得国家发明专利(专利号: CN102030765B)[2-3]。2014年Liu课题组报道,DVDMS介导的声动力治疗(sonodynamic therapy,SDT)对多种肿瘤具有抑制作用[4-6]。在声光领域对PDT和SDT杀伤肿瘤细胞机制的研究发现,两者分别通过特有的方式产生类似的活性氧类物质(reactive oxygen species,ROS),进而通过诱导肿瘤细胞自噬、凋亡和坏死等途径发挥抗肿瘤作用。作为DVDMS介导的PDT(DVDMS-PDT)的补充,DVDMS介导的SDT(DVDMS-SDT)进一步拓展了其研究和应用范围。近年来,关于DVDMS的研究和报道越来越多,主要集中在抗肿瘤作用方面,另外部分研究表明DVDMS对银屑病[7-8]、耐药菌[9]等的治疗也具有较好的效果;安全性研究也表明,DVDMS在比格犬和SD大鼠体内具有良好的安全性[10-11]。目前DVDMS已获取化学药品注册分类1.1类新药临床研究批件,进入Ⅰ期临床试验阶段。本文将对DVDMS的抗肿瘤作用及其机制的研究进展进行综述。
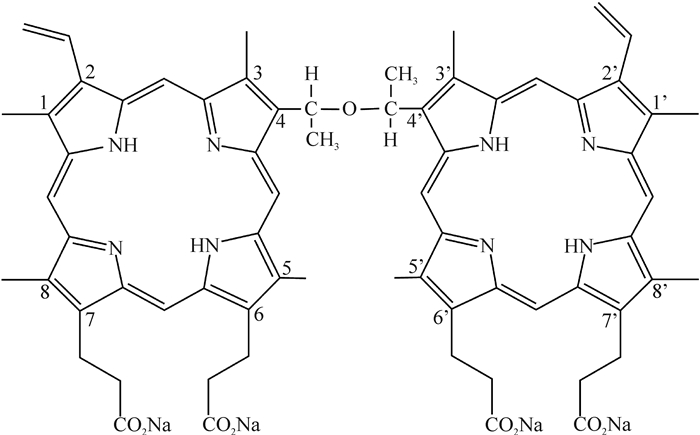
|
图 1 DVDMS化学结构式 Fig 1 Chemical structural formula of sinoporphyrin sodium (DVDMS) |
1 DVDMS-PDT
PDT治疗肿瘤主要有以下3种机制:(1)通过产生的ROS直接杀死肿瘤细胞;(2)通过作用于肿瘤组织的血管造成血液凝滞、血管闭合,减少肿瘤营养物质的供应,从而导致肿瘤坏死;(3)激活自身免疫系统,通过免疫细胞杀伤肿瘤细胞。研究表明,DVDMS-PDT对乳腺癌、食管癌、肝癌等多种肿瘤细胞和移植瘤均显示出良好的抗肿瘤效果。
Shi等[12]通过克隆形成、MTT细胞毒性和异种移植瘤实验对DVDMS-PDT的体外和体内抗肿瘤作用进行了临床前研究,结果显示DVDMS-PDT(0.5 μg/mL,30 mW/cm2,180 s)对乳腺癌MCF-7、肝癌HepG2、肾癌Ketr3和肺癌H460细胞的克隆形成抑制效果良好,抑制率均高于85.5%;MTT实验对11种人类肿瘤细胞进行了测试,DVDMS-PDT组的半数抑制浓度(half maximal inhibitory concentration,IC50)为0.1~1.0 μg/mL,阳性药Photofrin-PDT组的IC50为0.3~0.5 μg/mL,同样条件下DVDMS的效果强于Photofrin;异种移植瘤实验采用人食管癌CaEs-17细胞和肝癌HepG2细胞,同样实验条件下DVDMS-PDT(2 mg/kg)的肿瘤抑制率高达90%,肿瘤抑制效果与Photofrin-PDT(20 mg/kg)相当。与Photofrin相比,DVDMS在抗肿瘤方面具有剂量优势。
有研究小组就DVDMS-PDT对小鼠乳腺癌细胞4T1、人乳腺癌细胞MDA-MB-231的抗肿瘤作用进行了详细研究。Wang等[13]和胡建敏[14]通过体内外实验研究了DVDMS-PDT对高转移乳腺癌细胞4T1的增殖和转移抑制作用,结果显示,DVDMS-PDT具有较强的光毒性,扫描电镜和共聚焦显微镜观察可见DVDMS-PDT处理后4T1细胞发生萎缩、表面微绒毛变形和F-肌动蛋白(F-actin)微丝紊乱;与对照组和阳性药物Photofrin组相比,DVDMS-PDT抑制了4T1细胞的增殖和转移,并延长了荷瘤小鼠的生存期;但加入ROS清除剂N-乙酰半胱氨酸后,DVDMS-PDT对4T1细胞的光毒性被明显抑制。Wu等[15]研究显示,DVDMS-PDT可通过产生ROS引发人乳腺癌细胞MDA-MB-231早期细胞凋亡反应和F-actin微丝解体,进而抑制乳腺癌细胞的增殖和迁移。Xiong等[16]在上述研究的基础上进一步对2种PDT治疗策略进行比较,结果显示单次给药后短时间内多次光照较长时间多次给药后多次光照具有更好的抗肿瘤效应,这为DVDMS-PDT的临床应用提供了重要依据;进一步研究发现,DVDMS-PDT可通过降低增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达、诱导凋亡、抑制肺转移和新生血管生成,有效抑制乳腺癌细胞4T1的增殖。
Hu等[17]评价了DVDMS-PDT对食管癌Eca-109细胞的抑制作用。MTT实验结果显示,5 μg/mL、10 J/cm2条件下DVDMS-PDT处理组Eca-109细胞的活性约为50%,其细胞光毒性强于Photofrin-PDT阳性药组(80%);机制研究结果显示,Eca-109细胞的最大摄入量约在给药后3 h,且DVDMS在细胞内多分布于线粒体中;DVDMS-PDT可通过生成大量ROS引起DNA损伤和线粒体膜电位(mitochondrial membrane potential,MMP)改变,进而产生光毒性。
吕海燕[18]对DVDMS进行了初步的临床前研究,结果显示,DVDMS-PDT对结肠癌细胞HT29和LOVO、胶质瘤细胞U251、肝癌细胞SMMC-7721和BEL-7402,以及胃癌细胞MGC-803等多种肿瘤细胞具有较好的生长抑制作用;且DVDMS-PDT剂量较低时主要以诱导细胞凋亡为主,高剂量时则以诱导细胞坏死为主。姜智换等[19]对比了Photofrin和DVDMS对肺癌细胞H460、肝癌细胞HepG2、胃癌细胞BGC823和肾癌细胞Ketr3细胞的生长抑制作用,Photofrin对上述4种肿瘤细胞的IC50为(1.359±3.277)μg/mL,而DVDMS则为(0.207±0.584)μg/mL,其对肿瘤细胞的杀伤效果为前者的4~11倍;体内研究发现,DVDMS-PDT对小鼠肉瘤S180、H460细胞移植瘤具有较好的肿瘤生长抑制作用,而且激光照射部位的毒性反应弱于Photofrin。
尽管DVDMS-PDT在肿瘤治疗方面表现出良好的效果,为进一步增强疗效,有研究人员开始通过构建纳米石墨烯氧化物递药系统对肿瘤进行诊断和治疗。石墨烯氧化物(graphene oxide,GO)是石墨烯的氧化形式,具有比表面积大、水溶性好、表面易修饰、生物相容性好等优点,而且GO自身具有较高的近红外吸收能力[20],有利于增强DVDMS-PDT的抗肿瘤效果。GO的近红外线吸收能力强,载药量大,是光热疗法(photothermal therapy,PTT)的良好递药系统。Huang等[21]研究了GO-聚乙二醇-DVDMS(GO-PEG-DVDMS)聚合物对人肝癌细胞HepG2的抑制能力,结果表明GO-PEG-DVDMS可发挥PDT和PTT协同作用,对HepG2细胞具有良好的抑制效果。Yan等[22]制备了一种新型的GO-PEG-DVDMS光治疗诊断试剂,提升了DVDMS的荧光强度;通过研究该新型试剂对增强光学成像引导下PDT体内外抗肿瘤(恶性胶质瘤细胞U87MG及荷瘤小鼠)效果的影响,发现GO-PEG-DVDMS可通过分子内电荷转移增强DVDMS的荧光强度;与DVDMS实验组比较,GO-PEG载体可增强组织穿透性和EPR效应(enhanced permeability and retention effect),增加DVDMS在肿瘤组织的累积,进而增强PDT的治疗效果;静脉注射GO-PEG-DVDMS(相当于DVDMS 2 mg/kg)后光照(50 J/cm2),体内肿瘤清除率为100%,未见肿瘤复发、体质量下降等不良反应。此外,Yan等[23]还对GO-PEG-DVDMS的光学和光声二重成像引导下PDT和PTT协同治疗肿瘤(肺癌细胞PC9及荷瘤小鼠)作用进行了研究,结果显示,DVDMS可增强GO对近红外线的吸收,提高其光声学成像和PTT作用;与PDT(630 nm光照)或PTT(800 nm光照)单独处理组相比,GO-PEG-DVDMS的治疗效应提升;静脉注射GO-PEG-DVDMS(相当于GO-PEG 1 mg/kg、DVDMS 2 mg/kg)后光照(50 J/cm2),PC9荷瘤小鼠体内肿瘤细胞清除率为100%。结果提示纳米递药系统运载可增加细胞对DVDMS的摄取,增强DVDMS-PDT的抗肿瘤作用,与相关影像学技术结合有望开发成新型肿瘤治疗诊断一体化试剂。
上述结果表明,DVDMS-PDT在体外和体内实验中对多种肿瘤细胞均表现出生长抑制作用,有望用于多种肿瘤的治疗,尤其是结肠癌、乳腺癌、肺癌和肝癌。其具体机制可能包括以下几个方面:在630 nm激发光作用下,DVDMS产生ROS,导致细胞形态和结构发生变化,如细胞萎缩、表面微绒毛变形、F-actin微丝紊乱,抑制细胞的迁移;引起DNA损伤和线粒体膜电位改变;通过相关通路抑制细胞增殖,诱导细胞凋亡、坏死和自噬,损伤肿瘤微血管并抑制新生血管生成。部分研究结果显示DVDMS相比Photofrin具有明显的剂量优势,而且DVDMS-PDT的毒性效应弱于Photofrin,提示DVDMS有望成为一种新的抗肿瘤光敏剂。由于光的穿透能力较差,PDT应用主要集中在人体表面浅层肿瘤治疗,肺呼吸道、胃肠道、颅内、膀胱等部位的肿瘤治疗需借助光导纤维、内镜等其他介入技术,对深部、中晚期肿瘤治疗有一定困难。
2 DVDMS-SDT1989年,日本学者Yumita等[24]首次报道利用超声激活血卟啉的抗肿瘤作用,并称之为SDT。源于PDT的SDT具有其独特的优势,即超声方向性好、穿透性强、可聚焦于特定部位等,因而可将能量精确聚焦于深层的肿瘤组织,激发该位点的声敏剂并产生细胞毒性,以非侵入的方式抑制和杀伤深层的肿瘤组织和细胞。SDT无需借助内镜,操作简便,对正常组织毒副作用小,有望克服目前PDT在深部、中晚期肿瘤治疗等应用中存在的困难。目前认为SDT治疗肿瘤的机制主要是通过超声作用产生的物理效应(如热效应、机械效应、空化效应)和生化效应(如ROS、自由基等)及其混合作用,而细胞对SDT的应答受细胞种类、实验条件、超声辐射量、声敏剂类型及其在细胞内的定位等的影响。研究显示,在适当频率和功率的超声激发下,细胞对DVDMS的摄取增强,可通过SDT作用产生细胞毒性[4-6, 25-26]。
DVDMS的声敏性首次报道于2014年,研究者先后通过体内外实验研究了DVDMS-SDT对肉瘤、食管癌、白血病、结肠癌的抑制作用,结果显示DVDMS-SDT对多种肿瘤细胞和移植瘤显示出良好的抗肿瘤效果[4-6, 25]。Li等[4]采用小鼠肉瘤S180细胞移植模型,尾静脉注射DVDMS后活体成像,证明了DVDMS可选择性富集在肿瘤组织;超声激发DVDMS后产生协同作用,可抑制肿瘤的生长和转移(肌肉和胸骨侵袭)。Xiong等[25]研究了DVDMS联合多次SDT对肉瘤S180细胞的抑制作用,结果显示DVDMS给药后多次超声处理对肿瘤的抑制作用增强;分析其机制发现DVDMS-SDT可降低血管内皮生长因子(vascular endothelial growth factor,VEGF)和PCNA表达水平,诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖和体内肿瘤微血管系统构建,从而引起肿瘤组织坏死。
Wang等[6]研究表明,DVDMS被食管癌Eca-109细胞摄入后主要分布在线粒体内, 被超声激发后产生大量的ROS,导致细胞色素C的释放和凋亡蛋白激活,引发线粒体依赖的凋亡反应,扫描电镜下可见DVDMS-SDT处理后细胞发生相对严重的损伤。Wang等[26]还评价了DVDMS-SDT联合微泡造影剂SonoVue对结肠癌CT26细胞的抗肿瘤效应,结果显示SDT-SonoVue可增强细胞膜的通透性,促进细胞摄取DVDMS,增强DVDMS-SDT的抗肿瘤效应。Hu等[5]以白血病细胞K562和U937,以及ICR小鼠的外周血单核细胞与脾淋巴细胞为模型,研究发现与正常细胞和组织比较DVDMS可被肿瘤细胞快速摄取,并选择性在肿瘤组织累积;在合适的条件下,DVDMS可增强超声对细胞的损伤作用。
上述研究表明,DVDMS可选择性富集于肿瘤组织中,经超声处理后在靶向部位产生大量ROS,进而产生剂量依赖性细胞毒性,抑制肿瘤细胞的增殖和转移;联用微泡造影剂或对靶向部位进行多次超声处理可增强DVDMS的利用率和抗肿瘤作用;DVDMS-SDT对正常细胞毒性很小。DVDMS有望作为新的声敏剂用于肿瘤细胞的SDT。
3 DVDMS的其他研究除了DVDMS介导的PDT和SDT,还有研究人员对DVDMS介导的PDT+SDT、放射治疗增敏抗肿瘤作用进行了研究。
Liu等[27]初步评价了DVDMS联合SDT和PDT的抗肿瘤效果,乳腺癌细胞4T1、MDA-MB-231、MCF-7体外细胞毒性实验结果显示,SPDT(DVDMS+超声+激光)或PSDT(DVDMS+激光+超声)组对3种细胞的生长和迁移抑制作用均优于SDT和PDT组;4T1荷瘤小鼠体内实验结果显示,SPDT或PSDT可增强DVDMS的肿瘤生长抑制和肺转移抑制作用;初步机制研究表明,SPDT或PSDT可增加ROS的生成,而超声可产生空化作用,增加细胞膜的通透性,有助于增强DVDMS的治疗效果。SPDT或PSDT可以产生协同抗肿瘤作用,增加DVDMS的利用率并增强其抗肿瘤作用,值得深入研究。
李晖和谢树森[28]研究提出,X射线敏感的荧光药物被X射线激发后产生适合波长的荧光,可取代PDT治疗中的激光来激发光敏剂,从而产生治疗作用。X射线在人体组织中穿透性好,其对人体组织的作用和影响已十分清楚,该设想有望克服PDT技术中激光穿透能力有限的缺点,可用于原发癌和已向深部浸润或远端转移的肿瘤的治疗。与之类似,李晓龙[29]初步探究了DVDMS对H22肝癌移植瘤小鼠的放射治疗增敏作用,荷瘤小鼠尾静脉注射DVDMS后避光并进行放射治疗;结果显示DVDMS联合放射治疗组小鼠的肿瘤体积和质量均低于其他组,生存期明显延长,生存状态、活动度较好。在避光情况下单独研究DVDMS的放射治疗增敏作用为DVDMS的研究提供了新思路,有必要对DVDMS+PDT/SDT+放射治疗等方案的抗肿瘤效果进行探究。
4 小结DVDMS为我国具有自主知识产权的新一代高纯度光敏剂,在一定程度上克服了现在临床应用的光敏剂成分复杂、无可控质量标准、避光时间长等不足,其具有纯度高、质量可控、水溶性好、暗毒性低而光毒性强、易产业化等优势。上述诸多研究表明,DVDMS-PDT和DVDMS-SDT对多种肿瘤具有抑制作用,且安全性良好;而SDT和PDT联合使用将进一步降低其毒副作用,扩展其应用范围和适应证。目前关于PDT和SDT机制的研究尚不明确;SDT虽然在无创、安全性等方面具有特殊的优势,但对其疗效的干扰因素要多于PDT,很难保证临床应用中取得相对一致的疗效,因而在SDT临床应用前需反复试验,探索超声和生物组织作用的最佳声学参数。随着研究的深入,DVDMS有望开发成高效低毒的肿瘤治疗、诊断试剂,造福广大肿瘤患者。
| [1] |
AGOSTINIS P, BERG K, CENGEL K A, FOSTER T H, GIROTTI A W, GOLLNICK S O, et al. Photodynamic therapy of cancer:an update[J]. CA Cancer J Clin, 2011, 61: 250-281. DOI:10.3322/caac.v61:4 |
| [2] |
方起程. 癌症光动力治疗和新抗癌光敏剂华卟啉钠[J]. 中国新药杂志, 2014, 23: 1540-1545. |
| [3] |
方起程, 杨栋.以醚键结合的卟啉二聚体盐及其制造方法: CN102030765B[P]. 2012-08-29.
|
| [4] |
LI C F, ZHANG K, WANG P, HU J M, LIU Q H, WANG X B. Sonodynamic antitumor effect of a novel sonosensitizer on S180 solid tumor[J]. Biopharm Drug Dispos, 2014, 35: 50-59. DOI:10.1002/bdd.v35.1 |
| [5] |
HU J, WANG X, ZHANG K, WANG P, SU X, LI Y, et al. Sinoporphyrin sodium:a novel sensitizer in sonodynamic therapy[J]. Anticancer Drugs, 2014, 25: 174-182. DOI:10.1097/CAD.0000000000000031 |
| [6] |
WANG X, WANG H, ZHANG S, WANG P, ZHANG K, LIU Q. Sinoporphyrin sodium, a novel sensitizer, triggers mitochondrial-dependent apoptosis in ECA-109 cells via production of reactive oxygen species[J]. Int J Nanomedicine, 2014, 9: 3077-3090. |
| [7] |
刘汉清, 张晶旋, 魏金峰, 靳洪涛, 王爱平. 华卟啉钠光动力疗法对细胞异常增殖影响的体内、外实验研究[J]. 中国皮肤性病学杂志, 2016, 30: 20-24. |
| [8] |
刘汉清, 姜智焕, 吴文涛, 魏金峰, 靳洪涛, 王爱平. 华卟啉钠的光漂白性质研究[J]. 癌变·畸变·突变, 2016, 28: 81-90. DOI:10.3969/j.issn.1004-616x.2016.02.001 |
| [9] |
MAI B, WANG X, LIU Q, LEUNG A W, WANG X, XU C, et al. The antibacterial effect of sinoporphyrin sodium photodynamic therapy on Staphylococcus aureus planktonic and biofilm cultures[J]. Lasers Surg Med, 2016, 48: 400-408. DOI:10.1002/lsm.22468 |
| [10] |
LIN N, LI C, WANG Z, ZHANG J, YE X, GAO W, et al. A safety study of a novel photosensitizer, sinoporphyrin sodium, for photodynamic therapy in Beagle dogs[J]. Photochem Photobiol Sci, 2015, 14: 815-832. DOI:10.1039/C4PP00463A |
| [11] |
SHI R, LIN X, ZHANG J, JIN H, WANG A, WEI J. Safety evaluation of repeated intravenous infusion of sinoporphyrin with and without PDT in rats[J]. Photochem Photobiol Sci, 2016, 15: 1366-1376. DOI:10.1039/C6PP00276E |
| [12] |
SHI R, LI C, JIANG Z, LI W, WANG A, WEI J. Preclinical study of antineoplastic sinoporphyrin sodium-PDT via in vitro and in vivo models[J/OL]. Molecules, 2017, 22: 112. doi: 10.3390/molecules22010112.
|
| [13] |
WANG X, HU J, WANG P, ZHANG S, LIU Y, XIONG W, et al. Analysis of the in vivo and in vitro effects of photodynamic therapy on breast cancer by using a sensitizer, sinoporphyrin sodium[J]. Theranostics, 2015, 5: 772-786. DOI:10.7150/thno.10853 |
| [14] |
胡建敏.新型光敏剂华卟啉钠介导的光动力疗法对小鼠乳腺癌抗肿瘤效应研究[D].西安: 陕西师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10718-1015722902.htm
|
| [15] |
WU L, WANG X, LIU Q, WINGNANG LEUNG A, WANG P, XU C. Sinoporphyrin sodium mediated photodynamic therapy inhibits the migration associated with collapse of F-actin filaments cytoskeleton in MDA-MB-231 cells[J]. Photodiagnosis Photodyn Ther, 2016, 13: 58-65. DOI:10.1016/j.pdpdt.2015.12.008 |
| [16] |
XIONG W, WANG X, HU J, LIU Y, LIU Q, WANG P. Comparative study of two kinds of repeated photodynamic therapy strategies in breast cancer by using a sensitizer, sinoporphyrin sodium[J]. J Photochem Photobiol B, 2016, 160: 299-305. DOI:10.1016/j.jphotobiol.2016.04.024 |
| [17] |
HU J, WANG X, LIU Q, ZHANG K, XIONG W, XU C, et al. Antitumor effect of sinoporphyrin sodium-mediated photodynamic therapy on human esophageal cancer Eca-109 cells[J]. Photochem Photobiol, 2014, 90: 1404-1412. DOI:10.1111/php.2014.90.issue-6 |
| [18] |
吕海燕.新型光敏剂以醚键结合的卟啉二聚体盐(DVDMS-2)的初步临床前研究[D].厦门: 厦门大学, 2012. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y2073892
|
| [19] |
姜智换, 史蕤, 李超, 王爱平. 华卟啉钠介导的光动力疗法在体外和体内对肿瘤生长的抑制作用[J]. 癌变·畸变·突变, 2013, 25: 163-167. DOI:10.3969/j.issn.1004-616x.2013.03.001 |
| [20] |
CHUNG C, KIM Y K, SHIN D, RYOO S R, HONG B H, MIN D H. Biomedical applications of graphene and graphene oxide[J]. Acc Chem Res, 2013, 46: 2211-2224. DOI:10.1021/ar300159f |
| [21] |
HUANG C, CHU C C, ZHANG J, GAO H Y, LIU G. First Sino-German Symposium on "Singlet molecular oxygen and photodynamic effects":antitumor effect of sinoporphyrin sodium loaded graphene oxide on human liver cancer HepG2 cells[J]. Photon Lasers Med, 2015, 4: 365-368. |
| [22] |
YAN X, NIU G, LIN J, JIN A J, HU H, TANG Y, et al. Enhanced fluorescence imaging guided photodynamic therapy of sinoporphyrin sodium loaded graphene oxide[J]. Biomaterials, 2015, 42: 94-102. DOI:10.1016/j.biomaterials.2014.11.040 |
| [23] |
YAN X, HU H, LIN J, JIN A J, NIU G, ZHANG S, et al. Optical and photoacoustic dual-modality imaging guided synergistic photodynamic/photothermal therapies[J]. Nanoscale, 2015, 7: 2520-2526. DOI:10.1039/C4NR06868H |
| [24] |
YUMITA N, NISHIGAKI R, UMEMURA K, UMEMURA S. Hematoporphyrin as a sensitizer of cell-damaging effect of ultrasound[J]. Jpn J Cancer Res, 1989, 80: 219-222. DOI:10.1111/cas.1989.80.issue-3 |
| [25] |
XIONG W, WANG P, HU J, JIA Y, WU L, CHEN X, et al. A new sensitizer DVDMS combined with multiple focused ultrasound treatments: an effective antitumor strategy[J/OL]. Sci Rep, 2015, 5: 17485. doi: 10.1038/srep17485.
|
| [26] |
WANG H, WANG P, LI L, ZHANG K, WANG X, LIU Q. Microbubbles enhance the antitumor effects of sinoporphyrin sodium mediated sonodynamic therapy both in vitro and in vivo[J]. Int J Biol Sci, 2015, 11: 1401-1409. DOI:10.7150/ijbs.12802 |
| [27] |
LIU Y, WANG P, LIU Q, WANG X. Sinoporphyrin sodium triggered sono-photodynamic effects on breast cancer both in vitro and in vivo[J]. Ultrason Sonochem, 2016, 31: 437-448. DOI:10.1016/j.ultsonch.2016.01.038 |
| [28] |
李晖, 谢树森. 采用X射线间接激励光敏剂的光动力学疗法新设想[J]. 中国激光医学杂志, 1997, 6: 63-65. |
| [29] |
李晓龙.初步探究华卟啉钠的放疗增敏作用[D].石家庄: 河北医科大学, 2016.
|
 2018, Vol. 39
2018, Vol. 39


