2. 同济大学医学院, 上海 200092;
3. 海军军医大学(第二军医大学)长海医院超声科, 上海 200433
2. Tongji University School of Medicine, Shanghai 200092, China;
3. Department of Ultrasound, Changhai Hospital, Navy Medical University(Second Military Medical University), Shanghai 200433, China
肺结核临床表现多样,胸部影像学常有“同影异病”现象,与部分肺癌难以鉴别,且二者常常合并存在。据报道,结核病患者肺癌的发生率是正常人的1.5~2.5倍,肺癌也易造成结核分枝杆菌感染或结核病复发,增加了鉴别诊断的困难[1]。
计算机断层扫描(computed tomography,CT)是目前肺部疾病主要的影像学检查方式,可明确诊断典型肺结核,但对非典型肺结核缺乏特异性,诊断难度较大,容易出现漏诊或误诊[1];同时CT具有电离辐射,会对接受检查患者的机体造成不同程度的损伤[2]。超声造影是近年来发展的超声新技术,它应用微气泡造影剂在血管内的对比增强作用对病灶的微循环进行评价,已逐步应用于贴壁周围型肺病灶的鉴别与诊断。根据肺组织具有肺动脉与支气管动脉双重血供的特点,部分学者采用超声造影始增时间差对良恶性病变进行鉴别,取得了良好的临床应用效果[3-4]。本研究回顾性分析了贴壁周围型肺结核与肺癌患者的常规超声和超声造影图像,归纳总结病灶的大小、位置、形态特点和超声造影增强模式、增强强度、消退速度等,以期为肺结核与肺癌的鉴别诊断提供新的影像学依据。
1 资料和方法 1.1 研究对象回顾性分析2017年6月至2018年2月我院收治的经病理检查确诊为肺结核或肺癌患者的临床资料,选择超声清晰显影的贴壁周围型肺部病灶(经常规CT检查或胸部超声检查发现的贴壁周围型肺病灶),排除超声检查资料不全或造影图像不理想的病例。所有患者均签署超声造影检查知情同意书。
1.2 仪器与方法 1.2.1 仪器采用美国GE公司LOGIQ E9超声诊断仪,凸阵探头,频率为1~6 MHz。仪器具备低机械指数(mechanical index,MI)谐波造影成像功能及造影图像分析软件。
1.2.2 操作方法常规超声模式下观察记录病灶大小、形态、回声及血供特点后进行低MI下的实时超声造影检查。调节仪器MI为0.10,造影增益为20 dB,经肘静脉团注Sonovue超声造影剂(意大利Bracco公司)1.5 mL,并用5 mL生理盐水冲管,动态采集图像3 min并存储。观察并记录正常肺组织及病灶的造影始增时间、达峰时间、病灶增强模式(从外周向中心、从局部向整体、血管样增强等)、增强强度(与周围正常肺组织对比)、强化均匀程度、是否有坏死区及坏死区特点(无、小片状、大片状及筛孔样、坏死边缘是否规则)以及消退速度(2 min、3 min造影剂消退情况)。
1.2.3 图像分析逐帧分析造影图像,对以上指标进行目测分析,再选择病灶内增强特征明显区域和周围正常肺组织作为感兴趣区。通过造影图像分析软件绘制时间-强度曲线,分析造影始增时间及始增时间差(病灶造影始增时间-正常肺组织始增时间)、消退速度和增强强度等。病灶始增时间以Caremani等[3]的标准评估,≥10 s为晚增强、<10 s为早增强;病灶始增时间差以Bai等[4]的标准评估,≥2.5 s为晚增强、<2.5 s为早增强。
1.3 统计学处理应用SPSS 20.0软件进行统计学分析。计量资料采用x±s表示,两组间比较采用两独立样本t检验;计数资料以例数和百分数表示,两组间比较采用χ2检验;等级资料组间比较采用Kruskal-Wallis检验。检验水准(α)为0.05。
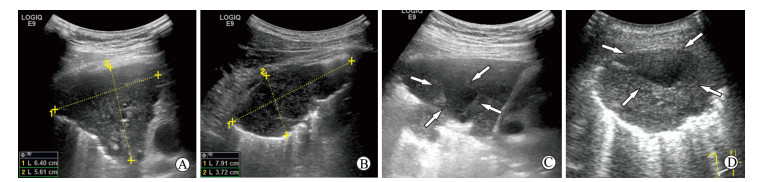
2 结果 2.1 一般情况与常规超声表现共纳入病例84例。结核组42例,男27例、女15例,年龄为16~78(42.78±17.48)岁,原发性肺结核12例、血性播散性肺结核1例、继发性肺结核29例;肺癌组42例,男28例、女14例,年龄为49~77(62.48±8.51)岁,鳞癌17例、腺癌21例、小细胞癌4例。肺结核多见双侧病灶,肺癌病灶多为单侧单发,所有患者均选取最大病灶进行观察。两组病灶形态上均分为肺实变及瘤样改变两大类,其中肺结核病灶以肺实变多见(24例,57.14%),呈楔形低回声,纵径较大,内部可见点状或条索状强回声(图 1A),血流信号丰富者居多;肺癌病灶中以瘤样改变为主(31例,73.81%),呈圆形或类圆形,内部回声较均匀(图 1B),无血流信号或血流信号少。肺结核和肺癌病灶均可见无回声液化坏死区(图 1C、1D)。两组患者一般资料及常规超声表现详见表 1。
|
图 1 贴壁肺病灶的超声表现 Fig 1 Ultrasound scan of subpleural adherent lung lesions A: Pulmonary consolidation of tuberculosis lesion; B: Lung cancer; C: Liquefied necrotic area in pulmonary tuberculosis lesion; D: Liquefied necrotic area in lung cancer. Arrows point to anechoic liquefied necrotic area |
|
|
表 1 肺结核及肺癌患者一般资料与常规超声表现 Tab 1 General information and conventional ultrasound features of patients with pulmonary tuberculosis or lung cancer |
2.2 超声造影表现
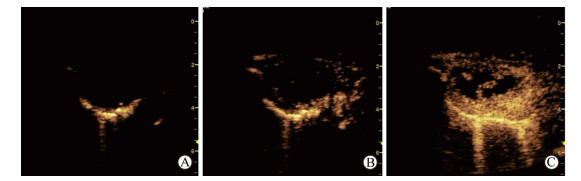
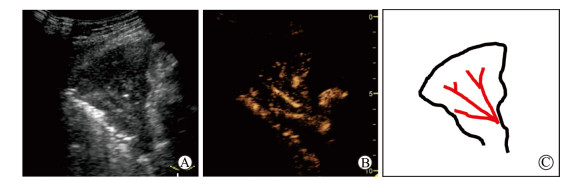
(1)增强模式:30例肺结核与37例肺癌病灶的增强模式均为从外周向中心增强(图 2),从局部向整体充填的肺结核与肺癌病灶分别为2例、4例(图 3)。肺结核患者中呈规则树枝状血管样增强(图 4)的病灶多于肺癌,差异有统计学意义(10例vs 1例,P=0.004)。详见表 2。
|
图 2 2从外周向中心增强模式 Fig 2 Enhancement pattern of periphery-to-center A: The surrounding lung tissue begins to enhance (9 s); B: The lung lesion begins to enhance (10 s); C: The lung lesion has been completely enhanced (22 s) |
|
图 3 从局部向整体增强模式 Fig 3 Enhancement pattern of partial-to-whole A: The surrounding lung tissue begins to enhance (10 s); B: The lung lesion begins to enhance (14 s); C: The lung lesion has been completely enhanced (17 s) |
|
图 4 增强早期规则树枝状血管征 Fig 4 Regular dendritic vessel sign at early stage of enhancement A: Pulmonary consolidation; B: Early stage of enhancement; C: Pattern diagram of vessels |
|
|
表 2 肺结核及肺癌超声造影表现 Tab 2 Contrast-enhanced ultrasound features of pulmonary tuberculosis and lung cancer |
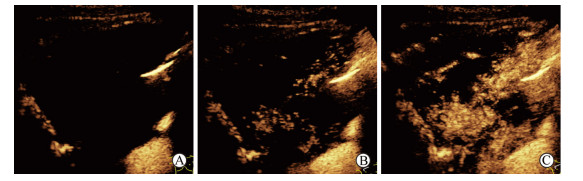
(2)增强强度、均匀程度和坏死区表现:达峰时肺结核与肺癌病灶均多为不均匀增强,但肺结核病灶多为低增强(17例vs 6例,χ2=7.244,P=0.007),肺癌病灶多为高增强(25例vs 6例,χ2=18.456,P<0.001);与肺癌组相比,肺结核组病灶坏死区多表现为筛孔样(13例vs 0例,χ2=15.380,P<0.001;图 5A)或形态规则的大片状坏死(11例vs 2例,χ2=7.372,P=0.007;图 5B);肺癌病灶坏死区形态多不规则(边缘呈毛刺状、分叶状或蟹足样,可伴有不规则分隔;图 5C),与肺结核组相比差异有统计学意义(16例vs 2例,χ2=13.859,P<0.001)。详见表 2。
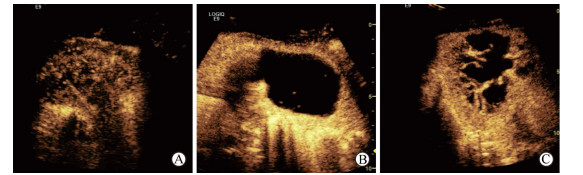
|
图 5 坏死区表现 Fig 5 Images of necrotic areas A: Sieved necrosis; B: Large necrosis of regular shape; C: Large necrosis of irregular shape |
(3)始增时间:正常肺组织的超声造影始增时间为(7.51±4.34)s,肺结核病灶的始增时间为(9.31±2.83)s,肺癌病灶的始增时间为(12.15±2.14)s。以10 s为标准,肺结核病灶的始增时间较早,肺癌病灶的始增时间较晚(χ2=7.467,P=0.006);以2.5 s为标准,肺结核病灶的始增时间差短于肺癌(χ2=65.227,P<0.001)。详见表 2。
(4)消退速度:肺结核病灶的消退速度较慢、肺癌较快,2 min增加强度减半者分别为21例、31例(χ2=5.048,P=0.025),但3 min两组病灶造影剂仍多见残留且差异无统计学意义。详见表 2。
3 讨论肺结核是由结核分枝杆菌引起的一种慢性传染性疾病,其病理演变过程复杂、影像学表现多样,特别是孤立局限的病灶极易与肺癌混淆,毛刺征、血管集束征、胸膜凹陷征等恶性影像学特征均可出现[5]。
既往认为超声检查在肺部疾病的诊断中价值有限,仅可对侵及胸膜的病灶进行显像。但肺结核(包括不典型肺结核)因其特有的病理改变导致正常肺含气结构受到破坏,肺组织发生渗出、增生和坏死并大多累及胸膜,文献报道近90%的患者肺内病灶能很好地进行超声显像,包括胸膜下结节、肺不张、肺实变、胸膜增厚、肺空洞、钙化和胸腔积液等[6-8]。与CT和X线检查比较,尽管超声检查不能清晰地显示肺内不贴壁病灶及纵隔等结构,但其应用范围广、灵敏性高、费用低、创伤小,对肺结核的长期随访具有明显优势。
近年来,超声造影技术在肺部疾病中逐步得到应用,根据肺组织具有由肺动脉与支气管动脉双重血供的特点,部分学者采用造影始增时间差对胸膜下肺肿瘤进行良恶性鉴别,取得了较好的临床应用效果[3]。与同样显示病灶血供情况的CT增强检查比较,超声造影不仅能观察病灶的微循环灌注,还能通过全程实时动态成像准确测量病灶及正常肺组织的始增时间和消退时间,提供较CT增强检查更多的时相信息,提高诊断准确性。如Bai等[4]研究发现,考虑到个体间血管结构、血流速度以及造影剂注射速度等的差异,以肺病灶与正常肺组织的始增时间差作为良恶性诊断标准,始增时间差<2.5 s为肺动脉供血,≥2.5 s为支气管动脉供血,其诊断灵敏度、特异度和准确度分别可达97.5%、95.8%和97.1%。
本研究数据表明,肺结核造影剂进入速度较快,始增时间早(<10 s),与正常肺组织的始增时间差多<2.5 s,提示其血供来源多为肺动脉;肺癌病灶造影剂进入速度慢,始增时间晚(≥10 s),与正常肺组织的始增时间差多≥2.5 s,提示其血供来源多为支气管动脉。这与文献报道[9-10]一致。
在增强模式方面,Cao等[11]报道了造影增强模式能反映病变组织不同的病理变化过程。本研究结果显示两类病灶均以从外周向中心增强为主,实变型肺结核多具有特征性的规则树枝状血管征改变,血管走行正常,没有增宽迂曲,呈现良性病变的特征;而肺癌中血管征改变见于压缩肺组织内,受恶性病灶的影响,血管受推挤、绕行甚至受侵。另外,肺结核病灶更多见不均匀低增强,其坏死区与肺癌存在差异,包括:(1)筛孔样坏死,此类坏死具有较高特异性,与赵丹等[12]报道的“蜂窝状增强”表现相似;(2)形态规则的大片状坏死,此类坏死多为液化坏死,形成内壁圆钝平滑的脓腔。肺癌病灶多呈不均匀高增强,坏死区形态不规则,边缘呈毛刺状、分叶状或蟹足样,可伴有不规则分隔等。同时本研究数据表明肺结核病灶造影剂消退速度慢于肺癌,与亓培君等[13]研究结果相符。这可能与超声造影剂的代谢特点和病灶的血供特点有关。超声造影剂是直径为2.5 μm的六氟化硫微泡,可经肺泡通气进行代谢,大量聚集于肺动脉,肺结核病灶为肺动脉供血,造影剂不断进入病灶内故消退较慢;而肺癌病灶为支气管动脉供血,来源于体循环,且病灶内存在大量微血管直捷通路,故造影剂残留较少,消退较快。
综上所述,肺结核超声造影表现为快进慢退、规则树枝状的血管样增强和(或)不均匀低增强以及筛孔样坏死和(或)形态规则的大片坏死,与肺癌的快进快退、不均匀高增强、形态不规则的坏死区有显著差异,可为二者鉴别提供有价值的依据。
由于本研究样本量小,因此无法对不同类型的肺癌和肺结核进行更细致的分层分析与研究,今后将扩大样本量进一步研究;另外本研究未与胸部最常用的影像学技术CT或X线检查结果进行对照,未来工作中将进一步完善相关资料。
| [1] |
WANG X L, SHAN W. Application of dynamic CT to identify lung cancer, pulmonary tuberculosis, and pulmonary inflammatory pseudotumor[J]. Eur Rev Med Pharmacol Sci, 2017, 21: 4804-4809. |
| [2] |
PATZ E F Jr, GRECO E, GATSONIS C, PINSKY P, KRAMER B S, ABERLE D R. Lung cancer incidence and mortality in National Lung Screening Trial participants who underwent low-dose CT prevalence screening:a retrospective cohort analysis of a randomised, multicentre, diagnostic screening trial[J]. Lancet Oncol, 2016, 17: 590-599. DOI:10.1016/S1470-2045(15)00621-X |
| [3] |
CAREMANI M, BENCI A, LAPINI L, TACCONI D, CAREMANI A, CICCOTOSTO C, et al. Contrast enhanced ultrasonography (CEUS) in peripheral lung lesions:a study of 60 cases[J]. J Ultrasound, 2008, 11: 89-96. DOI:10.1016/j.jus.2008.05.008 |
| [4] |
BAI J, YANG W, WANG S, GUAN R H, ZHANG H, FU J J, et al. Role of arrival time difference between lesions and lung tissue on contrast-enhanced sonography in the differential diagnosis of subpleural pulmonary lesions[J]. J Ultrasound Med, 2016, 35: 1523-1532. DOI:10.7863/ultra.15.08022 |
| [5] |
JIA Z, CHENG S, MA Y, ZHANG T, BAI L, XU W, et al. Tuberculosis burden in China: a high prevalence of pulmonary tuberculosis in household contacts with and without symptoms[J/OL]. BMC Infect Dis, 2014, 14: 64. doi: 10.1186/1471-2334-14-64.
|
| [6] |
MARTINEZ LACASA X, CANALS FONT R, JAEN MANZANERA A, CUCHI BURGOS E, LITE LITE J. [Comparative study of concordance and costs between tuberculin skin test and QuantiFERON®-TB Gold In-Tube in the diagnosis of latent tuberculosis infection among contacts of patients with pulmonary tuberculosis][J]. Med Clin (Barc), 2015, 145: 427-432. DOI:10.1016/j.medcli.2014.11.027 |
| [7] |
AGOSTINIS P, COPETTI R, LAPINI L, BADONA MONTEIRO G, N'DEQUE A, BARITUSSIO A. Chest ultrasound findings in pulmonary tuberculosis[J]. Trop Doct, 2017, 47: 320-328. DOI:10.1177/0049475517709633 |
| [8] |
邱文彪. DR摄影与多层螺旋CT扫描在诊断空洞型肺结核中的应用对比[J]. 深圳中西医结合杂志, 2014, 24: 118-119. |
| [9] |
肖湘生, 于红, 李惠民, 刘士远, 李成洲, 刘靖. 肺癌支气管动脉与肺动脉CT血管造影分析[J]. 中华肿瘤杂志, 2006, 28: 302-305. DOI:10.3760/j.issn:0253-3766.2006.04.016 |
| [10] |
ELDRIDGE L, MOLDOBAEVA A, ZHONG Q, JENKINS J, SNYDER M, BROWN R H, et al. Bronchial artery angiogenesis drives lung tumor growth[J]. Cancer Res, 2016, 76: 5962-5969. DOI:10.1158/0008-5472.CAN-16-1131 |
| [11] |
CAO B S, LIANG Y M, LI X L, DENG J, ZHANG G C. Contrast-enhanced sonography of juxtapleural pulmonary tuberculoma[J]. J Ultrasound Med, 2013, 32: 749-756. DOI:10.7863/ultra.32.5.749 |
| [12] |
赵丹, 杨高怡, 何宁, 孟君, 于秀蕾. 超声造影模式在诊断颈部淋巴结结核中的应用价值[J]. 中国超声医学杂志, 2015, 31: 683-686. |
| [13] |
亓培君, 鹿皎, 陈烨, 张世坤, 李琳琳, 崔莹莹. 周围型肺鳞癌及肺腺癌超声造影初步研究[J]. 临床超声医学杂志, 2017, 19: 375-378. DOI:10.3969/j.issn.1008-6978.2017.06.006 |
 2018, Vol. 39
2018, Vol. 39


