2. 上海交通大学附属胸科医院放疗科, 上海 200030
2. Department of Radiation Oncology, Shanghai Chest Hospital, Shanghai Jiao Tong University, Shanghai 200030, China
胸腺肿瘤是最常见的前纵隔肿瘤,一般生长缓慢,以局部浸润为主要生长方式,转移灶常常局限在胸膜、膈肌、心包等胸腔结构内,胸腔以外的转移少见[1-3]。根据2004年世界卫生组织(World Health Organization,WHO)的病理组织学分型,胸腺肿瘤被分为A、AB、B1、B2、B3型及胸腺癌;其治疗方式的选择主要依赖于临床分期,目前应用最广的是Masaoka分期(Ⅰ~Ⅳ期)[4]。手术切除是胸腺肿瘤的主要治疗手段,但即使完全切除的胸腺肿瘤仍有后期复发的可能性,其复发率达10%~30%,而胸膜是最常见的复发部位[5-7]。放射治疗和化学治疗被广泛应用在胸腺肿瘤的辅助治疗和姑息治疗中,胸腺肿瘤对放射治疗具有一定敏感性[8],但外照射有剂量上限且不良反应较大。放射性125I粒子植入是一种近距离放射治疗手段,具有微创、安全、有效的优势,其疗效在前列腺肿瘤中已得到验证[9]。本研究针对胸膜复发的胸腺肿瘤患者,探讨125I粒子植入治疗的短期疗效及安全性。
1 资料和方法 1.1 研究对象收集2016年9月至2017年6月于复旦大学附属华东医院行放射性125I粒子植入治疗的胸腺肿瘤患者资料。所有患者均经病理确诊,具备完整的临床资料和随访信息。纳入标准:(1)胸部计算机断层扫描(computed tomography,CT)等影像学证据确认有复发病灶;(2)不能耐受系统化学治疗,或既往化学治疗失败;(3)既往接受过胸部高剂量放射治疗;(4)凝血功能正常。排除标准:(1)临床预计生存时间<3个月;(2)未完成治疗;(3)有胸腔外转移。
1.2 治疗方法术前行胸部CT、超声、正电子发射断层显像-计算机断层扫描(positron emission tomography-computed tomography,PET-CT)等检查,综合各项检查结果,确定肿瘤大小、边界、位置以及肿瘤周围组织结构及血供情况,将获得的资料输入计算机放射治疗计划系统(Radiotherapy Planning System,TPS)制定治疗计划,确定125I粒子的活度、数目以及在肿瘤内的空间分布。最小周边剂量(minimal peripheral dose,MPD)为120~140 Gy,计划靶体积(planning target volume,PTV)为大体肿瘤体积(gross target volume,GTV)边缘外扩0.5~1.0 cm。PTV边缘由90%等剂量曲线覆盖。采用2%利多卡因局部浸润麻醉,根据治疗需要固定患者体位,依据TPS制定的计划确定穿刺点、进针方向及源间距,在CT或超声引导下,于穿刺点进针,插植粒子针,间距一般为0.5 cm。粒子植入后及时进行剂量验证,判断已植入的粒子是否符合治疗计划,必要时进行粒子补种以覆盖治疗盲区。
125I粒子由上海欣科医药有限公司提供,外形为圆柱形钛合金封装体,长度为4.5 mm,直径为0.8 mm,平均光子能量为27~35 keV,组织穿透距离为1.7 cm,初始剂量率为0.07 Gy/h,半衰期为59.6 d,单个粒子活度为(1.5~2.6)×107 Bq。粒子植入针和Mick粒子植入枪为美国Radio-Nuclear公司产品。超声设备为意大利百胜公司Mylab Twice高端彩色多普勒诊断仪。CT设备为美国GE公司Discovery CT750 HD宝石CT仪。TPS为广州航视医学图像技术有限公司开发的放射性粒子近距离治疗计划系统。
1.3 短期疗效评价因125I粒子半衰期为2个月,因此所有病例均在治疗后2个月进行随访。术后2个月复查胸部CT,采用2009年实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版的标准[10],以胸部CT测量数据为依据。完全缓解:病灶完全消失;部分缓解:基线病灶长径总和缩小≥30%;疾病进展:基线病灶长径总和增加≥20%,或者出现新病灶;疾病稳定:病灶缩小未达到部分缓解或增加未达到疾病进展标准。客观缓解率=(完全缓解例数+部分缓解例数)/总病例数×100%。
1.4 不良反应参考常见不良反应事件评价标准(Common Terminology Criteria for Adverse,CTCAE)4.0版本[11]判断治疗的不良反应。
2 结果 2.1 病例资料13例患者纳入本研究,其中男7例,女6例;发病年龄为30~78岁,中位年龄为50岁;经手术或穿刺活组织检查明确病理类型,其中胸腺鳞状细胞癌6例,B2型胸腺瘤3例,B3型胸腺瘤4例;转移灶位于左侧胸膜10例,右侧胸膜3例;11例曾接受过根治性胸腺肿瘤手术。所有患者既往均于上海交通大学附属胸科医院进行过胸部放射治疗。13例患者均接受过一线化学治疗,其中6例患者还接受过二线化学治疗,化学治疗方案包括CAP(环磷酰胺+多柔比星+顺铂)、DP(多烯紫杉醇+顺铂)、EP(依托泊苷+顺铂)、TC(多西他赛+环磷酰胺)、ADOC(多柔比星+顺铂+长春新碱+环磷酰胺)、IVP(异环磷酰胺+长春地辛+顺铂)、GP(吉西他滨+顺铂)等。
2.2 治疗参数13例患者的平均手术时间为35 min,范围为21~54 min;平均住院时间为1.9 d,范围为1.0~3.0 d。全组共13个靶区病灶在CT或超声引导下按计划植入125I粒子,植入粒子数中位数为30粒,范围为20~58粒;粒子剂量中位数为1.9×107 Bq,范围为(1.5~2.6)×107 Bq;总剂量中位数为15.6×107 Bq,范围为(12.0~35.0)×107 Bq;靶体积中位数为33.6 cm3,范围为7.3~108.0 cm3;缩小体积中位数为23.3 cm3,范围为4.7~65.0 cm3。
2.3 短期疗效术后2个月复查胸部CT,7例病灶达到完全缓解,6例病灶达到部分缓解,客观缓解率为100%(13/13)。伴有胸壁疼痛的4例患者症状均得到缓解。典型病例治疗前后的CT图像见图 1。在3~9个月的随访过程中,没有患者出现粒子植入部位的疾病进展。
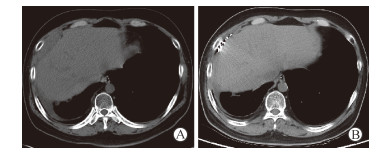
|
图 1 125I粒子植入前和植入后2个月的CT图像 Fig 1 CT before and at 2 months after 125I implantation A: Before 125I seed implantation, CT scan showed low-density lesion in the right anterior inferior chest wall near the right costophrenic angle; B: At 2 months after 125I seed implantation, CT scan only showed high-density particle shadow in the original lesion area. CT: Computed tomography |
2.4 不良反应
所有患者均顺利完成125I粒子植入术。术后1例患者出现左侧(治疗侧)少量气胸,肺组织被压缩30%,经对症处理(保守治疗)后气胸基本消失;1例患者出现发热,经对症治疗后症状缓解。无患者出现血胸、粒子移位等明显粒子植入相关并发症,未见明显皮肤放射治疗反应和血液不良反应。
3 讨论胸腺瘤的复发模式主要为局部区域性复发,大多数复发位于胸腔内,最常见的复发部位为胸膜[7],尤其是脏层胸膜[10]。有专家认为,再手术完整切除肿瘤是胸腺肿瘤复发患者积极的预后因子[11]。但实际上,再次手术后2年内出现胸膜复发的概率仍高达70%以上[12]。而且很多患者由于肿瘤侵犯位置复杂较难行手术治疗或自身身体状况不能耐受手术等原因,无法再次行手术治疗。因此化学治疗和放射治疗在复发性胸腺肿瘤的治疗中具有极其重要的作用。
目前胸腺肿瘤仍没有标准的化学治疗方案,手术后辅助化学治疗对胸腺肿瘤患者的作用也不十分明确[13],也有研究发现术后化学治疗没有明显的生存获益[14]。化学治疗对一部分复发患者显示出较好的反应,但化学治疗后缓解期相对较短,只有约8~10个月,而如何处理化学治疗后出现进展的患者仍是棘手的问题[15-16]。
虽然大部分胸腺肿瘤表现出对放射治疗的敏感性,但由于其复发位置经常毗邻于胸部的一些重要器官(心脏、肺、食管、气管等),大范围、高剂量的放射治疗会带来比较大的隐患[7],不可能无限制使用,治疗上存在困难。对于复发的胸腺肿瘤患者,尤其是以前接受过常规胸部外照射放射治疗的患者,如何施以更精准的治疗、减少对正常组织的损害值得深入探讨。
125I粒子的作用原理是通过持续释放低能量的γ射线,将能量传给带电粒子或直接产生带电粒子,从而产生电离辐射,使DNA、RNA、蛋白质等大分子化学键断裂,最终导致肿瘤细胞凋亡;对进入不同分裂周期的肿瘤细胞不间断照射,使损伤效应叠加,进而增强对肿瘤细胞的杀伤作用。125I粒子的γ射线能量为27~35 keV,组织穿透距离仅为1.7 cm,具有射线剂量可控性强、肿瘤靶区内剂量高的特点[17]。
本研究将放射性125I粒子用于胸腺肿瘤胸膜复发患者的治疗,结果显示,125I粒子植入2个月后影像学检查显示客观缓解率可达100%(13/13),伴有胸壁疼痛的4例患者的伴随症状也得到缓解。此外本研究中患者基本在术后第2天就可出院,住院周期短;治疗中使用局部麻醉,治疗时间短。这说明125I粒子对患者的身体条件要求相对低,患者普遍耐受性较好。125I粒子植入后,只有1例患者出现气胸,考虑与穿刺位置毗邻肺组织、穿刺针道较长有关,经过对症治疗后好转;1例患者出现发热。其余患者未出现明显不良反应。因此125I粒子治疗总体上较为安全可靠。
总之,本研究发现对于胸腺肿瘤胸膜复发的患者,125I粒子植入治疗具有放射源分布于靶区内的适形度好、局部治疗剂量高、持续放射时间长、治疗耐受性好、住院周期短、术后并发症少等优点,近期肿瘤缓解率高,可考虑作为放射治疗和化学治疗失败的挽救性治疗措施。但本研究尚属初步研究,病例数较少,治疗方案不完全统一,随访时间尚短,其远期疗效尚需进一步验证。
| [1] |
KONDO K. Optimal therapy for thymoma[J]. J Med Invest, 2008, 55(1/2): 17-28. |
| [2] |
KONDO K. Therapy for thymic epithelial tumors[J]. Gen Thorac Cardiovasc Surg, 2014, 62: 468-474. DOI:10.1007/s11748-014-0420-z |
| [3] |
KOMAKI R, GOMEZ D R. Radiotherapy for thymic carcinoma: adjuvant, inductive, and definitive[J/OL]. Front Oncol, 2014, 3: 330. doi: 10.3389/fonc.2013.00330. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3887269/
|
| [4] |
DETTERBECK F C, NICHOLSON A G, KONDO K, VAN SCHIL P, MORAN C. The Masaoka-Koga stage classification for thymic malignancies:clarification and definition of terms[J]. J Thorac Oncol, 2011, 6. |
| [5] |
REGNARD J F, MAGDELEINAT P, DROMER C, DULMET E, DE MONTPREVILLE V, LEVI J F, et al. Prognostic factors and long-term results after thymoma resection:a series of 307 patients[J]. J Thorac Cardiovasc Surg, 1996, 112: 376-384. DOI:10.1016/S0022-5223(96)70265-9 |
| [6] |
YUAN Z Y, GAO S G, MU J W, XUE Q, MAO Y S, WANG D L, et al. Long-term outcomes of 307 patients after complete thymoma resection[J/OL]. Chin J Cancer, 2017, 36: 46. doi: 10.1186/s40880-017-0213-8. https://cancercommun.biomedcentral.com/articles/10.1186/s40880-017-0213-8
|
| [7] |
RIMNER A, GOMEZ D R, WU A J, SHI W, YORKE E D, MOREIRA A L, et al. Failure patterns relative to radiation treatment fields for stage Ⅱ-Ⅳ thymoma[J]. J Thorac Oncol, 2014, 9: 403-409. DOI:10.1097/JTO.0000000000000099 |
| [8] |
STRÖBEL P, BAUER A, PUPPE B, KRAUSHAAR T, KREIN A, TOYKA K, et al. Tumor recurrence and survival in patients treated for thymomas and thymic squamous cell carcinomas:a retrospective analysis[J]. J Clin Oncol, 2004, 22: 1501-1509. DOI:10.1200/jco.2004.22.14_suppl.1501 |
| [9] |
GEORGAKOPOULOS J, ZYGOGIANNI A, PAPADOPOULOS G, PAPANDREOU N, KOUVARIS J, ARMONIS V, et al. Permanent implantation as brachytherapy technique for prostate carcinoma-review of clinical trials and guidelines[J]. Rev Recent Clin Trials, 2012, 7: 173-180. DOI:10.2174/157488712802281268 |
| [10] |
MARGARITORA S, CESARIO A, CUSUMANO G, MEACCI E, D'ANGELILLO R, BONASSI S, et al. Thirty-five-year follow-up analysis of clinical and pathologic outcomes of thymoma surgery[J]. Ann Thorac Surg, 2010, 89: 245-252. DOI:10.1016/j.athoracsur.2009.08.074 |
| [11] |
REGNARD J F, MAGDELEINAT P, DROMER C, DULMET E, DE MONTPREVILLE V, LEVI J F, et al. Prognostic factors and long-term results after thymoma resection:a series of 307 patients[J]. J Thorac Cardiovasc Surg, 1996, 112: 376-384. DOI:10.1016/S0022-5223(96)70265-9 |
| [12] |
KORST R J, KANSLER A L, CHRISTOS P J, MANDAL S. Adjuvant radiotherapy for thymic epithelial tumors:a systematic review and meta-analysis[J]. Ann Thorac Surg, 2009, 87: 1641-1647. DOI:10.1016/j.athoracsur.2008.11.022 |
| [13] |
ATTARAN S, MCCORMACK D, PILLING J, HARRISON-PHIPPS K. Which stages of thymoma benefit from adjuvant chemotherapy post-thymectomy?[J]. Interact Cardiovasc Thorac Surg, 2012, 15: 273-275. DOI:10.1093/icvts/ivs133 |
| [14] |
KIM B K, CHO B C, CHOI H J, SOHN J H, PARK M S, CHANG J, et al. A single institutional experience of surgically resected thymic epithelial tumors over 10 years:clinical outcomes and clinicopathologic features[J]. Oncol Rep, 2008, 19: 1525-1531. |
| [15] |
SAKAI M, ONUKI T, INAGAKI M, YAMAOKA M, KITAZAWA S, KOBAYASHI K, et al. Early-stage thymic carcinoma:is adjuvant therapy required?[J]. J Thorac Dis, 2013, 5: 161-164. |
| [16] |
WEI M L, KANG D, GU L, QIU M, ZHENGYIN L, MU Y. Chemotherapy for thymic carcinoma and advanced thymoma in adults[J/CD]. Cochrane Database Syst Rev, 2013(8): CD008588. http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD008588.pub2/full
|
| [17] |
YANG Q, PENG S, WU J, BAN X, HE M, XIE C, et al. Spectral CT with monochromatic imaging and metal artifacts reduction software for artifacts reduction of 125I radioactive seeds in liver brachytherapy[J]. Jpn J Radiol, 2015, 33: 694-705. |
 2018, Vol. 39
2018, Vol. 39


