单纯疱疹病毒Ⅰ型(herpes simplex virus typeⅠ,HSV-1)是一种普遍存在的嗜神经DNA病毒,可以潜伏在宿主神经元中并激活引起病变,最终导致细胞死亡。阿尔茨海默病(Alzheimer disease,AD)是一种以认知障碍、记忆损伤为主要临床表现的进行性神经退行性疾病,脑内大量β-淀粉样蛋白(β-amyloid,Aβ)积聚形成的老年斑和细胞内tau蛋白过度磷酸化形成的神经纤维缠结为AD的主要病理特征。流行病学调查显示,HSV-1感染可能会加重AD的病理学进程,增加HSV-1携带者患AD的风险[1]。在AD患者的大脑中,90%的老年斑附近存在HSV-1 DNA,72%的老年斑与其病毒DNA有关[2]。Aβ与HSV-1的糖蛋白gB具有一定的同源序列,研究认为,HSV-1感染可以诱导细胞内Aβ生成[3-4],HSV-1蛋白或可作为淀粉样斑块沉积中的补充剂促进Aβ的沉积[5]。但也有研究认为Aβ在对抗HSV-1感染中呈现保护作用[6]。
AD患者脑内大量HSV-1 DNA与载脂蛋白E(apolipoprotein E,ApoE)基因密切相关,ApoE和HSV-1可能在细胞表面存在交互作用。ApoE和HSV-1在与受体结合进入细胞时,都要先与细胞表面硫酸类肝素蛋白多糖(heparan sulfate proteoglycan,HSPG)分子结合,即HSV-1会与ApoE竞争细胞表面的HSPG分子,而不同基因型ApoE的蛋白结构和分子结合力等不同,从而产生一定的差异[7]。本研究通过检测HSV-1感染SH-SY5Y细胞12、24 h后相关蛋白的表达,探讨HSV-1感染与AD发病可能的联系。
1 材料和方法 1.1 材料与主要试剂非洲绿猴肾细胞(Vero细胞)、SH-SY5Y细胞均购自中国科学院典型培养物保藏委员会细胞库,HSV-1由同济大学附属第十人民医院王平教授馈赠。胎牛血清(fetal bovine serum, FBS)、DMEM培养基、DMEM/F12培养基、青霉素-链霉素双抗购自美国Gibco公司。抗ApoE抗体(ab7620)、兔抗神经元核抗原(NeuN)抗体(ab177487)、鼠抗HSV-1糖蛋白gC抗体购自英国Abcam公司;鼠抗NeuN抗体(MAB377,1:200)购自美国Merck公司;鼠抗Aβ42淀粉样蛋白抗体(MOAB-2;NBP2-13075,1:250)购自美国Novus公司;兔抗淀粉样前体蛋白(amyloid precursor protein,APP)抗体(21204)购自英国SAB公司;兔抗磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase-3β,p-GSK-3β)抗体购自美国CST公司;Alexa Fluor 594标记的抗鼠免疫球蛋白G、Alexa Fluor 488标记的抗兔免疫球蛋白G、Alexa Fluor 488标记的抗羊免疫球蛋白G荧光二抗购自美国Invitrogen公司;糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)、内参β-肌动蛋白(β-actin)及相应二抗购自武汉三鹰生物技术有限公司。化学发光显色试剂盒购自美国Millipore公司。
1.2 Vero细胞与SH-SY5Y细胞培养Vero细胞用含10% FBS的DMEM培养液,SH-SY5Y细胞用含1%青霉素-链霉素双抗、10% FBS的DMEM/F12培养液,均置于37 ℃、5% CO2细胞培养箱中常规培养,待细胞长满,弃掉培养液,用0.25%胰酶消化细胞,1:3传代培养。
1.3 HSV-1的扩增与滴度测定待Vero细胞长至80%左右时弃掉培养液,加入100 μL HSV-1悬液[5×105空斑形成单位(plaque forming unit,PFU)/mL]和适量无血清培养液于培养箱中孵育1 h,每隔20 min晃动培养液以使病毒充分接触细胞。1 h后弃掉病毒悬液,加入含3% FBS的维持液培养48 h,待细胞出现大量的细胞病变效应(cytopathic effect,CPE)后收集上清液。重复上述步骤扩增3次病毒,于-80 ℃冰箱反复冻融3次,以便充分裂解,300×g离心5 min,取上清液分装保存。于96孔板中进行HSV-1滴度测定,测得滴度为3.2×108 PFU/mL。
1.4 HSV-1感染SH-SY5Y细胞取SH-SY5Y细胞分为4组:以滴度为3.2×108 PFU/mL的HSV-1感染SH-SY5Y细胞,感染复数(multiplicity of infection,MOI)分别设为1、10、20,即为1 MOI组、10 MOI组、20 MOI组,同时设磷酸盐缓冲液(phosphate buffer saline,PBS)对照组。取处于对数生长期的SH-SY5Y细胞,消化后重悬,分别以每孔2×105个细胞的密度接种于多聚赖氨酸包被的24孔板、每孔1×106个细胞的密度接种于6孔板,置于37 ℃、5% CO2细胞培养箱中常规培养。24 h后弃掉培养液,用无血清培养液转入1、10、20 MOI HSV-1悬液,感染1 h后弃掉病毒悬液,加入含3% FBS的维持液分别培养12、24 h后行后续实验,每组设置3个复孔。显微镜下观察SH-SY5Y细胞形态变化。取细胞培养上清液,行PCR鉴定细胞外液中HSV-1 DNA的表达。HSV-1DNA上游引物:5′-TGG GAC ACA TGC CTT CTT GG-3′,下游引物:5′-ACC CTT AGT CAG ACT CTG TTA CTT ACC C-3′;扩增产物长度为147 bp。
1.5 免疫荧光检测HSV-1感染后SH-SY5Y细胞中Aβ和ApoE表达按1.4项下方法用10 MOI HSV-1感染SH-SY5Y细胞,设PBS对照组。12、24 h后取出24孔板,弃去培养液,PBS洗3次,每次3 min;4%多聚甲醛固定细胞15 min,PBS洗3次,0.5% Triton X-100(PBS配制)透膜15 min,PBS洗3次。加入10%山羊血清于室温中封闭1 h,回收封闭液,加入一抗4 ℃冰箱孵育过夜。回收一抗,PBST洗3次,加入荧光二抗室温孵育2 h。回收二抗,PBST洗3次,加入DAPI染色液孵育5 min,PBST洗3次,用抗荧光淬灭剂封片,于荧光显微镜下拍照记录。所有免疫荧光染色图像的获得采用统一的设置和曝光时间,将其转换为8字节的图片,每组随机选取至少10张图片,选择统一的感兴趣区域应用ImageJ软件分析其染色光密度。
1.6 蛋白质印迹法检测HSV-1感染后SH-SY5Y细胞中APP、GSK-3β、p-GSK-3β、黑素代谢酶(melanin metabolic enzyme,MME)、ApoE表达按1.4项下方法用10 MOI HSV-1感染SH-SY5Y细胞,设PBS对照组,用RIPA裂解液裂解提取感染12、24 h后的SH-SY5Y细胞总蛋白,采用BCA法测定总蛋白浓度。上样量为每孔30 μg,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转膜到聚偏氟乙烯膜上,加入5%牛血清白蛋白室温封闭1 h。加入一抗4 ℃孵育过夜,回收一抗,TBST洗3次,每次10 min;加入辣根过氧化物酶标记的相应二抗室温孵育2 h。TBST洗3次,化学发光液显影,并使用ImageJ软件进行灰度分析。
1.7 统计学处理应用GraphPad Prism 5.0软件进行统计学分析。所有数据均以x±s表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 HSV-1感染后SH-SY5Y细胞形态的改变由图 1可见,HSV-1分别感染SH-SY5Y细胞12、24 h后,HSV-1为10 MOI时细胞中HSV-1 DNA已显著表达。因此,选用10 MOI HSV-1行后续实验。
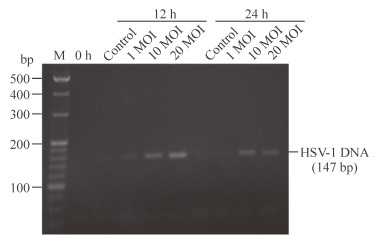
|
图 1 感染HSV-1后细胞上清中HSV-1 DNA表达 Fig 1 Expression of HSV-1 DNA in supernatants HSV-1: Herpes simplex virusⅠ; M: Marker; MOI : Multiplicity of infection |
10 MOI的HSV-1感染SH-SY5Y细胞12 h后,镜下可见细胞神经突起开始减少,且出现神经突起回缩;感染24 h后很少有明显的神经突起存在,且细胞开始聚集,呈圆形,并有细胞脱落。见图 2。
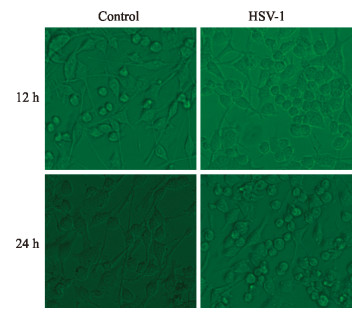
|
图 2 10 MOI HSV-1感染后SH-SY5Y细胞的形态改变 Fig 2 HSV-1 (10 MOI) infection inducing morphological changes in SH-SY5Y cells MOI: Multiplicity of infection; HSV-1: Herpes simplex virusⅠ. Original magnification: ×200 |
2.2 HSV-1感染诱导SH-SY5Y细胞表达Aβ
10 MOI的HSV-1感染12 h后,免疫荧光染色可观察到明显的Aβ阳性染色(图 3A),且与对照组相比,HSV-1感染组细胞中Aβ的表达增加(P<0.01,图 3C)。HSV-1感染24 h后Aβ阳性染色主要集中于细胞内(图 3B),Aβ表达较12 h时有所下降(P<0.01),但仍较对照组高(P<0.05,图 3C)。
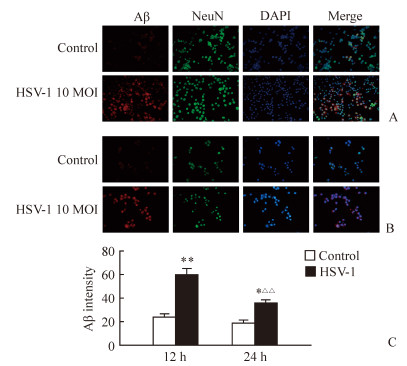
|
图 3 10 MOI HSV-1感染对SH-SY5Y细胞Aβ表达的影响 Fig 3 Effect of HSV-1 (10 MOI) infection on Aβ expression in SH-SY5Y cells A: Expression of Aβ in SH-SY5Y cells on 12 h of post-infection; B: Expression of Aβ in SH-SY5Y cells on 24 h of post-infection; C: Statistical analysis of immuno-intensity of Aβ in control and HSV-1 infected group. HSV-1: Herpes simplex virusⅠ; Aβ: β-Amyloid; MOI: Multiplicity of infection; NeuN: Neuronal nuclei; DAPI: 4', 6-diamidino-2-phenylindole. Original magnification: ×400 (A, B). *P < 0.05, **P < 0.01 vs control group at the same time point; △△P < 0.01 vs HSV-1 group at 12 h. n=3, x±s |
2.3 HSV-1感染对SH-SY5Y细胞ApoE表达的影响
10 MOI的HSV-1感染12 h后,SH-SY5Y细胞中ApoE蛋白的表达与对照组相比差异无统计学意义(P>0.05);感染24 h后,ApoE蛋白的表达增加(P<0.01),见图 4A~4C。免疫荧光染色结果(图 4D)显示,HSV-1 gC蛋白和ApoE蛋白主要聚集在细胞核周围,两者免疫荧光共染提示其可能相互作用,影响HSV-1感染诱导Aβ的表达。

|
图 4 10 MOI HSV-1感染对SH-SY5Y细胞ApoE表达的影响 Fig 4 Effect of HSV-1 (10 MOI) infection on ApoE expression in SH-SY5Y cells A: Expression of ApoE in SH-SY5Y cells 12 h post-infection; B: Expression of ApoE in SH-SY5Y cells 24 h post-infection; C: Statistical analysis of immuno-intensity of ApoE in control and HSV-1 infected group; D: HSV-1 gC co-localized with ApoE protein in perinuclear after HSV-1 infection. HSV-1: Herpes simplex virusⅠ; ApoE: Apolipoprotein E; MOI: Multiplicity of infection; NeuN: Neuronal nuclei; DAPI: 4', 6-diamidino-2-phenylindole. Original magnification: ×400 (A, B, D). **P < 0.01 vs control group at the same time point. n=3, x±s |
2.4 HSV-1调控APP、MME、ApoE蛋白表达及GSK-3β活化过程
蛋白质印迹结果(图 5)显示,与对照组相比,HSV-1感染12 h后细胞中APP蛋白的表达水平降低(P<0.05),GSK-3β总蛋白的表达水平增加(P<0.05)且Ser9位磷酸化活性增强(P<0.05),MME蛋白的表达水平增加(P<0.01);感染24 h后细胞中MME蛋白的表达水平降低(P<0.05),ApoE蛋白的表达水平增加(P<0.05)。
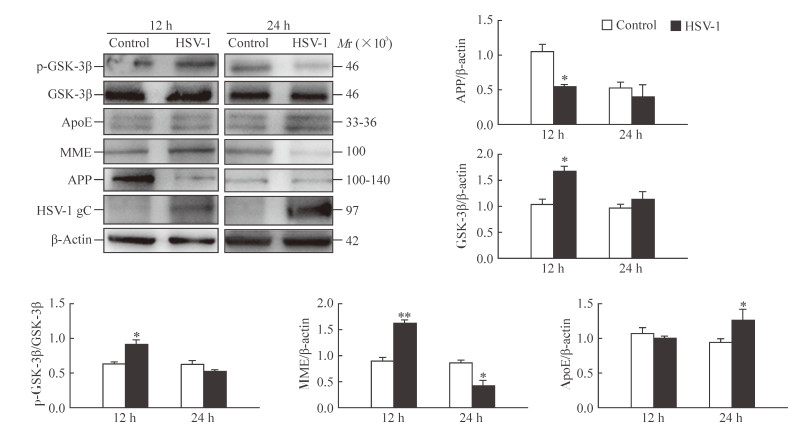
|
图 5 HSV-1对APP、GSK-3β、p-GSK-3β、MME、ApoE表达的影响 Fig 5 Effect of HSV-1 infection on expressions of APP, MME, ApoE, GSK-3β and p-GSK-3β in SH-SY5Y cells HSV-1: Herpes simplex virusⅠ; APP: Amyloid precursor protein; GSK-3β: Glycogen synthase kinase-3β; p-GSK-3β: Phosphorylated glycogen synthase kinase-3β; MME: Melanin metabolic enzyme; ApoE: Apolipoprotein E. *P < 0.05, **P < 0.01 vs control group at the same time point. n=3, x±s |
3 讨论
HSV-1为嗜神经性DNA病毒,可在中枢神经系统中建立潜伏感染,其激活导致神经病变,且可在免疫低下等情况下复发。有研究发现,HSV-1感染与AD的发生和发展密切相关,其可以增加病毒携带者患病的风险[8]。目前关于HSV-1与神经元的体外研究主要集中于鼠原代神经元和全能干细胞,本实验选用SH-SY5Y细胞是因为该细胞可以模拟神经元,与神经元在生物学和功能特征上有许多相似性,相对于原代神经元可重复性好,且对于培养条件要求更简单[9]。
HSV-1侵染细胞的过程复杂。病毒包膜上含有多种糖蛋白,糖蛋白gB、gC、gD、gH、gL均参与病毒对细胞的侵染。gB和gC蛋白可以介导病毒与细胞表面的硫酸类肝素蛋白多糖分子结合,从而促进gD蛋白与细胞表面的特异性受体结合,进而触发病毒包膜与细胞膜融合,促进病毒进入细胞[10]。
研究发现,AD患者的大脑中HSV-1主要分布于Aβ斑块附近[11],且HSV-1 gB蛋白与Aβ有一定的同源性,这提示HSV-1可能影响脑内Aβ的水平。大脑内Aβ水平的调节主要有Aβ生成和降解两条途径。细胞合成的APP若被β-分泌酶和α-分泌酶连续切割形成Aβ肽分泌到细胞外,一般认为不会对细胞造成太大损伤;但经过β-分泌酶和γ-分泌酶的连续切割,则会生成Aβ40或Aβ42的片段,而Aβ42片段更易造成Aβ寡聚体的形成,促进Aβ聚集进而产生细胞毒性。MME可以降解脑内错误折叠以及缠结的Aβ肽。
本研究发现HSV-1感染SH-SY5Y细胞12 h后Aβ蛋白表达明显增加,而APP蛋白的表达降低,同时ApoE蛋白的表达无明显改变。但感染24 h后,APP蛋白表达无明显改变,而ApoE蛋白表达增加;Aβ蛋白表达较对照组虽有所增加,但相较12 h时却下降。本研究中采用的MOAB2为特异性针对Aβ的1~4位氨基酸残基的抗体[12],而HSV-1gB蛋白与Aβ42的同源性位置为22~42位氨基酸[3],因此Aβ表达的增加并不是由于其与HSV-1存在交叉反应。这提示Aβ表达升高可能与HSV-1感染、ApoE蛋白表达有关。
以往研究发现,HSV-1感染神经元后一方面会诱导APP发生剪切,导致Aβ和其他神经毒性片段在神经元内外累积[13-14],其产生的羧基端APP可以改变HSV-1进入神经元的方式,调控脑啡肽酶和GSK-3β的转录,参与Aβ级联反应;另一方面,HSV-1可以活化GSK-3依赖性通路进而上调神经元内Aβ的表达[15]。APP为一种跨膜蛋白,GSK-3β可以干预APP的裂解过程,诱导淀粉样途径的进行,从而促进Aβ的生成。本研究发现HSV-1感染12 h后APP蛋白的表达降低(P<0.05),表明HSV-1在感染12 h时通过影响APP的代谢过程进而影响Aβ产生,而Aβ的增多可以反馈增加MME的表达。GSK-3β磷酸化增强,活性下降,从而促进病毒通过微管网络进行蔓延[16-17]。感染24 h时APP、GSK-3β蛋白的表达均无明显变化,MME蛋白表达降低,提示此时HSV-1主要是影响其降解过程而促进Aβ增加,此时ApoE蛋白表达增加,可与HSV-1竞争表面受体,减少HSV-1进入细胞,从而导致Aβ的表达弱于感染12 h时。
总之,本研究表明HSV-1感染可以诱导SH-SY5Y细胞Aβ表达增加,感染12 h时Aβ表达增加与促进APP蛋白代谢密切相关,可能是通过影响GSK-3β的活化从而增加Aβ表达;感染24 h时HSV-1可能主要是抑制其降解过程进而增加Aβ的表达,此时ApoE蛋白表达增强,其可能与HSV-1竞争细胞表面受体,减少HSV-1进入细胞发挥作用,导致Aβ表达弱于感染12 h时。这为进一步阐明HSV-1参与AD发病的观点提供了证据,其分子机制仍需进一步实验验证。
| [1] |
MIKLOSSY J. Emerging roles of pathogens in Alzheimer disease[J/OL]. Expert Rev Mol Med, 2011, 13: e30. doi: 10.1017/s1462399411002006.
|
| [2] |
JAMIESON G A, MAITLAND N J, WILCOCK G K, CRASKE J, ITZHAKI R F. Latent herpes simplex virus type 1 in normal and Alzheimer's disease brains[J]. J Med Virol, 1991, 33: 224-227. DOI:10.1002/(ISSN)1096-9071 |
| [3] |
WOZNIAK M A, ITZHAKI R F, SHIPLEY S J, DOBSON C B. Herpes simplex virus infection causes cellular β-amyloid accumulation and secretase upregulation[J]. Neurosci Lett, 2007, 429(2/3): 95-100. |
| [4] |
SANTANA S, RECUERO M, BULLIDO M J, VALDIVIESO F, ALDUDO J. Herpes simplex virus type Ⅰ induces the accumulation of intracellular beta-amyloid in autophagic compartments and the inhibition of the non-amyloidogenic pathway in human neuroblastoma cells[J]. Neurobiol Aging, 2012, 33: 430. |
| [5] |
CRIBBS D H, AZIZEH B Y, COTMAN C W, LAFERLA F M. Fibril formation and neurotoxicity by a herpes simplex virus glycoprotein B fragment with homology to the Alzheimer's Aβ peptide[J]. Biochemistry, 2000, 39: 5988-5994. DOI:10.1021/bi000029f |
| [6] |
BOURGADE K, GARNEAU H, GIROUX G, LE PAGE A Y, BOCTI C, DUPUIS G, et al. β-Amyloid peptides display protective activity against the human Alzheimer's disease-associated herpes simplex virus-1[J]. Biogerontology, 2014, 16: 85-98. |
| [7] |
ITZHAKI R F, WOZNIAK M A. Herpes simplex virus type 1 in Alzheimer's disease:the enemy within[J]. J Alzheimers Dis, 2008, 13: 393-405. DOI:10.3233/JAD-2008-13405 |
| [8] |
MCNAMARA J, ANN MURRAY T A. Connections between herpes simplex virus type 1 and Alzheimer's disease pathogenesis[J]. Curr Alzheimer Res, 2016, 13: 996-1005. DOI:10.2174/1567205013666160314150136 |
| [9] |
SHIPLEY M M, MANGOLD C A, KUNY C V, SZPARA M L. Differentiated human SH-SY5Y cells provide a reductionist model of herpes simplex virus 1 neurotropism[J/OL]. J Virol, 2017, 91. doi: 10.1128/jvi.00958-17.
|
| [10] |
SPEAR P G. Herpes simplex virus:receptors and ligands for cell entry[J]. Cell Microbiol, 2004, 6: 401-410. DOI:10.1111/cmi.2004.6.issue-5 |
| [11] |
WOZNIAK M A, MEE A P, ITZHAKI R F. Herpes simplex virus type 1 DNA is located within Alzheimer's disease amyloid plaques[J]. J Pathol, 2009, 217: 131-138. DOI:10.1002/path.v217:1 |
| [12] |
YOUMANS K L, TAI L M, KANEKIYO T, STINE W B, MICHON S C, NWABUISI-HEATH E, et al. Intraneuronal Aβ detection in 5xFAD mice by a new Aβ-specific antibody[J]. Mol Neurodegener, 2012, 7-8. |
| [13] |
DE CHIARA G, MARCOCCI M E, CIVITELLI L, ARGNANI R, PIACENTINI R, RIPOLI C, et al. APP processing induced by herpes simplex virus type 1(HSV-1) yields several APP fragments in human and rat neuronal cells[J/OL]. PLoS One, 2010, 5: e13989. doi: 10.1371/journal.pone.0013989.
|
| [14] |
HARRIS S A, HARRIS E A. Molecular mechanisms for herpes simplex virus type 1 pathogenesis in Alzheimer's disease[J]. Front Aging Neurosci, 2018, 10: 48. DOI:10.3389/fnagi.2018.00048 |
| [15] |
PIACENTINI R, LI PUMA D D, RIPOLI C, MARCOCCI M E, DE CHIARA G, GARACI E, et al. Herpes simplex virus type-1 infection induces synaptic dysfunction in cultured cortical neurons via GSK-3 activation and intraneuronal amyloid-beta protein accumulation[J/OL]. Sci Rep, 2015, 5: 15444. doi: 10.1038/srep15444.
|
| [16] |
CIVITELLI L, MARCOCCI M E, CELESTINO I, PIACENTINI R, GARACI E, GRASSI C, et al. Herpes simplex virus type 1 infection in neurons leads to production and nuclear localization of APP intracellular domain (AICD):implications for Alzheimer's disease pathogenesis[J]. J Neurovirol, 2015, 21: 480-490. DOI:10.1007/s13365-015-0344-0 |
| [17] |
NAGHAVI M H, GUNDERSEN G G, WALSH D. Plus-end tracking proteins, CLASPs, and a viral Akt mimic regulate herpesvirus-induced stable microtubule formation and virus spread[J]. Proc Natl Acad Sci USA, 2013, 110: 18268-18273. DOI:10.1073/pnas.1310760110 |
 2018, Vol. 39
2018, Vol. 39


