2. 上海交通大学分析测试中心, 上海 200240;
3. 上海中医药大学附属岳阳中西医结合医院营养科, 上海 200437
2. Instrumental Analysis Center, Shanghai Jiao Tong University, Shanghai 200240, China;
3. Department of Nutriology, Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China
随着生活水平的提高和饮食结构的改变,非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)成为世界上最普遍的肝脏疾病之一,且其发病率日渐增高,尤其是在发达国家,成人发病率已达30%[1]。如果不早期干预和预防,NAFLD可逐渐发展成坏死性炎症,甚至肝纤维化,导致肝功能损伤[2-3]。随着肝功能损伤程度的加重,机体产生胰岛素抵抗,高水平的胰岛素可促进骨骼肌及脂肪组织对支链氨基酸的摄取和利用,导致血清支链氨基酸如亮氨酸、异亮氨酸水平显著降低,使血浆氨基酸谱改变[4-5]。叶春和房宇[6]研究也发现,NAFLD大鼠血清支链氨基酸和芳香族氨基酸水平均下降,瓜氨酸和鸟氨酸水平明显增加,牛磺酸水平明显下降,表明NAFLD可使氨基酸代谢紊乱。上述研究提示改善氨基酸代谢紊乱可能有益于NAFLD的预防与治疗。
由于NAFLD的发生与发展与脂代谢紊乱尤其是高脂血症密切相关,目前,治疗NAFLD可以通过非药物手段和药物手段,其中药物治疗主要是利用他汀类降血脂药物控制NAFLD的发展。已有研究发现降脂药物辛伐他汀在调节人体脂质代谢的同时,对氨基酸代谢也有调节作用[7]。但长期使用他汀类药物易引起睡眠障碍[8],另一严重不良反应是其标准剂量下可引起血清肌酸激酶增加而导致肌病[9]。因此,寻求安全有效的天然活性物质以预防和干预NAFLD具有非常重要的现实意义。
植物甾醇由甾核主体和侧链基团两部分构成,广泛存在于富含油脂的植物种子、坚果和谷物中。植物甾醇酯(phytosterol ester,PSE)由植物甾醇酯化而成,其脂溶性和生物利用度优于游离植物甾醇。研究显示植物甾醇及PSE具有降胆固醇和调节血脂[10-11]以及抗氧化[12]等生理功能。我们前期的动物实验研究表明,PSE 3 g/d可有效减轻高脂饮食诱导NAFLD大鼠的肝脂肪变性[13]。本实验采用高脂饮食建立NAFLD大鼠模型,进一步研究PSE对血清氨基酸谱的影响,从氨基酸代谢角度初步阐明PSE减轻NAFLD肝脂肪变性的作用途径。
1 材料和方法 1.1 实验动物与材料1个月龄健康雄性SD大鼠,清洁级,平均体质量为(100±10)g,由上海斯莱克实验动物有限公司提供[动物生产许可证号:SCXK(沪)2012-0002]。PSE由巴斯夫(中国)有限公司提供,总PSE和植物甾醇含量≥97%,其中PSE含量≥91%,游离植物甾醇含量≤6%;甾醇组成:胆甾醇含量≤2%,菜籽甾醇含量≤6%,菜油甾醇含量为20%~29%,豆甾醇含量为12%~23%,β-谷甾醇含量为42%~55%,D5-燕麦甾醇含量≤4%,D7-燕麦甾醇含量≤2%,D7-豆甾烯醇含量≤2%,其他组分含量≤5%。氨基酸混合物标准溶液B型(AWM1998)和AN-2型(AWM1614)均购自日本和光纯药工业株式会社;10%三氯乙酸溶液(优级纯)和8 mol/L氢氧化钠(NaOH)溶液(优级纯)均购自国药集团化学试剂有限公司;L-8900型全自动氨基酸分析仪为日本Hitachi公司产品。
1.2 分组与干预将31只SD大鼠给予基础饲料适应性喂养7 d后,随机分为3组:正常对照组(NC组,n=7)、高脂模型组(HF组,n=12)和PSE干预组(PSE+HF组,n=12)。其中,NC组大鼠饲喂基础饲料,HF和PSE+HF组饲喂高脂饲料。NC组及HF组均以纯牛奶灌胃,PSE+HF组按照10 mL/kg每天灌胃给予PSE(0.05 g/mL)强化牛奶(即每天给予PSE剂量为0.5 g/kg)。实验期间记录大鼠摄食量及体质量。实验干预12周后,禁食12 h,麻醉后于腹主动脉取血,分离血清,保存于-80 ℃备用。基础饲料配方:水分含量≤10%,粗蛋白含量≥20%,粗脂肪含量≥4%,粗纤维含量≤5%,灰分含量≤8%,矿物质及氨基酸含量为1.6%~5.1%。高脂饲料配方:基础饲料含量为52.4%,猪油含量为20%,胆固醇含量为1%,胆盐含量为2%,蔗糖含量为10%,酪蛋白含量为10%,麦芽糊精含量为2.7%,其他组分含量为1.9%。
1.3 肝组织病理分析将肝组织冰冻切片(层厚为4~8 μm)常温干燥15~20 min,加入100%异丙醇孵育5 min,加入0.5%的油红O溶液60 ℃孵育8 min。经85%异丙醇溶液洗3 min,双脱水洗后,苏木精染1.5 min。双脱水洗,封片剂封片,于普通光学显微镜下观察。根据肝脏组织学变化情况,将肝脏脂肪变性程度分为4个等级:“-”表示肝细胞结构正常或偶见肝细胞脂肪变性,“+”表示1/3以下的肝细胞脂肪变性,“++”表示1/3~2/3的肝细胞脂肪变性,“+++”为2/3以上的肝细胞脂肪变性。
1.4 血清游离氨基酸谱检测取-80 ℃冻存的血清150 μL,按照1:1体积比加入4 ℃预冷的10%三氯乙酸溶液,混匀,4 ℃反应1 h。20 000×g 4 ℃离心30 min。取上清液,加入8 mol/L的NaOH溶液,调pH为2。20 000×g 4 ℃离心30 min。取150 μL上清进行血清游离氨基酸谱检测。
1.5 统计学处理应用SPSS 19.0软件对实验数据进行统计学分析。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用LSD法。利用Pearson相关性分析判断各氨基酸与肝脏脂肪变性程度的相关性。利用SIMCA-P 11.5软件进行偏最小二乘法判别分析。检验水准(α)为0.05。
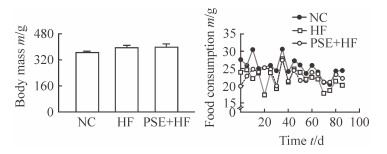
2 结果 2.1 PSE对NAFLD大鼠体质量、摄食量与肝组织形态学的影响各组大鼠干预后体质量及实验期间摄食量情况见图 1,在高脂饮食情况下,PSE+HF组与HF组大鼠体质量变化差异无统计学意义(P>0.05),且3组大鼠摄食量差异无统计学意义(P>0.05)。肝组织油红O染色结果见图 2,NC组大鼠肝组织未见红染,肝小叶及细胞核清晰,肝细胞索排列整齐,7只大鼠脂肪变性评估结果均为“-”;HF组肝细胞内脂滴被染成红色,大小不一,广泛分布在细胞质中,12只大鼠脂肪变性评估“+”2只、“++”4只、“+++”6只;PSE干预组肝细胞红染程度较HF组得到明显改善,12只大鼠脂肪变性评估“+”4只、“++”5只、“+++”3只。
|
图 1 各组大鼠体质量和摄食量 Fig 1 Body mass and food consumption of rats in each group NC: Normal control group; HF: High fat diet group; PSE+HF: High fat diet and phytosterol ester intervention group. n=7 in NC group, n=12 in HF group, n=12 in PSE+HF group; x±s |

|
图 2 PSE对大鼠肝组织形态学的影响 Fig 2 Effect of phytosterol ester (PSE) on rat liver histomorphology A: Normal control (NC) group; B: High fat diet (HF) group; C: High fat diet and PSE intervention (PSE+HF) group. Original magnification: ×200 |
2.2 PSE对NAFLD大鼠血清必需氨基酸含量的影响
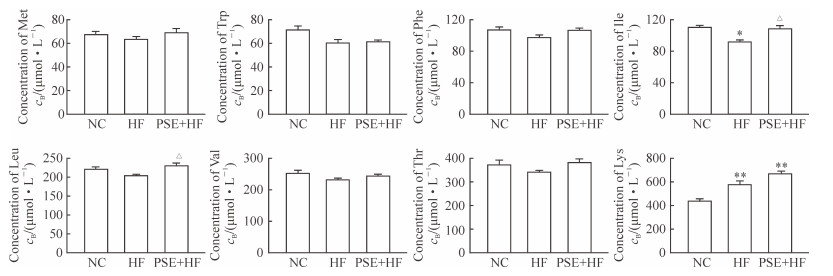
与NC组比较,HF组大鼠血清异亮氨酸含量降低,赖氨酸含量增加,差异均有统计学意义(P<0.05,P<0.01)。PSE干预后,大鼠血清异亮氨酸和亮氨酸含量分别较HF组增加了17.25%和12.42%,且差异均有统计学意义(P<0.05或P<0.01)。见图 3。
|
图 3 PSE对大鼠血清必需氨基酸含量的影响 Fig 3 Effects of phytosterol ester (PSE) on serum essential amino acid profile in rats NC: Normal control group; HF: High fat diet group; PSE+HF: High fat diet and PSE intervention group. Met: Methionine; Trp: Tryptophan; Phe: Phenylalanine; Ile: Isoleucine; Leu: Leucine; Val: Valine; Thr: Threonine; Lys: Lysine. *P < 0.05, **P < 0.01 vs NC group; △P < 0.05 vs HF group. n=7 in NC group, n=12 in HF group, n=12 in PSE+HF group; x±s |
2.3 PSE对NAFLD大鼠血清非必需氨基酸含量的影响
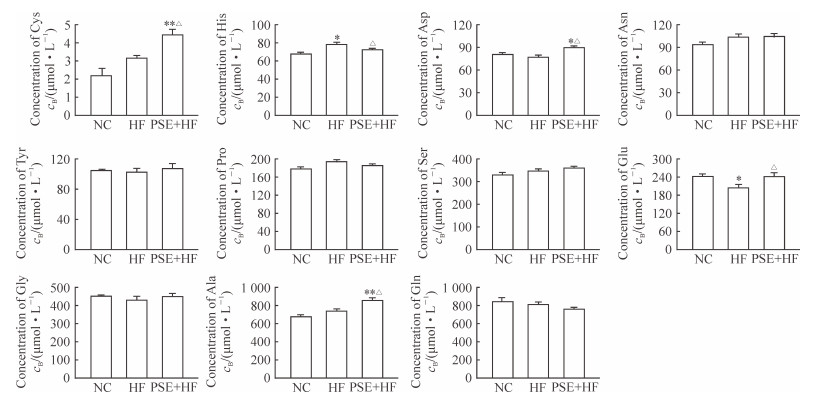
与NC组相比,HF组大鼠血清组氨酸含量增加,而谷氨酸含量降低,差异均有统计学意义(P<0.05)。PSE干预后,半胱氨酸、天冬氨酸、谷氨酸和丙氨酸含量分别较HF组增加了41.47%、15.61%、17.87%和16.07%,且差异均有统计学意义(P<0.05);而组氨酸含量较HF组降低,差异有统计学意义(P<0.05)。见图 4。
|
图 4 PSE对大鼠血清非必需氨基酸含量的影响 Fig 4 Effects of phytosterol ester (PSE) on serum non-essential amino acid profile in rats NC: Normal control group; HF: High-fat diet group; PSE+HF: High fat diet and PSE intervention group. Cys: Cystine; His: Histidine; Asp: Aspartic acid; Asn: Asparagine; Tyr: Tyrosine; Pro: Proline; Ser: Serine; Glu: Glutamic acid; Gly: Glycine; Ala: Alanine; Gln: Glutamine. *P < 0.05, **P < 0.01 vs NC group; △P < 0.05 vs HF group. n=7 in NC group, n=12 in HF group, n=12 in PSE+HF group; x±s |
2.4 PSE对NAFLD大鼠血清氨基酸相关代谢物水平的影响
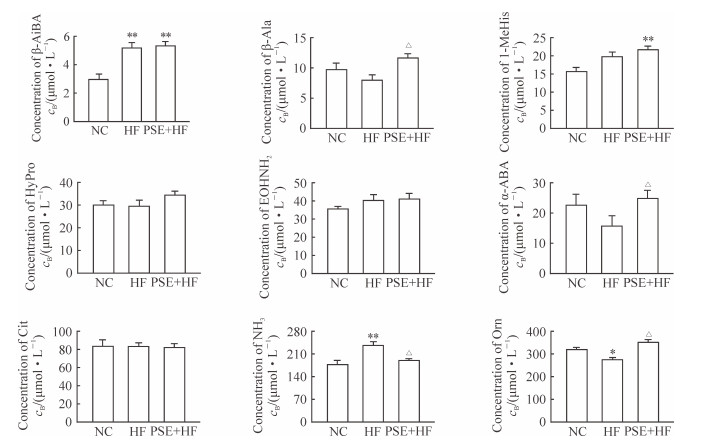
HF组大鼠血清β-氨基异丁酸和血氨水平均高于NC组,鸟氨酸含量低于NC组,差异均有统计学意义(P<0.05,P<0.01)。与HF组相比,PSE干预后大鼠血清β-丙氨酸、α-氨基正丁酸和鸟氨酸的含量分别增加了45.81%、57.54%和28.60%,血氨水平降低了20.21%,且差异均有统计学意义(P<0.05)。见图 5。
|
图 5 PSE对大鼠血清氨基酸相关代谢物水平的影响 Fig 5 Effect of phytosterol ester (PSE) on serum amino acid metabolites in rats NC: Normal control group; HF: High-fat diet group; PSE+HF: High-fat diet and PSE intervention group. β-AiBA: β-Aminoisobutyric acid; β-Ala: β-Alanine; 1-MeHis: 1-Methylhistidine; HyPro: Hydroxyproline; EOHNH2: Ethanolamine; α-ABA: α-Amino-n-butyric acid; Cit: Citrulline; NH3: Ammonia; Orn: Ornithine. *P < 0.05, **P < 0.01 vs NC group; △P < 0.05 vs HF group. n=7 in NC group, n=12 in HF group, n=12 in PSE+HF group; x±s |
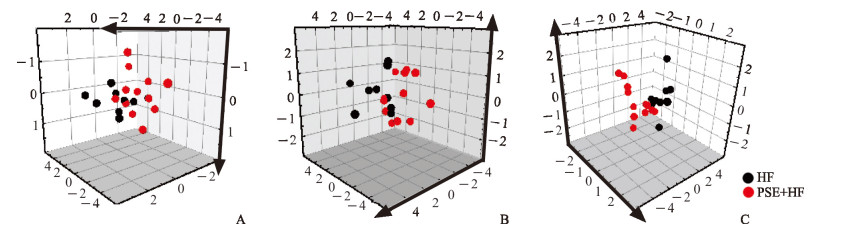
2.5 PSE对NAFLD大鼠血清氨基酸的综合影响
偏最小二乘法判别分析结果表明,HF组与PSE+HF组可分别聚类,进一步证明PSE干预后大鼠氨基酸代谢紊乱可在一定程度上得到纠正(图 6)。Pearson相关性分析结果表明,组氨酸、脯氨酸及血氨水平与肝脏脂肪变性程度(以肝三酰甘油、总胆固醇和非酯化脂肪酸水平综合计算)呈正相关(r=0.64、0.52、0.58,P均<0.01),色氨酸、苯丙氨酸、异亮氨酸、半胱氨酸、谷氨酸及相关代谢物鸟氨酸与肝脏脂肪变性程度呈负相关(r=-0.49、-0.49、-0.57、-0.64、-0.47、-0.56,P均<0.05)。
|
图 6 大鼠血清氨基酸谱偏最小二乘法判别分析结果 Fig 6 Partial least squares-discriminant analysis (PLS-DA) of serum amino acid spectrum in rats A: Essential amino acid profile; B: Non-essential amino acid profile; C: Amino acid metabolites. HF: High-fat diet group; PSE+HF: High-fat diet and phytosterol ester intervention group |
3 讨论
目前,关于植物甾醇的生物学活性研究多集中在调节胆固醇代谢、降血脂、抗氧化及抗炎等方面,但其对氨基酸代谢的影响尚未见报道。体内不同种类的氨基酸可发挥不同的生理功能,如色氨酸、酪氨酸和半胱氨酸具有较强的抗氧化活性[14];精氨酸和丙氨酸与血糖水平密切相关[15]。另有研究提示,小鼠体内氨基酸种类及含量可影响高脂饮食诱导的肥胖、胰岛素抵抗及肝脂质变性程度[16]。故本研究利用高脂饮食建立NAFLD大鼠模型,通过分析PSE干预对NAFLD大鼠血清氨基酸谱的影响,从氨基酸代谢角度初步探讨PSE发挥预防NAFLD作用的相关途径。
本研究结果显示,与正常饮食的NC组大鼠相比,高脂饮食可引起NAFLD大鼠氨基酸代谢紊乱,而PSE干预可调节高脂饮食引起的氨基酸代谢紊乱,且氨基酸谱更接近NC组。本研究还通过偏最小二乘法判别分析结果进一步证明,PSE干预后大鼠氨基酸代谢紊乱可在一定程度上得到纠正。Dudek和Semenkovich[17]研究表明,必需氨基酸可能通过调节非载荷tRNA水平影响脂肪酸合成酶的表达,从而调节脂代谢;Trupp等[7]研究发现,他汀类药物在降低人血清低密度脂蛋白胆固醇水平的同时,可显著增加血清必需氨基酸亮氨酸、苏氨酸、赖氨酸、苯丙氨酸的水平。本研究发现,具有降脂作用的PSE可增加NAFLD大鼠血清中支链必需氨基酸亮氨酸和异亮氨酸的含量,而较高支链氨基酸摄入通常有较低的肥胖发生率[18]。另有研究表明,亮氨酸可能通过降低脂肪酸转运与相关蛋白质合成而抑制脂肪酸的合成,从而发挥降脂作用[19];亮氨酸还可通过调控沉默信息调节因子2同源蛋白1(silent mating-type information regulation 2 homolog 1,SIRT1)的表达促进脂肪分解[20]。
此外,有研究显示赖氨酸可以提高肉毒碱水平,从而缓解三酰甘油的积累[21]。胡晓霞[22]研究发现,苏氨酸能显著降低生长中期草鱼肌肉脂肪含量,提示苏氨酸的增加可能有促进脂肪分解、降低体脂的作用。本研究发现与HF组大鼠相比,PSE干预可使NAFLD大鼠血清赖氨酸、色氨酸、苯丙氨酸和苏氨酸含量增加,但差异无统计学意义。
本研究还发现PSE干预后NAFLD大鼠血清半胱氨酸、天冬氨酸和丙氨酸含量较HF组增加,而组氨酸含量降低,与既往研究结果[7]一致。非必需氨基酸在维持机体正常运转中同样扮演重要角色,上述非必需氨基酸中,半胱氨酸是构成体内重要抗氧化物质谷胱甘肽(glutathione,GSH)的主要成分,GSH的合成受饮食中半胱氨酸含量的影响[23]。肝脏还可通过分解半胱氨酸得到牛磺酸,从而发挥对肝组织的保护作用[21]。Yanni等[24]报道,口服天冬氨酸和谷氨酸可抑制兔体内高胆固醇饮食造成的脂肪肝。以上研究结果均表明,PSE对脂质代谢的调节作用可能与其对氨基酸代谢的调节有关。
氨基酸在相互转化和合成其他物质的过程中会产生许多代谢物。本研究发现,高脂诱导NAFLD大鼠的血氨水平较NC组升高,可能是因为在NAFLD状态下肝功能受损,合成尿素的能力减退,氨的清除减少,肝脏的解毒功能降低,而长期高血氨水平可通过激活线粒体途径引起肝细胞凋亡,从而进一步加剧肝损伤[25]。PSE干预使NAFLD大鼠血氨水平降低,表明PSE对高脂饮食诱导的NAFLD大鼠的肝脏具有一定的保护作用。此外,目前超声引导下肝穿刺活组织检查是确诊NAFLD的金标准,但该方法不易被患者接受;NAFLD患者血液生物化学检查项目主要有血清酶、β球蛋白、铁蛋白、载脂蛋白A1以及胆汁酸等,这些指标敏感性低且无特异性。而本研究发现,组氨酸和血氨水平与NAFLD肝脏脂肪变性程度呈正相关。NAFLD状态下肝脏代谢功能下降,肝合成尿素能力下降,导致血氨升高,提示血氨水平可联合其他生物化学指标及影像学检查作为NAFLD的诊断参考依据,但尚需要更多的实验室生物化学检查数据进一步证实。
| [1] |
AGRAWAL S, DUSEJA A K. Non-alcoholic fatty liver disease:East versus West[J]. J Clin Exp Hepatol, 2012, 2: 122-134. DOI:10.1016/S0973-6883(12)60101-7 |
| [2] |
COHEN J C, HORTON J D, HOBBS H H. Human fatty liver disease:old questions and new insights[J]. Science, 2011, 332: 1519-1523. DOI:10.1126/science.1204265 |
| [3] |
KATSIKI N, MIKHAILIDIS D P, MANTZOROS C S. Non-alcoholic fatty liver disease and dyslipidemia:an update[J]. Metabolism, 2016, 65: 1109-1123. DOI:10.1016/j.metabol.2016.05.003 |
| [4] |
HOLECEK M. Branched-chain amino acids and ammonia metabolism in liver disease:therapeutic implications[J]. Nutrition, 2013, 29: 1186-1191. DOI:10.1016/j.nut.2013.01.022 |
| [5] |
吕铮, 孟庆华. 肝硬化患者支链氨基酸的应用进展[J]. 临床肝胆病杂志, 2015, 31: 475-457. DOI:10.3969/j.issn.1001-5256.2015.03.040 |
| [6] |
叶春, 房宇. 非酒精性脂肪肝大鼠血清氨基酸谱的改变及分析[J]. 南京师大学报(自然科学版), 2016, 39: 90-94. |
| [7] |
TRUPP M, ZHU H, WIKOFF W R, BAILLIE R A, ZENG Z B, KARP P D, et al. Metabolomics reveals amino acids contribute to variation in response to simvastatin treatment[J/OL]. PLoS One, 2012, 7: e38386. doi: 10.1371/journal.pone.0038386.
|
| [8] |
BRONCEL M, GORZELAK-PABIŚ P, SAHEBKAR A, SEREJKO K, URSONIU S, RYSZ J, et al. Sleep changes following statin therapy:a systematic review and meta-analysis of randomized placebo-controlled polysomnographic trials[J]. Arch Med Sci, 2015, 11: 915-926. |
| [9] |
STROES E S, THOMPSON P D, CORSINI A, VLADUTIU G D, RAAL F J, RAY K K, et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management[J/OL]. Eur Heart J, 2015, 36: 1012. doi: 10.1093/eurheartj/ehv043.
|
| [10] |
AWAISHEH S S, KHALIFEH M S, AL-RUWAILI M A, KHALIL O M, AL-AMERI O H, AL-GROOM R. Effect of supplementation of probiotics and phytosterols alone or in combination on serum and hepatic lipid profiles and thyroid hormones of hypercholesterolemic rats[J]. J Dairy Sci, 2013, 96: 9-15. DOI:10.3168/jds.2012-5442 |
| [11] |
KATAN M B, GRUNDY S M, JONES P, LAW M, MIETTINEN T, PAOLETTI R; Stresa Workshop Participants. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels[J]. Mayo Clin Proc, 2003, 78: 965-978. DOI:10.1016/S0025-6196(11)63144-3 |
| [12] |
VIVANCOS M, MORENO J J. β-Sitosterol modulates antioxidant enzyme response in RAW 264.7 macrophages[J]. Free Radic Biol Med, 2005, 39: 91-97. DOI:10.1016/j.freeradbiomed.2005.02.025 |
| [13] |
张情.植物甾醇酯对高脂饮食诱导的非酒精性脂肪肝的预防作用研究[D].上海: 上海交通大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10248-1015807539.htm
|
| [14] |
MEUCCI E, MELE M C. Amino acids and plasma antioxidant capacity[J]. Amino Acids, 1997, 12(3/4): 373-377. |
| [15] |
PATTERSON S, SCULLION S M, MCCLUSKEY J T, FLATT P R, MCCLENAGHAN N H. Prolonged exposure to homocysteine results in diminished but reversible pancreatic β-cell responsiveness to insulinotropic agents[J]. Diabetes Metab Res Rev, 2007, 23: 324-334. DOI:10.1002/(ISSN)1520-7560 |
| [16] |
徐玲, 马红艳, 肖斌, 高陈林. 富生酮氨基酸饮食改善高脂诱导小鼠非酒精性脂肪肝[J]. 中国现代医学杂志, 2016, 26: 22-27. |
| [17] |
DUDEK S M, SEMENKOVICH C F. Essential amino acids regulate fatty acid synthase expression through an uncharged transfer RNA-dependent mechanism[J]. J Biol Chem, 1995, 270: 29323-29329. DOI:10.1074/jbc.270.49.29323 |
| [18] |
QIN L Q, XUN P, BUJNOWSKI D, DAVIGLUS M L, VAN HORN L, STAMLER J, et al. Higher branched-chain amino acid intake is associated with a lower prevalence of being overweight or obese in middle-aged East Asian and Western adults[J]. J Nutr, 2011, 141: 249-254. DOI:10.3945/jn.110.128520 |
| [19] |
SUN X, ZEMEL M B. Leucine and calcium regulate fat metabolism and energy partitioning in murine adipocytes and muscle cells[J]. Lipids, 2007, 42: 297-305. DOI:10.1007/s11745-007-3029-5 |
| [20] |
SUN X, ZEMEL M B. Leucine modulation of mitochondrial mass and oxygen consumption in skeletal muscle cells and adipocytes[J]. Nutr Metab (Lond), 2009, 6: 26. DOI:10.1186/1743-7075-6-26 |
| [21] |
KHAN L, BAMJI M S. Tissue carnitine deficiency due to dietary lysine dificiency:triglyceride accumulation and concomitant impairment in fatty acid oxidation[J]. J Nutr, 1979, 109: 24-31. DOI:10.1093/jn/109.1.24 |
| [22] |
胡晓霞.生长中期草鱼的苏氨酸需要量研究[D].雅安: 四川农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157346.htm
|
| [23] |
LI P, YIN Y L, LI D, KIM S W, WU G. Amino acids and immune function[J]. Br J Nutr, 2007, 98: 237-252. DOI:10.1017/S000711450769936X |
| [24] |
YANNI A E, AGROGIANNIS G, NOMIKOS T, FRAGOPOULOU E, PANTOPOULOU A, ANTONOPOULOU S, et al. Oral supplementation with L-aspartate and L-glutamate inhibits atherogenesis and fatty liver disease in cholesterol-fed rabbit[J]. Amino Acids, 2010, 38: 1323-1331. DOI:10.1007/s00726-009-0340-x |
| [25] |
RAO K V, NORENBERG M D. Cerebral energy metabolism in hepatic encephalopathy and hyperammonemia[J]. Metab Brain Dis, 2001, 16(1/2): 67-78. DOI:10.1023/A:1011666612822 |
 2018, Vol. 39
2018, Vol. 39


