多发性骨髓瘤(multiple myeloma,MM)及其恶化前病变来源于终末分化的B淋巴细胞,是高度异质性的浆细胞疾病。荧光原位杂交(fluorescence in situ hybridization,FISH)遗传学分析发现遗传学异常对MM的进展和预后判断有重要作用,是建立危险分层和预后判断体系的重要手段。然而由于肿瘤初始负荷低、标本稀释等因素使得部分患者可检测瘤细胞比例偏低,约30%~40%的标本FISH检测结果低于或在临界值附近,这其中除部分标本确实无异常遗传学改变外,也有相当一部分标本是“假阴性”结果[1-2]。如何进一步优化标本采集、运送、存储、前处理、检测及报告分析流程,预先“浓缩瘤细胞”、提高可检测瘤细胞比例,提高方法学灵敏性和特异性、减少漏诊,是临床和实验室迫切需要解决的问题。海军军医大学(第二军医大学)长海医院血液科和血液病实验室通过成立品管圈(quality control cycle,QCC)小组并确立主题活动内容,在实验室现有条件基础上确定目标和实施方案,实践并摸索改进、形成新的实验流程并进行标准化,有效提高了浆细胞遗传学异常检出率,现将相关实施情况报告如下。
1 方法和结果 1.1 准备阶段血液科医师和实验室成员共同学习QCC的特点、活动内容及要求,在此基础上建立QCC活动小组。QCC成员9人由科室骨干自发组成,组成人员包括血液科临床副主任医师、主治医师各1名,血液病实验室副主任医师1名、副主任技师1名、主管技师2名、技师3名。QCC活动小组负责本次活动指导、决策、实施、监督和效果确认。
1.2 实施阶段 1.2.1 主题选定圈长组织将当前临床和实验室工作中拟解决的关键问题列举,全体QCC成员进行讨论,并根据医院政策、问题的重要性、问题的迫切性及QCC成员能力4个方面,采用“5、3、1”评分[3]得出本次活动的主题为“提高单克隆浆细胞遗传学异常检出率”。
1.2.2 制定活动计划根据活动步骤制定详细的小组活动计划表,并制成甘特图,按步骤实施。
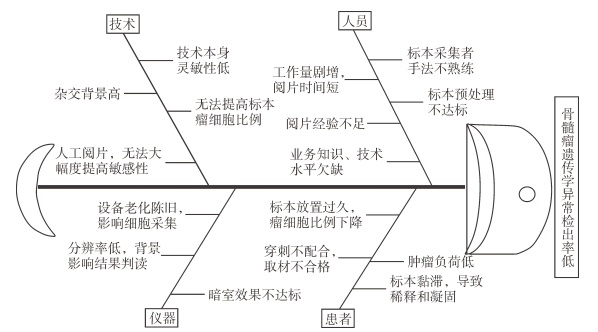
1.2.3 现状把握及主要因素分析2014年12月,QCC成员通过到现场、看操作,全程了解当时实验室疑诊MM患者标本的采集、运送、接收、前处理、检测及报告分析;收集2014年6月至2014年12月所有怀疑MM并进行浆细胞相关FISH检测的骨髓标本。共调查了155例检测标本,其中阴性结果60例,占38.7%,各种可能漏检原因及其构成比见表 1。通过柏拉图分析发现,肿瘤初始负荷低以及标本稀释使采集的患者标本中异常细胞比例偏低达不到FISH检测方法灵敏性,是临床浆细胞遗传学异常漏检的主要原因。进而组织QCC成员通过头脑风暴、运用鱼骨图,从人员、技术、仪器、患者4个方面进行分析,确定能够提高检出率的主要因素包括:制定采样、预处理的操作规范和人员培训;改善环境设施和升级硬件设备以提高分辨率;匹配工作量增加,增加人员编制并及时进行大强度、高质量的培训;建立新技术、新方法以提高标本中瘤细胞比例(图 1)。
|
|
表 1 疑诊多发性骨髓瘤患者遗传异常检测阴性情况及其构成比分析 |
|
图 1 多发性骨髓瘤遗传学异常检出率低原因分析鱼骨图 |
通过QCC成员对上述所列可能原因的充分讨论,并进行无记名表决,提出本次主题关键要因是:常规FISH实验流程无法检测出瘤细胞负荷低的标本中浆细胞的遗传学异常。实践中发现肿瘤负荷低于20%的患者异常检出率低,其关键原因是显微镜下可分析的异常浆细胞数目过少。如何将肿瘤负荷低于20%的异常浆细胞标本在FISH检测之前进行“浓缩”,人为提高后续检测中异常浆细胞的密度,是解决本次主题的主要因素。
1.2.4 目标设定及依据根据公式计算目标值:目标值=现状值-(现状值×改善重点×圈能力)。其中,改善重点通过柏拉图分析获得,圈能力通过对流程改善涉及的部门及实施细节可行性评估,由全体QCC成员投票获得。考虑到MM患者浆细胞遗传学改变本身有一定的阴性率,不可能通过提高原始标本中瘤细胞比例使所有异常浆细胞FISH检测都为阳性。因此,目标值设定为38.7%-(38.7%×80%×94.5%)=9.4%,较为合理。
1.2.5 对策拟定及实施明确重点后,QCC成员进一步从对策的自主性、可行性和效益性等方面查文献、头脑风暴,并由全体QCC成员对其进行评分,并按得分高低进行排序,最后得出技术因素中提高瘤细胞比例是解决本次品管圈主题的最有效、最根本的解决方案,其他排名前3可附带改善的方案,也在过程中一并拟定对策并实施,包括各个关键环节操作人员培训、人手调配、暗室改造等。
针对提高瘤细胞比例这个主要、根本的解决方案,QCC活动小组根据实验室现有条件对采集标本中的瘤细胞分类别、并采用流式分选或磁珠分选两种方案进行“浓缩”,观察对比各组的分选效果。具体方案、效果及优缺点如下:(1)瘤细胞比例>20%的标本,不进行浓缩操作,直接按常规处理FISH检测。(2)瘤细胞比例≤20%的标本尝试磁珠分选或流式分选后检测。磁珠分选1次后瘤细胞比例均在50%以下,瘤细胞比例低于5%时1次磁珠分选浓缩甚至不能达到15%;而流式分选后瘤细胞比例均可达到90%以上,瘤细胞比例大于0.01%时只要标本量足够均可获得足够标本进行FISH分析。(3)磁珠分选操作时间长,前后约需要4~5 h,且所需抗体量大,需要专门的过滤柱、磁铁和支架,瘤细胞损耗多,瘤细胞比例过低时,分选后纯度仍然达不到FISH检测最低要求。流式分选效率高,耗时相对较短(2~3 h);若瘤细胞比例较高(5%~20%)可直接对常规检测后残留标本进行分选用于FISH检测,耗时更短且不需要额外增加大量抗体,节省成本。
1.3 效果确认经过实践摸索优化,后续常规工作中,对于瘤细胞比例低、不适合直接进行FISH检测的标本,首先采用流式分选浓缩,分选后瘤细胞比例均在90%以上,远远超过了FISH方法学要求的最低检测密度。分选操作中,可直接分选约3 000~5 000个瘤细胞至玻片上,晾干后进行FISH检测,也减少了标本直接进行FISH检测时标本前处理、滴片等操作,简化了步骤。检测流程的更改如图 2所示。旧流程对采集标本未经瘤细胞密度评估直接处理进行FISH检测,漏检率高,且部分疑诊但非骨髓瘤标本行相关检测无必要。新检测流程首先进行形态和流式检测,明确疑诊骨髓瘤患者是否存在异常浆细胞,同时确定异常细胞比例。对于浆细胞正常标本,终止遗传学检测项目,避免不必要浪费,降低患者负担;高密度标本确诊后再行FISH检测,提高检出率及结果特异性;对于低密度标本(≤20%),首先采用流式分选浓缩异常浆细胞,再进行FISH检测,提高FISH灵敏性,降低了漏检率。

|
图 2 品管圈活动后多发性骨髓瘤遗传学异常检测流程更改模式图 |
为进一步评价上述改进措施实施的效果,我们收集了2015年1月至2015年6月血液病实验室拟诊MM并采用新流程进行遗传学检测的标本,对比前期2014年6月至2014年12月采用旧流程检测标本,发现初发MM患者FISH检测遗传学异常检出率由61.3%提高至92.1%,而阴性率由38.7%下降至7.9%(表 2),达到了预计目标值。
|
|
表 2 新、旧流程FISH检测拟诊MM患者遗传学异常检出率差异对比 |
2 讨论
QCC活动近年在国内得到广泛开展,在发动群众智慧、逐个突破实际工作中的细节问题、优化工作流程、提升工作质量等多个方面发挥了重要的作用。临床医疗各个专业,尤其是护理人员在开展QCC活动中的积极性很高,也取得了很多有效的临床成果[4-6]。
本次活动中,我们针对本院血液科临床医师对MM患者细胞遗传学正确检测结果的迫切需求,及时成立QCC小组,发动群众力量,结合实验室硬件和软件情况,全面分析了问题形成的要因。确定能够提高检出率的部分因素包括:制定采样、预处理的操作规范和人员培训;改善环境设施和升级硬件设备以提高分辨率;匹配工作量增加,增加人员编制并进行大强度、高质量的及时培训;建立新技术、新方法以提高标本中瘤细胞比例。通过对前3个方面的改进可以提高标本采集质量、确保报告分析水平,可部分减少稀释标本、临界值附近标本漏检率,但仍不能确实提高异常细胞密度较低标本的遗传学异常检出率。QCC成员头脑风暴后一致认为,只有建立新技术、新方法有效提高原始标本中瘤细胞比例,才能彻底解决瘤细胞比例低于或接近于检测灵敏度低点所致漏检。我科实验室有带分选功能的流式细胞仪,常规可以对低至0.01%靶细胞进行分选浓聚,多用于科研。如果借鉴到临床则可以大大提高拟检测临床标本中的异常浆细胞比例。为进一步简化标本处理步骤、优化流程、避免工作量过度增加,我们又进一步摸索将异常浆细胞分选至FISH检测玻片上,晾干处理后直接进行FISH分析流程,减少了原始标本处理中的滴片等步骤。
我们也对比了目前临床常用的磁珠分选富集的方案,对于起始密度相对较高的标本,磁珠富集可以基本满足FISH检测要求,但其分选纯度仍不及流式分选。而对于异常细胞密度特别低(<5%)的标本,磁珠1次富集几乎达不到FISH分析要求,再次富集增加工作量和抗体损耗,异常细胞得率也低。因此结合我科实验室实际条件,磁珠分选没有优势,达不到流式分选的效果和临床FISH检测的要求。
通过本次QCC活动,实验室浆细胞异常检出率明显提高,假阴性率下降,达到了预计目标值。QCC活动将原来直接初发标本检测FISH流程更改为借助其他2种方法首先确定初发标本中瘤细胞是否存在及瘤细胞的密度,再根据瘤细胞密度决定对标本直接进行FISH检测或是采用流式分选浓缩后再进行FISH检测。相关流程的改变,不增加医师负担(不改变医嘱开单模式)、不增加患者痛苦和负担(不增加采样次数、实验室承担分选费用)、减少了部分无效检测(部分拟诊MM患者形态和流式检测无异常浆细胞,则终止FISH检测),但提高了FISH阳性检出率、降低了漏检率,为患者进行危险分层和制定个体化治疗方案提供了准确的实验室证据。
| [1] |
RAJAN A M, RAJKUMAR S V. Interpretation of cytogenetic results in multiple myeloma for clinical practice[J/OL]. Blood Cancer J, 2015, 5: e365. doi:10.1038/bcj.2015.92.
|
| [2] |
RAJKUMAR V. Myeloma today: disease definitions and treatment advances[J/OL]. Am J Hematol, 2016, 91: 965. doi:10.1002/ajh.24392.
|
| [3] |
梁铭会, 刘庭芳, 董四平. 品管圈在医疗质量持续改进中的应用研究[J]. 中国医院管理, 2012, 32: 37-39. |
| [4] |
杨蔺, 董航筠, 程娟, 蒋黎敏, 傅启华, 李怀远. 品管圈在改善急诊生化检验及时率中的应用[J]. 检验医学, 2016, 31: 61-65. |
| [5] |
迟俊涛. 品管圈在护理工作中的应用现状及建议[J]. 中华现代护理杂志, 2015, 21: 745-747. |
| [6] |
孙春燕. 应用品管圈活动对提升医院感染管理工作质量的探讨[J]. 中国消毒学杂志, 2015, 32: 1207-1208, 1212. |
 2018, Vol. 39
2018, Vol. 39


