颅内未破裂动脉瘤(unruptured intracranial aneurysm,UIA)约占人群的1%~7%[1-3]。随着材料学、神经介入影像学的发展和相关随机对照研究结果的开展,血管内介入治疗(endovascular treatment,EVT)已成为颅内动脉瘤的重要治疗方法。尽管EVT被证明是一种安全有效的UIA治疗方法,但其潜在的并发症不容忽视[4-6]。缺血性并发症(ischemic complication,IC)是EVT围手术期最常见的并发症之一[7-9]。围手术期内一旦发生IC,可能会造成永久性残疾或致死[10]。目前,导致EVT治疗过程中发生程序相关性IC的原因尚不明确。本研究旨在通过单中心大样本数据分析EVT治疗UIA过程中IC的发生率及可能的危险因素,为UIA的管理提供信息。
1 资料和方法 1.1 临床资料连续性收集2010年1月至2017年2月间于我院接受EVT治疗的UIA患者的临床资料,所有患者均经数字减影血管造影(digital subtraction angiography,DSA)证实为UIA。排除标准:(1)梭形、假性、外伤性、感染性动脉瘤;(2)合并硬脑膜动静脉瘘、脑动静脉畸形、烟雾病等脑血管病或恶性肿瘤;(3)1个月内有脑出血或蛛网膜下隙出血;(4)资料不完整。最终共1 232例UIA患者纳入本研究。
1.2 纳入的危险因素与IC的定义IC主要包括3种:(1)术中急性血栓形成,定义为DSA可明确识别的脑血流充盈缺损;(2)围手术期内发生明显的神经功能缺损,影像学证实为载瘤动脉闭塞或磁共振弥散序列显示有与神经功能缺损相关的新发脑梗死;(3)围手术期内出现典型的短暂性脑缺血发作(transient ischemic attack,TIA)。纳入的IC相关危险因素包括:(1)患者相关的危险因素,即年龄、性别、高血压病史、糖尿病史、既往蛛网膜下隙出血病史、TIA或脑梗死史、吸烟史、饮酒史、颅内血管狭窄、心血管疾病史(冠心病、心律不齐、心房颤动等);(2)动脉瘤相关的危险因素,即动脉瘤最大径、瘤颈、多发动脉瘤、动脉瘤位置、不规则形态、穿支丰富区域等;(3)介入治疗相关的危险因素,即治疗策略(单纯弹簧圈栓塞、球囊辅助栓塞、支架辅助弹簧圈栓塞、单纯支架置入以及闭塞载瘤动脉)、支架应用、血流导向装置、重叠支架、一次手术治疗多个动脉瘤。
1.3 EVT治疗方法所有接受EVT的患者术前均口服双联抗血小板药物(阿司匹林/氯吡格雷100/ 75 mg,至少3 d)。全部EVT过程均在全身麻醉下施行,经右侧股动脉穿刺放置血管导入鞘。在程序开始前,将肝素(50 U/kg)经股动脉鞘团注进入患者体内,然后维持剂量为15 U/(kg·h)。本研究使用Echelon-10(ev3 Neurovascular,Irvine,California,USA)作为动脉瘤栓塞微导管进行动脉瘤的超选和弹簧圈的输送。使用支架配套的支架输送导管(根据所使用支架的种类不同进行相应调整)输送支架,支架的中心位置覆盖动脉瘤瘤颈,治疗结果由手术医师应用Raymond分级进行评判。所有手术操作均由本中心5位年均开展超过200台动脉瘤手术的医师完成。
1.4 围手术期药物准备及术中血栓处理所有准备接受EVT的UIA患者术前均口服阿司匹林(100 mg/d)和氯吡格雷(75 mg/d),不少于3 d。术中予单纯弹簧圈填塞的患者术后不予抗血小板聚集治疗;支架辅助栓塞的患者术后常规予双联抗血小板聚集治疗。2010年2月之前,所有支架辅助栓塞的患者术后均口服双联抗血小板治疗(阿司匹林300 mg/d,氯吡格雷75 mg/d)维持6周,然后单独服用阿司匹林(100 mg/d)并终生服用;此外,术后常规给予低分子肝素(40 mg/12 h,皮下注射3 d)预防支架内血栓形成。2010年2月,本中心通过回顾性研究发现,术后给予低分子肝素可能增加患者术后出血的风险,因此自2010年3月1日起,所有支架辅助栓塞的患者术后不再使用低分子肝素。此外,自2010年1月1日以来,本中心开展了血栓弹力图检测,发现阿司匹林100 mg即可有效抑制血小板聚集。因此自2010年6月起,支架辅助栓塞患者的术后抗血小板聚集方案修改为:阿司匹林100 mg/d,氯吡格雷75 mg/d,持续6周;6周后单独服用阿司匹林100 mg/d,终生服用。术中如果发生急性支架内血栓形成或术后2 h内患者出现典型支架内血栓形成导致的大血管鼻塞症状,予糖蛋白Ⅱb/Ⅲa抑制剂替罗非班进行溶栓治疗,同时行二次脑血管造影或影像学检查,明确病因后积极处理。
1.5 统计学处理应用SPSS 23.0软件进行数据分析。计数资料以率(百分比)表示,计量资料以x±s表示。计数资料的组间比较采用Fisher精确检验或Pearson χ2检验,计量资料的组间比较采用Student t检验。将单因素分析中P<0.1的危险因素纳入logistic多因素分析(向后逐步法),进入标准为0.1,剔除标准为0.15。检验水准(α)为0.05。
2 结果 2.1 患者基线资料与单因素分析共纳入1 232例UIA患者,男性395例、女性837例。按照是否发生IC将患者分为IC组(n=34)和非IC组(n=1 198),两组患者的平均年龄分别为(57.39±11.04)、(57.74±12.52)岁。单因素分析结果显示,患者相关的危险因素中,高血压病(P=0.002)、吸烟(P=0.050)与IC发生有关。动脉瘤相关的危险因素中,动脉瘤最大径(P=0.004)与IC发生有关,将动脉瘤最大径按照10 mm转化为二分类变量后纳入统计分析,发现其仍与IC发生有关(P=0.005)。介入治疗相关的各危险因素均与IC发生无关。见表 1。
|
|
表 1 UIA患者的基线资料与IC危险因素的单因素分析 Tab 1 Characteristics of patients with UIA and univariate analysis of IC |
2.2 UIA患者发生IC的多因素分析
将单因素分析所得的3项P<0.10的危险因素(高血压病、吸烟、动脉瘤最大径>10 mm)纳入多因素分析,结果(表 2)显示,高血压病(OR=3.192,P=0.003)、吸烟(OR=2.956,P=0.022)、动脉瘤最大径>10 mm(OR=2.915,P=0.004)是UIA患者发生IC的独立危险因素。
|
|
表 2 UIA患者发生IC的多因素分析 Tab 2 Multivariate analysis of IC in patients with UIA |
2.3 IC患者的临床特点
共34例(2.8%)患者发生了IC,其中16例(47.1%)为急性支架内血栓形成(典型病例见图 1)、15例(44.1%)为术后症状性脑梗死、3例(8.8%)为TIA;9例(26.5%)急性支架内血栓形成的患者术中接受了动脉溶栓治疗,术后均无神经功能缺损。14例(41.2%)患者术后发生短暂性神经功能缺失,11例(32.4%)发生永久性神经功能缺损。25例(73.5%)未行血栓弹力图测试,9例(26.5%)行血栓弹力图测试的患者中3例(8.8%)血小板功能正常、6例(17.6%)对阿司匹林或氯吡格雷有明显的抵抗。19例(55.9%)使用了替罗非班,其中18例(52.9%)有效,1例(2.9%)血栓未溶解。发生IC后所有患者均经术中挽救性溶栓、术后挽救性治疗;3例(8.8%)残留永久性功能障碍,1例(2.9%)死亡,其余30例预后均较好,改良Rankin量表(mRS)评分<2分。
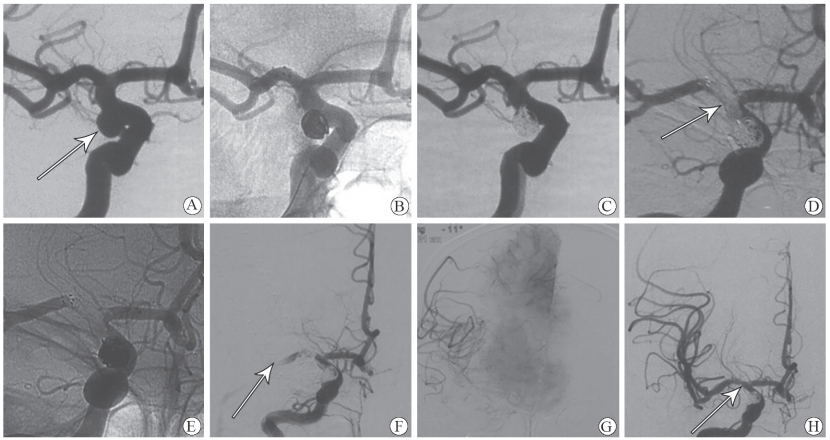
|
图 1 EVT治疗颅内UIA急性支架内血栓形成患者的典型图像 Fig 1 Typical images of patients with acute stent thrombus formation in EVT of UIA A 60-year female patient.A: Angiography shows the patient harbored the posterior communicating artery segment aneurysm (arrow); B: Stent-assisted coiling is used to coil the aneurysm; C: Immediate angiography after embolization shows the parent artery and branch patency, no stent thrombosis; D: Acute stent thrombosis, arrow shows thrombus; E: Non-subtraction image shows stent morphology; F: Secondly angiography shows complete occlusion of the right middle cerebral artery, the arrow shows the distal of thrombus; G: Flow of right middle cerebral artery blood is slow, and anterior cerebral artery compensates for the middle cerebral artery blood supply area; H: After using tirofiban+mechanical thrombectomy+stenting, the flow of right middle cerebral artery blood recovers, and the arrow shows residual stenosis.UIA: Unruptured intracranial aneurysm; EVT: Endovascular treatment |
3 讨论
随着神经介入放射学的不断发展,越来越多的无症状或轻微症状的UIA被检测发现,而介入材料和技术的不断成熟也使得介入治疗逐渐成为其主要治疗方式[11-13]。IC是EVT围手术期最常见的并发症之一[7-9]。既往文献报道介入治疗过程中症状性IC的发生率约为2%~7.1%[6, 14]。本研究纳入的1 232例UIA患者中共有34例(2.8%)发生IC,与Jang等[4]、Song等[15]的报道结果基本一致,而低于Park等[6]、Pierot等[14]、Derdeyn等[16]报道的IC发生率。分析其原因可能是:(1)神经介入技术的发展使介入治疗的并发症发生率逐年降低,而本研究数据全部采集自2010年之后,神经介入治疗的发展已相对成熟;(2)本中心5位介入医师均有超过5年(200台/年)的手术经验,丰富的经验和熟练的操作进一步降低了并发症的发生率。
目前,导致EVT治疗中发生IC的危险因素尚不明确。既往文献报道相关因素可能有术前抗血小板药物准备不充分、患者对阿司匹林或氯吡格雷抵抗、较大的动脉瘤最大径、弹簧圈凸入载瘤动脉、支架打开不充分导致贴壁不良和既往脑缺血病史等[4, 16]。本研究单因素分析结果显示高血压病(P=0.002)、吸烟(P=0.050)、动脉瘤最大径>10 mm(P=0.005)与IC发生有关,多因素分析结果显示高血压病(OR=3.192,P=0.003)、吸烟(OR=2.956,P=0.022)、动脉瘤最大径>10 mm(OR=2.915,P=0.004)为UIA患者发生IC的独立危险因素。高血压病可能会增加动脉粥样硬化性脑血管的负担,从而导致IC的发生。本研究发现吸烟是患者发生IC的重要预测指标,与既往研究[17-19]结果一致。Adeeb等[10]指出吸烟是缺血性卒中的独立预测因子,Xia等[19]发现吸烟可能与动脉瘤大小的增加有关,表明吸烟可能通过影响动脉瘤的大小而增加IC的发生风险。动脉瘤最大径>10 mm是EVT治疗UIA时发生IC的独立危险因素,与既往文献报道结果[15-16, 20-21]一致。分析其原因可能如下:(1)较大的动脉瘤可能会增加血栓栓塞事件的风险,进而导致神经缺陷;(2)动脉瘤体积较大易于瘤内血栓形成,操作过程中瘤内血栓脱落可能会引起神经功能障碍;(3)较大的动脉瘤一般瘤颈较宽,常需要球囊或支架辅助栓塞,导致手术时间延长,进而增加IC的发生风险。
此外,既往研究显示缺血性脑卒中病史、多发动脉瘤、宽颈动脉瘤、不规则形状或有子囊、心血管合并症、动脉瘤位于穿支丰富区域均与IC的发生有关[6, 20, 22]。但本研究中这些危险因素与IC发生均无关,可能是研究人群不同以及不同研究对变量的定义不完全相同,进而导致结果可能有差异。
有研究显示,支架或血流导向支架的使用可能与IC的发生有关[10, 15, 23]。但本研究中85.0%(1 047/1 232)的患者应用了支架治疗,而IC的发生率仅为2.7%,且未放置支架、放置支架患者IC的发生率分别为1.6%(3/185)、3.0%(31/1 047),差异无统计学意义(P=0.305),表明应用支架并不增加UIA患者IC的发生率。血流导向装置具有较高的金属覆盖率,提示其可能会增加UIA患者IC的发生风险,但本研究数据结果显示血流导向装置与IC的发生无关(P=0.119),可认为应用血流导向装置进行UIA治疗是安全的。本课题组前期研究也表明应用支架是UIA患者发生术中破裂的保护因素[24],本研究进一步证实了支架应用的安全性,这可能与本中心进行支架辅助栓塞时的术前、术后药物准备以及患者管理经验丰富有关。
围手术期内一旦发生IC,可能造成永久残疾或致死[10]。本研究中34例发生IC的患者均经术中挽救性溶栓、术后挽救性治疗,总的永久致残率和死亡率分别为8.8%和2.9%,与既往报道基本一致[14, 25]。此外,本研究中19例术中或术后1 h内急性支架内血栓形成的患者予盐酸替罗非班行溶栓治疗,其中18例(52.9%)血栓溶解;溶栓成功的患者术后恢复良好,而未溶解患者预后较差。该结果说明对于支架内血栓形成的患者,及早发现、及早行溶栓治疗可以改善患者预后。对症状性急性脑梗死,按照急性脑梗的处理方法予以处理。对于TIA患者,在确认无颅内出血后连续3 d予低分子肝素抗凝,并行血栓弹力图检查是否存在阿司匹林或氯吡格雷抵抗,对存在抵抗的患者及时更换抗血小板聚集药物。
本研究不足之处在于:(1)本研究为单中心回顾性研究;(2)研究从病例中收集临床特征,不同医师记录的数据不同,可能导致最终数据不准确;(3)与接受EVT的患者数相比,本研究数据库中发生IC的患者较少,相关结果仍需在更大的人群和多中心数据库中进行验证;(4)未能收集一些与血栓事件相关的技术因素,如弹簧圈凸入载瘤动脉、支架打开是否充分等。
综上所述,高血压病、吸烟、动脉瘤最大径>10 mm是UIA患者发生IC的独立危险因素;应用普通支架和血流导向装置治疗UIA是安全的。
| [1] | UCAS Japan Investigators, MORITA A, KIRINO T, HASHI K, AOKI N, FUKUHARA S, HASHIMOTO N, et al. The natural course of unruptured cerebral aneurysms in a Japanese cohort[J]. N Engl J Med, 2012, 366: 2474–2482. DOI: 10.1056/NEJMoa1113260 |
| [2] | JUVELA S, POUSSA K, LEHTO H, PORRAS M. Natural history of unruptured intracranial aneurysms:a long-term follow-up study[J]. Stroke, 2013, 44: 2414–2421. DOI: 10.1161/STROKEAHA.113.001838 |
| [3] | WIEBERS D O, WHISNANT J P, HUSTON J 3rd , MEISSNER I, BROWN R D Jr, PIEPGRAS D G, et al. Unruptured intracranial aneurysms:natural history, clinical outcome, and risks of surgical and endovascular treatment[J]. Lancet, 2003, 362: 103–110. DOI: 10.1016/S0140-6736(03)13860-3 |
| [4] | JANG E W, KIM Y B, CHUNG J, SUH S H, HONG C K, JOO J Y. Clinical risk factors affecting procedure-related major neurological complications in unruptured intracranial aneurysms[J]. Yonsei Med J, 2015, 56: 987–992. DOI: 10.3349/ymj.2015.56.4.987 |
| [5] | JI W, XU L, WANG P, SUN L, FENG X, LÜ X, et al. Risk factors to predict neurological complications after endovascular treatment of unruptured paraclinoid aneurysms[J]. World Neurosurg, 2017, 104: 89–94. DOI: 10.1016/j.wneu.2017.03.098 |
| [6] | PARK H K, HOROWITZ M, JUNGREIS C, GENEVRO J, KOEBBE C, LEVY E, et al. Periprocedural morbidity and mortality associated with endovascular treatment of intracranial aneurysms[J]. AJNR Am J Neuroradiol, 2005, 26: 506–514. |
| [7] | ORRÙ E, ROCCATAGLIATA L, CESTER G, CAUSIN F, CASTELLAN L. Complications of endovascular treatment of cerebral aneurysms[J]. Eur J Radiol, 2013, 82: 1653–1658. DOI: 10.1016/j.ejrad.2012.12.011 |
| [8] | YONAHA H, HYODO A, INAJI T, ITO K, KUSHI S, TSUCHIDA K, et al. Thromboembolic events associated with coil protrusion into parent arteries after GDC treatment[J]. Interv Neuroradiol, 2006, 12(Suppl 1): 105–111. |
| [9] | EDWARDS N J, JONES W H, SANZGIRI A, CORONA J, DANNENBAUM M, CHEN P R. Antiplatelet therapy for the prevention of peri-coiling thromboembolism in high-risk patients with ruptured intracranial aneurysms[J]. J Neurosurg, 2017, 127: 1326–1332. DOI: 10.3171/2016.9.JNS161340 |
| [10] | ADEEB N, GRIESSENAUER C J, MOORE J M, FOREMAN P M, SHALLWANI H, MOTIEI-LANGROUDI R, et al. Ischemic stroke after treatment of intraprocedural thrombosis during stent-assisted coiling and flow diversion[J]. Stroke, 2017, 48: 1098–1100. DOI: 10.1161/STROKEAHA.116.016521 |
| [11] | MOLYNEUX A, KERR R, STRATTON I, SANDERCOCK P, CLARKE M, SHRIMPTON J, et al. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J]. Lancet, 2002, 360: 1267–1274. DOI: 10.1016/S0140-6736(02)11314-6 |
| [12] | MOLYNEUX A J, KERR R S, YU L M, CLARKE M, SNEADE M, YARNOLD J A, et al. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion[J]. Lancet, 2005, 366: 809–817. DOI: 10.1016/S0140-6736(05)67214-5 |
| [13] | THOMPSON B G, BROWN R D Jr, AMIN-HANJANI S, BRODERICK J P, COCKROFT K M, CONNOLLY E S Jr, et al. Guidelines for the management of patients with unruptured intracranial aneurysms:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2015, 46: 2368–2400. DOI: 10.1161/STR.0000000000000070 |
| [14] | PIEROT L, SPELLE L, VITRY F; ATENA Investigators, ATENA Investigators. Immediate clinical outcome of patients harboring unruptured intracranial aneurysms treated by endovascular approach:results of the ATENA study[J]. Stroke, 2008, 39: 2497–2504. DOI: 10.1161/STROKEAHA.107.512756 |
| [15] | SONG J, KIM B S, SHIN Y S. Treatment outcomes of unruptured intracranial aneurysm; experience of 1, 231 consecutive aneurysms[J]. Acta Neurochir (Wien), 2015, 157: 1303–1311. DOI: 10.1007/s00701-015-2460-2 |
| [16] | DERDEYN C P, CROSS D T 3rd , MORAN C J, BROWN G W, PILGRAM T K, DIRINGER M N. Postprocedure ischemic events after treatment of intracranial aneurysms with Guglielmi detachable coils[J]. J Neurosurg, 2002, 96: 837–843. DOI: 10.3171/jns.2002.96.5.0837 |
| [17] | DING D. Deleterious effect of smoking on ischemic stroke outcomes:implications for the role of chronic inflammation on atherosclerotic plaque pathogenesis[J]. J Stroke Cerebrovasc Dis, 2014, 23: 596–597. DOI: 10.1016/j.jstrokecerebrovasdis.2013.12.034 |
| [18] | KERNAN W N, OVBIAGELE B, BLACK H R, BRAVATA D M, CHIMOWITZ M I, EZEKOWITZ M D, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2014, 45: 2160–2236. DOI: 10.1161/STR.0000000000000024 |
| [19] | XIA N, LIU Y, ZHONG M, ZHUGE Q, FAN L, CHEN W, et al. Smoking associated with increased aneurysm size in patients with anterior communicating artery aneurysms[J]. World Neurosurg, 2016, 87: 155–161. DOI: 10.1016/j.wneu.2015.11.094 |
| [20] | JI W, LIU A, LÜ X, KANG H, SUN L, LI Y, et al. Risk score for neurological complications after endovascular treatment of unruptured intracranial aneurysms[J]. Stroke, 2016, 47: 971–978. DOI: 10.1161/STROKEAHA.115.012097 |
| [21] | SHIMIZU K, IMAMURA H, MINEHARU Y, ADACHI H, SAKAI C, SAKAI N. Endovascular treatment of unruptured paraclinoid aneurysms:single-center experience with 400 cases and literature review[J]. AJNR Am J Neuroradiol, 2016, 37: 679–685. DOI: 10.3174/ajnr.A4577 |
| [22] | PRITZ M B. Perforator and secondary branch origin in relation to the neck of saccular, cerebral bifurcation aneurysms[J]. World Neurosurg, 2014, 82: 726–732. DOI: 10.1016/j.wneu.2013.02.052 |
| [23] | PUMAR J M, BANGUERO A, CUELLAR H, GUIMARAENS L, MASSO J, MIRALBES S, et al. Treatment of intracranial aneurysms with the silk embolization device in a multicenter study.A retrospective data analysis[J]. Neurosurgery, 2017, 81: 595–601. DOI: 10.1093/neuros/nyw123 |
| [24] |
李力, 张小曦, 赵瑞, 黄清海, 洪波, 刘建民. 颅内未破裂动脉瘤介入治疗程序相关性术中破裂的危险因素及临床特点分析[J]. 第二军医大学学报, 2017, 38: 1491–1496.
LI L, ZHANG X X, ZHAO R, HUANG Q H, HONG B, LIU J M. Risk factors and clinical features of intra-procedural rupture in endovascular treatment of unruptured intracranial aneurysm[J]. Acad J Sec Mil Med Univ, 2017, 38: 1491–1496. |
| [25] | BEKELIS K, MISSIOS S, MacKENZIE T A, DESAI A, FISCHER A, LABROPOULOS N, et al. Predicting inpatient complications from cerebral aneurysm clipping:the nationwide inpatient sample 2005-2009[J]. J Neurosurg, 2014, 120: 591–598. DOI: 10.3171/2013.8.JNS13228 |
 2018, Vol. 39
2018, Vol. 39


