2. 东莞市塘厦医院普外一科, 东莞 523710;
3. 第二军医大学长征医院药材科, 上海 200003
2. Department of Surgery(Ⅰ), Tangxia Hospital of Dongguan, Dongguan 523710, Guangdong, China;
3. Department of Pharmacy, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
胃癌是我国常见的恶性肿瘤之一,位居恶性肿瘤死亡原因的第2位[1]。但由于胃癌通常缺乏特异性的临床症状,很多患者确诊时已至中晚期,这导致胃癌的5年生存率仍不超过30%[2],因此早期诊断对提高胃癌的生存率有着十分重要的意义。目前,胃癌的早期诊断主要依赖胃镜检查,但胃镜检查方式尚未普及;而有关胃癌的肿瘤标志物敏感度较差,早期胃癌诊断缺乏有效的生物标志物。
代谢组学的研究方法提供了深入了解胃癌分子机制以及进行生物学诊断的机会。代谢组学通过对生物体内血、尿、组织等生物样本中的代谢物进行定量分析,寻找代谢物与生理、病理变化的对应关系,其研究对象大多是相对分子质量在1 000以内的小分子物质[3]。氨基酸代谢物是代谢物的重要组成之一,具有多种功能,它不仅反映人体的营养状态,还可以用于疾病的诊断、治疗、评价等[4]。近年,已有研究揭示氨基酸代谢物与肿瘤关系密切[5]。
本研究拟分析胃癌患者与正常人群及胃癌患者术前与术后血浆氨基酸代谢物水平的差异,探究胃癌血浆氨基酸代谢物中是否有可以作为胃癌诊断依据的靶向氨基酸代谢物。
1 对象和方法 1.1 研究对象胃癌病例选自2015年3月至2016年6月于第二军医大学长征医院普通外科和中医科治疗的胃癌患者,共104例。正常人群来自长征医院健康体检中心,体检结果未见异常,共50例。病例纳入标准:病理检查明确诊断为胃癌;年龄18~75周岁;手术前未接受其他抗肿瘤治疗。排除标准:年龄不足18周岁或超过75周岁;术前接受过放射治疗、化学治疗或靶向治疗等其他抗肿瘤治疗方案。胃癌的临床分期依据美国癌症联合委员会(AJCC)第7版胃癌分期标准[6]。
1.2 仪器Agilent 6460型三重四极杆串联质谱仪(美国Agilent公司);Agilent 1290型超高效液相色谱仪,包括G4220A双元泵、G1969-80230真空脱气机、G4226A自动进样器、G4212A可变波长DAD检测器、G1316C柱温箱(美国Agilent公司);MassHunter数据处理色谱工作站(美国Agilent公司);Labnet定时可调速旋涡混合器(美国Labnet公司);Eppendorf 5418R型台式冷冻高速离心机(德国Eppendorf公司);赛多利斯CPA225D十万分之一电子天平[赛多利斯科学仪器(北京)有限公司];SK200H型超声波清洗器(上海科导超声仪器有限公司)。
1.3 药品与试剂L-赖氨酸(Lys)、L-色氨酸(Trp)、L-苯丙氨酸(Phe)、L-甲硫氨酸(Met)、L-苏氨酸(Thr)、L-亮氨酸(Leu)、L-异亮氨酸(Ile)、L-缬氨酸(Val)、L-甘氨酸(Gly)、L-丙氨酸(Ala)、L-精氨酸(Arg)、L-丝氨酸(Ser)、L-天冬氨酸(Asp)、L-酪氨酸(Tyr)、L-胱氨酸(Cys)、L-组氨酸(His)和L-谷氨酸(Glu)等氨基酸标准品(中国药品生物制品检定所);L-马尿酸(HA)、对称性二甲基精氨酸(SDMA)、L-焦谷氨酸(pGlu)、氨基丙二酸(AMA)、L-谷氨酰胺(Gln)、L-犬尿氨酸(Kyn)、L-瓜氨酸(Cit)等氨基酸标准品(大连美仑生物技术有限公司);内标物L-甲硫氨酸-d4(L-met-d4)、L-丙氨酸-d3(L-ala-d3)、L-苯丙氨酸-d5(L-phe-d5)购自加拿大Toronto Research Chemicals有限公司。牛血清白蛋白(BSA,上海博光生物有限公司);PBS(上海英骏生物技术有限公司);七氟丁酸(HFBA,阿达玛斯试剂有限公司),甲醇和乙腈(德国Merck公司,质谱纯),甲酸(美国天地有限公司,色谱纯),Milli-Q超纯净水(美国Millipore公司)。
1.4 血浆氨基酸检测条件及方法研究对象空腹采血1.5~2.0 mL,采集后立即离心,750×g离心5 min,取上清。采用蛋白沉淀法对血浆样品进行预处理。精密吸取66 μL血浆,置于1.5 mL离心管内,加入198 μL蛋白沉淀剂(乙腈含有2%甲酸与400 ng/mL内标L-ala-d3、L-met-d4和L-phe-d5),涡旋3 min,1 100×g高速离心15 min,取上层清液50 μL;上层清液转至进样小瓶进行超高液相色谱串联质谱(UHPLC-MS/MS)分析。自动进样器吸取进样体积2 μL,自动进样器温度4 ℃。检测方法见文献[7]。
方法学验证操作参照美国食品药品监督管理局(FDA)药物分析过程及方法验证指导原则[7]完成。
1.5 统计学处理应用SPSS 17.0软件进行统计学分析,数据以x±s表示,组间比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 方法学验证结果结果显示,人体空白血浆基质不会对24种氨基酸的检测产生干扰。24种氨基酸在考察的浓度范围内呈现良好的线性关系,最低定量限与标示浓度的相对误差小于± 20%。日内、日间精密度分别为0.50%~12.43%和1.43%~14.94%,均符合分析要求;短期稳定性、长期稳定性、进样器稳定性、3次冻融循环稳定性分别为-14.35%~13.12%、-14.67%~14.20%、-14.63%~11.35%和-14.88%~13.51%,稳定性良好。基质效应和提取回收率分别在80.01%~107.19%、81.01%~110.38%范围内。同时,标准品储备溶液稳定性、累积效应、真实样本再分析分别为-14.52%~14.87%、-14.28%~ 14.92%和-17.61%~17.57%,同样也符美国FDA指导原则相关要求。色谱图见图 1。
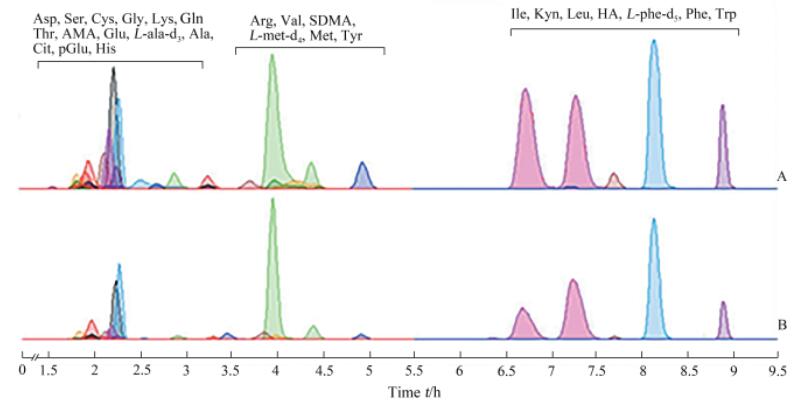
|
图 1 24种氨基酸及3种内标的UHPLC-MS/MS色谱图 Fig 1 Representative UHPLC-MS/MS chromatograms of 24 kinds of amino acids and three internal standards A: Multiple reaction monitoring (MRM) of blank plasma samples added with amino acid standards; B: MRM of human plasma. UHPLC-MS/MS: Ultra-high-performance liquid chromatography tandem mass spectrometry; Asp: L-aspartic acid; Ser: L-serine; Cys: L-cystine; Gly: L-glycine; Lys: L-lysine; Gln: L-glutamine; Thr: L-threonine; AMA: Aminomalonic acid; Glu: L-glutamic acid; L-ala-d3: L-alanine-d3; Ala: L-alanine; Cit: L-citrulline; pGlu: L-pyroglutamic acid; His: L-histidine; Arg: L-arginine; Val: L-valine; SDMA: Symmetric dimethylarginine; L-met-d4: L-methionine-d4; Met: L-methionine; Tyr: L-tyrosine; Ile: L-isoleucine; Kyn: L-kynurenine; Leu: L-leucine; HA: L-hippuric acid; L-phe-d5: L-phenylalanine-d5; Phe: L-phenylalanine; Trp: L-tryptophan |
2.2 胃癌患者与正常人群血浆氨基酸代谢物水平的比较
胃癌患者104例,其中男65例、女39例,年龄23~75岁,平均(60.33±11.24)岁,中位年龄62岁;正常对照者50例,其中男25例、女25例,年龄37~75岁,平均(58.64±9.82)岁,中位年龄61岁;两组年龄比较差异无统计学意义(P>0.05)。两组血浆氨基酸水平结果如表 1所示,SDMA、Kyn、HA水平两组间差异无统计学意义(P>0.05),Val、Arg、Ser水平胃癌组较正常对照组升高(P 均<0.05),其余18种氨基酸水平均较正常对照组下降(P 均<0.05)。
|
|
表 1 胃癌患者与正常人群血浆氨基酸代谢物水平比较 Tab 1 Comparison of plasma amino acid metabolite levels between gastric cancer patients and NCs |
2.3 不同分期胃癌患者血浆氨基酸代谢物水平比较
Ⅰ~Ⅱ期胃癌患者45例,年龄39~75岁,中位年龄62岁,平均(61.04±10.47)岁,Ⅲ~Ⅳ期胃癌患者59例,年龄23~75岁,中位年龄61岁,平均(59.79±11.84)岁,两组年龄比较差异无统计学意义(P>0.05)。Ⅲ~Ⅳ期胃癌患者血浆中的Arg水平高于Ⅰ~Ⅱ期胃癌患者(P<0.05);Gln、Glu、Met、Phe水平低于Ⅰ~Ⅱ期胃癌患者(P 均<0.05);其余19种氨基酸水平两组间差异无统计学意义(P>0.05)。详见表 2。
|
|
表 2 不同分期胃癌患者血浆氨基酸代谢物水平比较 Tab 2 Comparison of plasma amino acid metabolite levels between patients with different stages of gastric cancer |
2.4 胃癌患者术前、术后血浆氨基酸代谢物水平比较
随机抽取18例胃癌患者进行术前、术后血浆氨基酸代谢物水平的比较,年龄31~70岁,平均(59.06±10.89)岁,中位年龄62岁,Ⅱ期患者5例、Ⅲ期13例。结果显示,术后患者血浆Leu、Arg、Cit水平较术前下降,Gln、Lys、Glu、Phe水平较术前升高(P 均<0.05),其余17种氨基酸水平手术前后差异无统计学意义(P>0.05)。详见表 3。
|
|
表 3 胃癌患者术前、术后血浆氨基酸代谢物水平比较 Tab 3 Comparison of plasma amino acid metabolite levels between pre-operation and post-operation of gastric cancer patients |
3 讨论
胃癌是世界范围内第4位常见的恶性肿瘤[8]。氨基酸作为代谢网络中重要的一类代谢物参与多种生理和病理过程,如蛋白质等多种含氮化合物的生物合成等,其浓度的变化可以反映体内生理甚至病理反应的机制,其与肿瘤之间也可能存在相关性。已有研究表明胃癌患者体内存在氨基酸代谢异常[9]。
肿瘤细胞往往呈现糖酵解增加,即瓦氏效应(Warburg effect)[10]。肿瘤细胞即使在有氧情况下也常通过糖酵解途径提供能量,而不是通过氧化磷酸化反应。肿瘤细胞的生长速度远远大于正常细胞,但糖酵解的供能效应较低,肿瘤细胞必须增加摄取葡萄糖为自身的快速增殖提供能量[11]。由于葡萄糖来源的进入三羧酸循环的乙酰辅酶A浓度在肿瘤细胞中明显下降,肿瘤细胞需要其他替代途径补充三羧酸循环。在哺乳动物细胞中,除了葡萄糖外,另一主要供能来源主要是Gln,其在肿瘤生物合成过程中提供重要的能量以及氮、碳生物合成底物[12]。
本研究结果显示,胃癌患者血浆中包括Gln在内的多种氨基酸代谢物水平均较正常对照组下降,与Wang等[10]研究结果基本一致。此结果反映出肿瘤的快速增长对氨基酸需求旺盛,因此造成肿瘤组织中氨基酸含量升高,而血浆中氨基酸含量下降,这一现象又被称为“氮窃取”[13]。不同分期的胃癌患者的代谢物水平可能存在差异[14]。本实验结果还表明,Ⅲ~Ⅳ期胃癌血浆中的Gln、Glu、Met、Phe水平低于Ⅰ~Ⅱ期胃癌患者,术后患者血浆中Gln、Glu水平较术前有所升高。与Gln等大多数氨基酸的变化趋势不同,胃癌患者中少数血浆氨基酸代谢物水平高于正常人群,如Arg,该氨基酸还与分期有关,Ⅲ~Ⅳ期胃癌患者血浆中的Arg水平高于Ⅰ~Ⅱ期胃癌患者;同时胃癌术后患者血浆的Arg水平低于术前。已有研究显示Arg与肿瘤的生长有着密切的关系[15],逆转Arg可能成为肿瘤治疗的策略之一[16]。
本实验结果表明胃癌血浆氨基酸代谢物如Gln、Arg在胃癌早期预测中有重要意义。但这些差异氨基酸是否能作为胃癌早期诊断的标志物,仍需要大规模的临床研究进行验证。由于氨基酸代谢容易受多种因素影响[17-18],在今后的研究中除分析肿瘤内环境对氨基酸代谢的影响外,还需要分析整体因素对其的影响,以便更好地了解胃癌的生物学进程。
| [1] | HOU Q, TAN H T, LIM K H, LIM T K, KHOO A, TAN I B, et al. Identification and functional validation of caldesmon as a potential gastric cancer metastasis-associated protein[J]. J Proteome Res, 2013, 12: 980–990. DOI: 10.1021/pr3010259 |
| [2] | AQUINO P F, FISCHER J S, NEVES-FERREIRA A G, PERALES J, DOMONT G B, ARAUJO G D, et al. Are gastric cancer resection margin proteomic profiles more similar to those from controls or tumors?[J]. J Proteome Res, 2012, 11: 5836–5842. DOI: 10.1021/pr300612x |
| [3] | WILLIAMS A A, SITOLE L J, MEYER D. HIV/HAART-associated oxidative stress is detectable by metabonomics[J]. Mol Biosyst, 2017, 13: 2202–2217. DOI: 10.1039/C7MB00336F |
| [4] | LIN L, HUANG Z, GAO Y, YAN X, XING J, HUANG W. LC-MS based serum metabonomic analysis for renal cell carcinoma diagnosis, staging, and biomarker discovery[J]. J Proteome Res, 2011, 10: 1396–1405. DOI: 10.1021/pr101161u |
| [5] | LOAYZA-PUCH F, ROOIJERS K, BUIL L C, ZIJLSTRA J, OUDE VRIELINK J F, LOPES R, et al. Tumour-specific proline vulnerability uncovered by differential ribosome codon reading[J]. Nature, 2016, 530: 490–494. DOI: 10.1038/nature16982 |
| [6] | Witekind C. The development of the TNM classification of gastric cancer[J]. Pathol Int, 2015, 65: 399–403. DOI: 10.1111/pin.2015.65.issue-8 |
| [7] | WANG Q, WEN Y, XIA T, XIONG X, GAO S, YOU C, et al. Quantification of 18 amino acids in human plasma:application in renal transplant patient plasma by targeted UHPLC-MS/MS[J]. Bioanalysis, 2016, 8: 1337–1351. DOI: 10.4155/bio-2016-0057 |
| [8] | FERLAY J, SOERJOMATARAM I, DIKSHIT R, ESER S, MATHERS C, REBELO M, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J/OL].Int J Cancer, 2015, 136:E359-E386. doi:10.1002/ijc.29210. |
| [9] | ABBASSI-GHADI N, KUMAR S, HUANG J, GOLDIN R, TAKATS Z, HANNA G B. Metabolomic profiling of oesophago-gastric cancer:a systematic review[J]. Eur J Cancer, 2013, 49: 3625–3637. DOI: 10.1016/j.ejca.2013.07.004 |
| [10] | WANG H, ZHANG H, DENG P, LIU C, LI D, JIE H, et al. Tissue metabolic profiling of human gastric cancer assessed by 1H-NMR[J/OL]. BMC Cancer, 2016, 16:371. doi:10.1186/s12885-016-2356-4. |
| [11] | LIN L L, HSIA C R, HSU C L, HUANG H C, JUAN H F. Integrating transcriptomics and proteomics to show that tanshinone ⅡA suppresses cell growth by blocking glucose metabolism in gastric cancer cells[J/OL]. BMC Genomics, 2015, 16:41. doi:10.1186/s12864-015-1230-0. |
| [12] | PAN T, GAO L, WU G, SHEN G, XIE S, WEN H, et al. Elevated expression of glutaminase confers glucose utilization via glutaminolysis in prostate cancer[J]. Biochem Biophys Res Commun, 2015, 456: 452–458. DOI: 10.1016/j.bbrc.2014.11.105 |
| [13] | ZHANG J, BOWERS J, LIU L, WEI S, GOWDA G A, HAMMOUD Z, et al. Esophageal cancer metabolite biomarkers detected by LC-MS and NMR methods[J/OL]. PLoS One, 2012, 7:e30181. doi:10.1371/journal.pone.0030181. |
| [14] | JUNG J, JUNG Y, BANG E J, CHO S I, JANG Y J, KWAK J M, et al. Noninvasive diagnosis and evaluation of curative surgery for gastric cancer by using NMR-based metabolomic profiling[J]. Ann Surg Oncol, 2014, 21(Suppl 4): S736–S742. DOI: 10.1245/s10434-014-3886-0 |
| [15] | MONDANELLI G, UGEL S, GROHMANN U, BRONTE V. The immune regulation in cancer by the amino acid metabolizing enzymes ARG and IDO[J]. Curr Opin Pharmacol, 2017, 35: 30–39. DOI: 10.1016/j.coph.2017.05.002 |
| [16] | MANIG F, KUHNE K, VON NEUBECK C, SCHWARZENBOLZ U, YU Z, KESSLER B M, et al. The why and how of amino acid analytics in cancer diagnostics and therapy[J]. J Biotechnol, 2017, 242: 30–54. DOI: 10.1016/j.jbiotec.2016.12.001 |
| [17] | MIYAGI Y, HIGASHIYAMA M, GOCHI A, AKAIKE M, ISHIKAWA T, MIURA T, et al. Plasma free amino acid profiling of five types of cancer patients and its application for early detection[J/OL]. PLoS One, 2011, 6:e24143. doi:10.1371/journal.pone.0024143. |
| [18] | CHEN J L, TANG H Q, HU J D, FAN J, HONG J, GU J Z. Metabolomics of gastric cancer metastasis detected by gaschromatography and mass spectrometry[J]. World J Gastroenterol, 2010, 16: 5874–5880. DOI: 10.3748/wjg.v16.i46.5874 |
 2018, Vol. 39
2018, Vol. 39


