2. 保定市第一医院血液内科, 保定 071000;
3. 河北大学附属医院麻醉科, 保定 071000
2. Department of Hematology, The First People's Hospital of Baoding, Baoding 071000, Hebei, China;
3. Department of Anesthesiology, Affiliated Hospital of Hebei University, Baoding 071000, Hebei, China
骨髓增殖性肿瘤(myeloproliferative neo-plasm,MPN)是发生于血液系统的一类造血干细胞异常的克隆性疾病,其特点为骨髓中出现一系或多系异常增殖的血细胞,使血栓性疾病的发生率增加,并且增加向急性髓细胞白血病转化的风险。大部分MPN患者存在Janus激酶(Janus kinase 2,JAK2)基因突变。Kim等[1]研究了包括原发性骨髓纤维化(primary myelofibrosis,PMF)、真性红细胞增多症(polycythemia vera,PV)和原发性血小板增多症(essential thrombocythemia,ET)的407例MPN患者,检测到275例(67.6%)患者具有JAK2V617F突变。该突变可导致JAK2持续激活,从而使细胞因子受体JAK/STAT信号通路活化,进一步引起细胞增殖和抑制凋亡,导致PMF、PV或ET的发生[2]。
鲁索替尼(ruxolitinib)是一种选择性的JAK1/2抑制剂,通过竞争性抑制JAK1/2激酶结构域催化亚基上ATP结合位点,对JAK激酶活性起到抑制作用。2010年,Quintás-Cardama等[3]首次报道了鲁索替尼可以通过抑制JAK1/2治疗骨髓纤维化,从而最早被批准用于治疗中危或高危骨髓纤维化。大系列的Ⅲ期临床试验,包括COMFORT-Ⅰ和COMFORT-Ⅱ,明确了鲁索替尼缩脾和改善骨髓纤维化症状的疗效,并且证实了鲁索替尼与现有的骨髓纤维化治疗药物相比,可延长骨髓纤维化患者的总体生存期[4-6]。
研究表明,JAK/STAT信号途径是多种细胞因子的转导途径,介导细胞内多种细胞因子和生长因子的信号转导过程,并且进一步活化相关靶基因,影响细胞的增殖、凋亡和分化过程[7]。JAK/STAT信号通路同时也受多种因子的调控。细胞因子信号转导抑制蛋白1(suppressor of cytokine signaling 1,SOCS1)是JAK/STAT信号通路的反馈调控蛋白之一,能够抑制JAK/STAT信号途径的活性[8]。含SH2结构域蛋白酪氨酸磷酸酶1(SH2-containing protein tyrosine phosphatase 1,SHP1)也是JAK/STAT通路重要的负调控因子之一,其基因表达的减少或缺失可引起JAK/STAT信号通路的持续激活,与血液系统恶性肿瘤的发生密切相关[9]。迄今为止,鲁索替尼是否参与JAK2V617F突变细胞的SOCS1、SHP1表达调控,尚未见相关报道。因此,本研究观察了MPN患者JAK2V617F突变量和骨髓病理标本中磷酸化JAK2(phosphorylated Janus kinase 2, p-JAK2)、SOCS1、SHP1的蛋白表达情况,同时用不同浓度的鲁索替尼处理JAK2V617F突变阳性的人红白血病细胞系HEL细胞,观察其对HEL细胞活力的影响,探讨鲁索替尼是否通过JAK/STAT信号通路影响SOCS1、SHP1 mRNA和蛋白的表达,为鲁索替尼治疗MPN阐明新的作用机制。
1 材料和方法 1.1 患者资料纳入2012年7月至2016年8月于河北省人民医院和保定市第一医院就诊的48例初诊为JAK2V617F突变阳性MPN患者为MPN组,包括PV 21例、ET 14例、PMF 13例;其中男性22例、女性26例;中位年龄52(31~72)岁。所有MPN患者的诊断均符合2015年世界卫生组织(WHO)修订的MPN诊断标准[10]。对照组为同期就诊的24例贫血患者,其中男性10例、女性14例;中位年龄48(28~67)岁。本研究通过保定市第一医院医学伦理委员会批准(批准文号20120701),所有患者均签署知情同意书。
1.2 细胞与主要试剂人红白血病细胞系HEL细胞株(购自中国科学院上海生命科学研究院细胞资源中心)用含10%胎牛血清(FBS,美国Gibco公司)的RPMI 1640培养液(美国Gibco公司)培养于37 ℃、5% CO2 孵育箱。CCK-8试剂盒购自日本株式会社同仁化学研究所。JAK2(货号sc-294,批号14012)、p-JAK2(货号sc-101718,批号15002)、SOCS1(货号sc-9021,批号15001)、SHP1(货号sc-287,批号15002)单克隆抗体均购自美国Santa Cruz公司。EnivisionTM plus试剂盒购自福州迈新生物开发有限公司。基因组RNA提取试剂购自北京博迈德生物技术有限公司。引物序列由北京赛百盛基因技术有限公司合成。鲁索替尼(货号HY50858,批号SR007)购自瑞士诺华公司。
1.3 实验方法 1.3.1 免疫组织化学染色检测组织中p-JAK2、SOCS1、SHP1蛋白表达骨髓病理组织蜡块4 μm切片,45 ℃烤片3 h,脱蜡,抗原修复,加3%过氧化氢、磷酸盐缓冲液(PBS)冲洗,随后加入p-JAK2、SOCS1、SHP1一抗(均为1:100稀释)4 ℃过夜。PBS清洗3次,每次5 min,加EnivisionTM plus试剂盒中试剂A、试剂B,PBS冲洗。DAB显色,以细胞膜、细胞质或细胞核中出现棕黄色颗粒为阳性判断标准,苏木精复染,0.1%盐酸分化,自来水冲洗。切片经梯度乙醇脱水干燥,中性树胶封片。高倍镜视野下计数阳性细胞。
1.3.2 CCK-8试剂盒检测HEL细胞活力收集对数生长期HEL细胞,取细胞悬液100 μL(含5 000个细胞)加入到96孔板,设空白组、对照组和实验组,每组设5个平行孔。空白组加入100 μL无细胞的培养液和不同浓度(50、100、250、500、1 000 nmol/L)的鲁索替尼;对照组加入100 μL细胞悬液,不添加鲁索替尼;实验组加入100 μL细胞和不同浓度鲁索替尼。分别培养细胞至0、24、48 h时加入CCK-8溶液10 μL,孵育4 h后,用酶标仪测定450 nm处的光密度(D)值,计算细胞活力。细胞活力(%)=[(D实验组-D空白组)/(D对照组-D空白组)]×100%,根据计算结果绘制细胞生长曲线,实验重复3次,取平均值。
1.3.3 qPCR法检测骨髓活检标本JAK2V617F突变量和HEL细胞中JAK2、SOCS1、SHP1的mRNA表达收集细胞提取总RNA,检测RNA纯度,合格后反转录合成cDNA。以cDNA为模板、以β-actin 为内参基因进行qPCR反应,反应体系共25 μL,反应条件:50 ℃ 2 min,95 ℃ 10 min,1个循环;95 ℃ 15 s,60 ℃ 1 min,40个循环。qPCR反应前3~15个循环的荧光信号作为荧光本底信号,调节基线至适宜处作为阈值,各荧光曲线与基线交叉点的循环数即为Ct值。根据公式ΔCt= Ct(目的基因)-Ct(内参基因)和ΔΔCt=2-ΔCt,计算各目的基因的相对表达量,各组实验重复3次,取平均值。JAK2V617F MGB荧光探针上游引物5′-FAM-TCA CAA GCA TTT GGT TTT-MGB-3′,JAK2V617F 下游引物:5′-CCA GAA TAT TCT CGT CTC CAC TGA A-3′。根据标准品计算JAK2 和JAK2V617F 的绝对拷贝数量,计算JAK2V617F/JAK2比值。全序列引物设计见表 1。
|
|
表 1 qPCR引物序列 Tab 1 Primer sequence for qPCR |
1.3.4 蛋白质印迹法检测HEL细胞中JAK2、p-JAK2、SOCS1和SHP1的蛋白表达
收集细胞(约1×107 个),于冰上加预冷蛋白裂解液和PMSF,4 ℃裂解1 h,离心收集上清液,用考马斯亮蓝试剂盒(北京索莱宝科技有限公司)测定样品上清液中的蛋白浓度。取适量蛋白样品加入上样缓冲液混匀,高温变性。样品经120 V恒压聚丙烯酰胺凝胶电泳后,4 ℃ 100 V恒压2 h电转移至PVDF膜,然后用5%脱脂奶粉溶液常温封闭2 h,TBST洗膜。加JAK2(1:700稀释)、p-JAK2(1:500稀释)、SHP1(1:500稀释)和SOCS1(1:500稀释)一抗,4 ℃摇床孵育过夜。TBST洗膜3次后,加入二抗,37 ℃孵育2 h,TBST再次漂洗,显影、拍照,并进行灰度扫描和分析。
1.4 统计学处理应用SPSS 19.0软件行数据分析。呈正态分布的计量资料以x±s表示,两组间比较采用t检验,多组间比较采用方差分析,进一步两两比较采用SNK-q检验。各变量间的相关性分析采用Spearman等级相关分析。检验水准(α)为0.05。
2 结果 2.1 MPN患者JAK2V617F突变量和p-JAK2、SOCS1、SHP1蛋白的表达水平MPN组JAK2V617F/JAK2比值为(57.33±20.82)%,对照组为0%。骨髓病理组织中p-JAK2、SOCS1、SHP1蛋白均表达于细胞质中,三者在MPN组中的表达水平与对照组相比差异均有统计学意义(P 均<0.01)。见图 1和表 2。
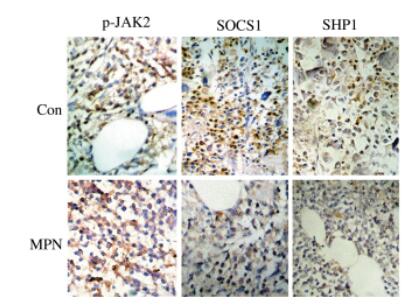
|
图 1 MPN组和对照组骨髓病理组织中p-JAK2、SOCS1、SHP1的表达 Fig 1 Expressions of p-JAK2, SOCS1, and SHP1 in bone marrow tissues in MPN and Con groups Con: Control; MPN: Myeloproliferative neoplasm; p-JAK2: Phosphorylated Janus kinase 2; SOCS1: Suppressor of cytokine signaling 1; SHP1: SH2-containing protein tyrosine phosphatase 1. Immunohistochemical staining. Original magnification: ×400 |
|
|
表 2 MPN组和对照组JAK2V617F突变量和p-JAK2、SOCS1、SHP1蛋白表达的比较 Tab 2 Comparison of JAK2V617F mutation level, and protein expressions of p-JAK2, SOCS1 and SHP1 between MPN and control groups |
2.2 JAK2V617F突变量与p-JAK2、SOCS1、SHP1蛋白表达量之间的关系
相关分析表明,MPN组织中SOCS1、SHP1蛋白表达量均与JAK2V617F突变量呈负相关(r=-0.648、-0.692,P 均<0.05)。以50%为界值,将MPN患者分为JAK2V617F/JAK2比值≥50%和<50%两组,JAK2V617F/JAK2比值≥50%的MPN患者22例,<50%者26例。对两组MPN患者SOCS1、SHP1蛋白表达水平进行分析,结果(表 3)表明,JAK2V617F/JAK2比值≥50%的MPN患者骨髓病理组织中SOCS1、SHP1的蛋白表达水平均低于JAK2V617F/JAK2比值<50%者(P 均<0.01),p-JAK2的蛋白表达水平高于JAK2V617F/JAK2比值<50%者(P<0.01)。
|
|
表 3 JAK2V617F突变量与p-JAK2、SOCS1、SHP1蛋白表达的关系 Tab 3 Relationships between JAK2V617F mutation and protein expressions of p-JAK2, SOCS1 and SHP1 |
2.3 鲁索替尼和HEL细胞活力的量效关系
CCK-8法检测结果显示,不同浓度的鲁索替尼均可影响HEL细胞活力,并且随着鲁索替尼浓度的增加细胞活力呈逐渐降低趋势。浓度为50、100、250、500和1 000 nmol/L的鲁索替尼分别处理HEL细胞48 h后,HEL细胞活力分别为(70.14±3.21)%、(59.71±3.46)%、(52.05±2.88)%、(43.31%±2.16)%和(38.56±2.08)%。在鲁索替尼处理24 h时,HEL细胞活力较0 h时下降,250 nmol/L鲁索替尼处理HEL细胞24、48、72 h时的细胞活力分别为(60.06±3.87)%、(52.05±2.88)%、(36.43±2.01)%,表明随着鲁索替尼处理时间的延长,细胞活力逐渐降低。
2.4 不同浓度鲁索替尼对HEL细胞JAK2、SOCS1、SHP1的mRNA和蛋白以及p-JAK2蛋白表达的影响结果如图 2、表 4所示,不同浓度鲁索替尼处理HEL细胞48 h后,随着浓度的增加JAK2 mRNA表达水平逐渐降低(F=60.84,P<0.01),SOCS1、SHP1 mRNA表达水平逐渐升高(F=34.20、87.23,P 均<0.01)。不同浓度鲁索替尼处理HEL细胞48 h后,随着鲁索替尼浓度的增加,HEL细胞中JAK2、p-JAK2蛋白表达水平逐渐降低(P<0.05,P<0.01),SOCS1、SHP1的表达水平则逐渐升高(P 均<0.01)。与鲁索替尼对HEL细胞中JAK2、SOCS1、SHP1 mRNA的调控效应结果一致。
|
|
表 4 不同浓度鲁索替尼处理后HEL细胞中JAK2、SOCS1、SHP1的mRNA和蛋白以及p-JAK2蛋白的表达 Tab 4 Expressions of JAK2, SOCS1 and SHP1 mRNA and proteins, and p-JAK2 protein in HEL cells after treating with ruxolitinib at different concentrations |
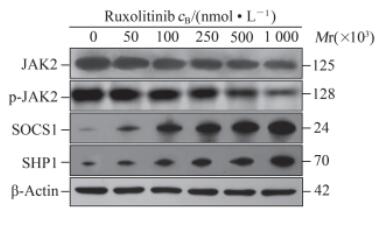
|
图 2 不同浓度鲁索替尼处理后HEL细胞中JAK2、p-JAK2、SOCS1、SHP1蛋白的表达 Fig 2 Expressions of JAK2, p-JAK2, SOCS1 and SHP1 proteins in HEL cells after treating with ruxolitinib at different concentrations Western blotting analysis. JAK2: Janus kinase 2; p-JAK2: Phosphorylated Janus kinase 2; SOCS1: Suppressor of cytokine signaling 1; SHP1: SH2-containing protein tyrosine phosphatase 1 |
3 讨论
JAK/STAT通路参与细胞增殖、分化、凋亡等生物学行为,在细胞因子受体介导的信号通路中起核心作用,是多数细胞因子的转导途径并活化相关靶基因[7, 11]。诸多研究表明,肿瘤的发生、发展与JAK/STAT信号通路的异常激活密切相关。费城染色体阴性的MPN患者中常常存在JAK2V617F、JAK2基因第12外显子突变,并且JAK2V617F 突变发生率最高[2]。JAK2V617F突变导致酪氨酸激酶过度活化从而持续激活JAK/STAT信号通路。本研究采用qPCR检测了48例MPN患者的JAK2V617F突变量,结果为(57.33±20.82)%,其中突变量≥50%的比例为45.83%(22/48),对照组的突变量则为0%。Zhao等[12]研究了中国170例PV和ET患者JAK2V617F突变量,所有患者JAK2V617F突变量中位数为15.6%,突变量>50%的比例分别为35.2%和11.2%,低于本研究结果,分析原因,本研究检测的是JAK2突变阳性的MPN患者,而Zhao等的结果则是统计了包括JAK2V617F突变阴性的所有PV和ET患者。另外,本研究应用免疫组织化学法检测的MPN患者p-JAK2蛋白表达量为(74.01±23.19)%,对照组为(42.29±15.78)%,差异有统计学意义(P<0.01),表明MPN患者JAK2V617F突变量和JAK2的活性均存在异常。
SOCS1不仅是JAK/STAT信号通路的靶基因,也是其负反馈调控因子,最终影响细胞的生长、增殖等生物学行为,从而抑制疾病、肿瘤的进展。SHP1是上皮和部分造血细胞恶性肿瘤的抑癌基因,是一种含SH2域的胞质酪氨酸磷酸酶,常通过JAK/STAT信号通路在造血细胞增殖分化中发挥负调控作用。多项研究表明,在乳腺癌、多发性骨髓瘤、急性髓细胞白血病等多种恶性肿瘤中发现SOCS、SHP1参与JAK/STAT的负向调节[13-16],但在MPN患者中尚未见相关报道。因此本研究检测了MPN患者肿瘤组织中SOCS1、SHP1蛋白表达情况,发现在MPN患者中SOCS1、SHP1蛋白表达较对照组降低(P<0.01),并且与JAK2V617F突变量呈负相关(SOCS1:r=-0.648,SHP1:r=-0.692;P 均<0.01),进一步证实了MPN中SOCS1、SHP1与JAK/STAT的负向调控关系,为后续实验奠定了基础。
近期发表的Ⅲ期临床试验证实了鲁索替尼的临床疗效[17]。本课题组前期研究显示,鲁索替尼能通过抑制JAK/STAT信号通路活化,抑制MPN患者肿瘤组织和HEL细胞中p-JAK2的表达,干扰下游靶基因与基质金属蛋白酶(matrix metalloprotein,MMP)-2、MMP-9启动基因的结合,下调MMP-2、MMP-9表达,从而抑制MMP-2、MMP-9参与的肿瘤细胞的侵袭和迁移过程,阻断了肿瘤细胞的无限增殖与迁移[18]。本研究在既往研究的基础上,进一步应用鲁索替尼处理具有JAK2V617F 突变的人红白血病细胞系HEL细胞,发现不同剂量的鲁索替尼能够抑制HEL细胞活力,影响其增殖。
一项对骨髓纤维化患者的长期临床观察的研究结果显示,经过鲁索替尼治疗后JAK2V617F突变量降低,约50%的患者纤维化程度得到改善或者病情稳定[19]。考虑到MPN患者中SOCS1、SHP1蛋白表达较对照组降低,因此,本研究还探讨了鲁索替尼是否能够通过调控JAK/STAT上调SOCS1、SHP1的表达。随着鲁索替尼浓度的增加,鲁索替尼对HEL细胞JAK2 mRNA、蛋白和p-JAK2蛋白表达的抑制作用逐渐增加,同时SOCS1、SHP1在mRNA和蛋白的表达水平均逐渐上升,表明鲁索替尼能够以SOCS1、SHP1为靶标,通过促进或阻断JAK/STAT通路达到治疗MPN的目的。
由此可见,MPN患者JAK2V617F突变细胞中SOCS1、SHP1低表达,并且与JAK2V617F突变量密切相关,鲁索替尼能够抑制JAK2V617F突变HEL细胞的增殖,并通过调控SOCS1、SHP1抑制JAK2信号通路,从而抑制MPN细胞增殖。
| [1] | KIM Y, PARK J, JO I, LEE G D, KIM J, KWON A, et al. Genetic-pathologic characterization of myeloproliferative neoplasms[J/OL]. Exp Mol Med, 2016, 48:e247. doi:10.1038/emm.2016.55. |
| [2] | O'SULLIVAN J M, HARRISON C N. JAK-STAT signaling in the therapeutic landscape of myeloproliferative neoplasms[J]. Mol Cell Endocrinol, 2017, 451: 71–79. DOI: 10.1016/j.mce.2017.01.050 |
| [3] | QUINTÁS-CARDAMA A, VADDI K, LIU P, MANSHOURI T, LI J, SCHERLE P A, et al. Preclinical characterization of the selective JAK1/2 inhibitor INCB018424:therapeutic implications for the treatment of myeloproliferative neoplasms[J]. Blood, 2010, 115: 3109–3117. DOI: 10.1182/blood-2009-04-214957 |
| [4] | VERSTOVSEK S, MESA R A, GOTLIB J, LEVY R S, GUPTA V, DIPERSIO J F, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis[J]. N Engl J Med, 2012, 366: 799–807. DOI: 10.1056/NEJMoa1110557 |
| [5] | HARRISON C, KILADJIAN J J, AL-ALI H K, GISSLINGER H, WALTZMAN R, STALBOVSKAVA V, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis[J]. N Engl J Med, 2012, 366: 787–798. DOI: 10.1056/NEJMoa1110556 |
| [6] | CERVANTES F, VANNUCCHI A M, KILADJIAN J J, AL-ALI H K, SIRULNIK A, STALBOVSKAVA V, et al. Three-year efficacy, safety, and survival findings from COMFORT-Ⅱ, a phase 3 study comparing ruxolitinib with best available therapy for myelofibrosis[J]. Blood, 2013, 122: 4047–4053. DOI: 10.1182/blood-2013-02-485888 |
| [7] | RAMPAL R, AL-SHAHROUR F, ABDEL-WAHAB O, PATEL J P, BRUNEL J P, MERMEL C H, et al. Integrated genomic analysis illustrates the central role of JAK-STAT pathway activation in myeloproliferative neoplasm pathogenesis[J/OL]. Blood, 2014, 123:e123-e133. doi:10.1182/blood-2014-02-554634. |
| [8] | PFITZNER E, KLIEM S, BAUS D, LITTERST C M. The role of STATs in inflammation and inflammatory diseases[J]. Curr Pharm Des, 2004, 10: 2839–2850. DOI: 10.2174/1381612043383638 |
| [9] | MIGONE T S, CACALANO N A, TAYLOR N, YI T, WALDMANN T A, JOHNSTON J A. Recruitment of SH2-containing protein tyrosine phosphatase SHP-1 to the interleukin 2 receptor; loss of SHP-1 expression in human T-lymphotropic virus type Ⅰ-transformed T cells[J]. Proc Natl Acad Sci USA, 1998, 95: 3845–3850. DOI: 10.1073/pnas.95.7.3845 |
| [10] | BARBUI T, THIELE J, VANNUCCHI A M, TEFFERI A. Rationale for revision and proposed changes of the WHO diagnostic criteria for polycythemia vera, essential thrombocythemia and primary myelofibrosis[J/OL]. Blood Cancer J, 2015, 5:e337. doi:10.1038/bcj.2015.64. |
| [11] |
徐倩, 刘贵敏, 谷蕾, 梁文同, 成志勇. 鲁索替尼对人红白血病HEL细胞增殖、凋亡作用的研究[J]. 第二军医大学学报, 2016, 37: 52–58.
XU Q, LIU G M, GU L, LIANG W T, CHENG Z Y. Effect of ruxolitinib on proliferation and apoptosis in human erythroleukemia leukemia[J]. Acad J Sec Mil Med Univ, 2016, 37: 52–58. |
| [12] | ZHAO S, ZHANG X, XU Y, FENG Y U, SHENG W, CEN J, et al. Impact of JAK2V617F mutation burden on disease phenotype in Chinese patients with JAK2V617F-positive polycythemia vera (PV) and essential thrombocythemia (ET)[J]. Int J Med Sci, 2016, 13: 85–91. DOI: 10.7150/ijms.10539 |
| [13] | SLATTERY M L, LUNDGREEN A, HINES L M, TORRES-MEJIA G, WOLFF R K, STERN M C, et al. Genetic variation in the JAK/STAT/SOCS signaling pathway influences breast cancer-specific mortality through interaction with cigarette smoking and use of aspirin/NSAIDs:the Breast Cancer Health Disparities Study[J]. Breast Cancer Res Treat, 2014, 147: 145–158. DOI: 10.1007/s10549-014-3071-y |
| [14] | BELDI-FERCHIOU A, SKOURI N, BEN ALI C, SAFRA I, ABDELKEFI A, LADEB S, et al. Abnormal repression of SHP-1, SHP-2 and SOCS-1 transcription sustains the activation of the JAK/STAT3 pathway and the progression of the disease in multiple myeloma[J/OL]. PLoS One, 2017, 12:e0174835. doi:10.1371/journal.pone.0174835. |
| [15] | AL-JAMAL H A, MAT JUSOH S A, HASSAN R, JOHAN M F. Enhancing SHP-1 expression with 5-azacytidine may inhibit STAT3 activation and confer sensitivity in lestaurtinib (CEP-701)-resistant FLT3-ITD positive acute myeloid leukemia[J/OL]. BMC Cancer, 2015, 15:869. doi:10.1186/s12885-015-1695-x. |
| [16] | LIONGUE C, WARD A C. Evolution of the JAK-STAT pathway[J/OL]. JAKSTAT, 2013, 2:e22756. doi:10.4161/jkst.22756. |
| [17] | VANNUCCHI A M, KILADJIAN J J, GRIESSHAMMER M, MASSZI T, DURRANT S, PASSAMONTI F, et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera[J]. N Engl J Med, 2015, 372: 426–435. DOI: 10.1056/NEJMoa1409002 |
| [18] | 刘贵敏, 张丽军, 付建珠, 梁文同, 成志勇, 白萍, 等. Ruxolitinib对JAK2V617F阳性骨髓增殖性肿瘤细胞基质金属蛋白酶调控的研究[J]. 中华血液学杂志, 2017, 38: 140–145. DOI: 10.3760/cma.j.issn.0253-2727.2017.02.011 |
| [19] | MASSARO F, MOLICA M, BRECCIA M. How ruxolitinib modified the outcome in myelofibrosis:focus on overall survival, allele burden reduction and fibrosis changes[J]. Expert Rev Hematol, 2017, 10: 155–159. DOI: 10.1080/17474086.2017.1273766 |
 2018, Vol. 39
2018, Vol. 39


