女性,53岁,体质量52 kg,身高158 cm。2017年1月3日因“颅内出血、脑梗后2个月,左房室瓣机械瓣膜功能障碍”入院。患者2年前于我院行双瓣膜置换术(double valve replacement,DVR),术后康复出院。2个月前因华法林“抗凝过量”导致脑出血,在外院急诊行左侧颅内血肿清除术+去骨板减压术治疗。术后当天为防止发生再次出血等并发症,停用华法林抗凝,停用后第2天患者出现脑梗死,右侧肢体偏瘫,经治疗并继续口服华法林抗凝后,偏瘫已不可逆。患者偏瘫后长期卧床,活动能力受限,自觉胸闷、气急等症状并不明显,1个月前复查心脏彩超提示:左房室瓣机械瓣膜一侧瓣叶开放受限伴血栓形成,遂入我院治疗。入院后体格检查:语言交流正常,左侧颅顶部颅骨缺失。心律齐,人工瓣膜启闭音异常。右侧上肢肌力1/6级;右下肢较左下肢肿胀,活动受限,肌力2/6级。行头颅MRI检查示:左侧顶部脑出血术后,右侧脑室引流术后,左侧顶叶脑肿胀;左侧海马、枕叶及顶叶内侧缘损伤、变性(图 1)。心脏彩超示:DVR术后2年,主动脉瓣机械瓣功能正常、启闭良好;左房室瓣机械瓣环回声略增强,靠近房间隔处瓣叶未见启闭活动,可见约3.8 cm×1.8 cm絮状回声团块附着,考虑为血栓形成致瓣叶卡瓣;对侧瓣叶启闭正常;瓣下最大血流速度为207 cm/s,压差17 mmHg(1 mmHg=0.133 kPa);瓣口可见反流,瞬时反流量6.0 mL。未见瓣周漏;左心室收缩功能正常,短轴缩短率(fraction shortening,FS)为27%,射血分数(ejection fraction,EF)为54%。给予强心利尿治疗,术前停用华法林3 d。于2017年1月10日行再次左房室瓣膜置换术(re-mitral valve replacement,Re-MVR)。手术采用胸骨正中切口,左侧股动脉和上、下腔静脉插管建立心肺转流,采用顺灌方式灌注心脏停搏液,术中采用近红外光谱仪(near-infrared spectroscopy, NIRS)监测脑氧饱和度。心脏停搏后,切开右心房经房间隔切口暴露左房室瓣,术中可见机械瓣膜室间隔侧瓣叶被血栓彻底包裹,瓣叶呈完全关闭状态(图 2A),血栓累及枢轴,左心室面机械瓣膜瓣下也存在严重的血栓附着(图 2B)。沿机械瓣瓣环切开后拆除原有机械瓣膜和缝线、垫片,彻底清除左心房、左心室内血栓后,用生理盐水反复冲洗心腔,再次置换1枚和上次手术相同的25 mm进口St. Jude双叶机械瓣。术中灌注心脏停搏液2次,每次20~25 min,主动脉开放后心脏自动复跳,主动脉阻断时间为56 min。术程顺利,安全返回重症监护室。患者术后当晚已清醒,意识正常、四肢活动情况同术前。次日上午拔除气管插管,使用高流量辅助吸氧治疗,逐步过渡为双鼻导管吸氧治疗,于2017年1月22日出院,嘱患者出院后继续服用华法林抗凝。出院前复查心脏彩超:左房室瓣机械瓣功能正常,瓣下最大血流速度为120 cm/s;左心室收缩功能正常(FS为28%,EF为54%)。患者术后1个月随访时恢复良好。
|
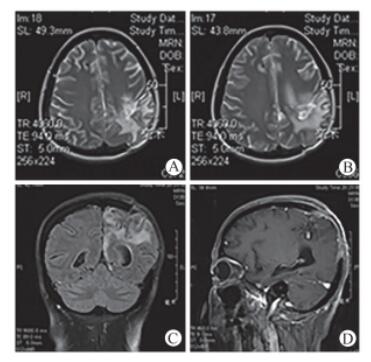
图 1 头颅MRI影像 MRI检查示:左侧顶部脑出血术后, 右侧脑室引流术后, 左侧顶叶脑肿胀(A, B); 左侧海马、枕叶及顶叶内侧缘损伤、变性(C, D) |

|
图 2 血栓致功能障碍的心脏机械瓣膜 A:机械瓣膜室间隔侧瓣叶被血栓彻底包裹, 瓣叶呈完全关闭状态; B:血栓累及枢轴,左心室面机械瓣膜瓣下存在严重的血栓附着 |
2 讨论
心脏瓣膜置换术后,由于口服抗凝药物异常所引发的脑卒中事件使心脏手术的风险明显增加,导致住院时间延长、住院费用增加和病死率增高[1-2]。资料显示,在西方发达国家,机械瓣膜血栓形成的发生率为每年0.3%~1.3%,而在发展中国家可高达每年6.1%,主要原因是由于抗凝治疗和监测不当所致[3]。机械瓣膜功能障碍的急诊手术病死率高达30%~50%[3],接受华法林抗凝治疗的患者中脑出血的发生率为0.3%~0.7%[4-5],口服华法林抗凝者比不使用华法林抗凝者脑出血的发生率高7~10倍[6],抗凝相关性脑出血患者6个月内的病死率为67%[7]。本例患者因口服华法林“抗凝过量”导致严重的颅内出血,在开颅减压术后停用华法林,造成脑梗死、偏瘫和机械瓣膜功能障碍,并导致左心房、左心室面血栓形成,从而接受Re-MVR。
本例患者术中原有人造瓣膜的拆卸是手术的重点,拆卸过程对左房室瓣环和周围组织的损伤情况决定了再次缝合、置入机械瓣膜的难易程度和术后是否发生出血、左心室破裂、传导阻滞等并发症。本例患者再次手术的时间与首次换瓣时间间隔2年,机械左房室瓣缝环表面已经完全内皮化且伴有增生,垫片显示不清且伴有血栓形成。因此,首先选择了垫片相对明显的一处,自缝环上方切开、切断缝线后拆除此处垫片,然后继续用刀片和组织剪自靠近机械瓣膜金属支架侧切割并逐步剪开缝环,然后继续围绕金属支架剪切缝环,目的在于先将机械瓣膜金属支架拆下以暴露术野,以及方便后续将遗留的缝环彻底拆除。同时在清除缝线、垫片、血栓等过程中尽可能减少损伤,保留更多的左房室瓣瓣环组织,便于再次缝合。
患者围手术期再次脑出血和脑梗死是非常严重的并发症。因此,本病例术中采用NIRS持续监测脑氧饱和度。研究报道,颅内压增高是脑出血的主要原因,脑出血后随着血肿的增大颅内压进一步增高,从而使脑组织灌注压下降,脑血供、氧供逐渐减少,脑氧饱和度明显下降,故脑氧饱和度监测结果可作为判断病情变化的指标[8]。本例患者监测结果和术后表现均未见异常,仅在恢复早期可见头颅去骨板处轻微向外肿胀,给予利尿剂等治疗后好转。
本例患者在术后拔除胸管后继续口服华法林抗凝,国际标准化比值(international normalized ratio,INR)维持在2~3。Otto[9]报道,应用华法林治疗,需要频繁调整剂量以维持足够的抗凝效果,这与INR、饮食结构的改变、不同的体育活动、药物间的相互作用、患者的依从性等因素相关。Grzymala-Lubanski等[10]对4 687例机械瓣置换术后的患者进行了5年随访,以研究出血风险和治疗时间与INR之间的关系。每年接受口服华法林抗凝治疗的患者中,血栓事件的发生率为2.41%,主要出血事件的发生率为3.15%[11],结果表明,高强度的抗凝并不能降低血栓形成的发生风险,反而会增加出血风险,INR为2.8~3.2患者发生出血风险的相对危险度是INR为2.2~2.7患者的2.92倍(95% CI:2.39~3.47)[11]。心脏瓣膜置换术后急性脑出血是非常严重的并发症,对心脏瓣膜假体置入后口服华法林抗凝导致急性脑出血的患者,目前尚未建立相关的逆转和恢复抗凝的治疗策略[11],仍需进一步研究。
| [1] | PUSKAS J D, WINSTON A D, WRIGHT C E, GOTT J P, BROWN W M 3rd, CRAVER J M, et al. Stroke after coronary artery operation:incidence, correlates, outcome, and cost[J]. Ann Thorac Surg, 2000, 69: 1053–1056. DOI: 10.1016/S0003-4975(99)01569-6 |
| [2] | MESSÉ S R, ACKER M A, KASNER S E, FANNING M, GIOVANNETTI T, RATCLIFFE S J, et al. Stroke after aortic valve surgery:results from a prospective cohort[J]. Circulation, 2014, 129: 2253–2261. DOI: 10.1161/CIRCULATIONAHA.113.005084 |
| [3] | 汪曾炜, 刘维永, 张宝仁. 心脏外科学[M]. 2版. 北京: 人民军医出版社, 2016: 588-597. |
| [4] | TOYODA K, YASAKA M, IWADE K, NAGATA K, KORETSUNE Y, SAKAMOTO T, et al. Dual antithrombotic therapy increases severe bleeding events in patients with stroke and cardiovascular disease:a prospective, multicenter, observational study[J]. Stroke, 2008, 39: 1740–1745. DOI: 10.1161/STROKEAHA.107.504993 |
| [5] | ROMUALDI E, MICIELI E, AGENO W, SQUIZZATO A. Oral anticoagulant therapy in patients with mechanical heart valve and intracranial haemorrhage. A systematic review[J]. Thromb Haemost, 2009, 101: 290–297. |
| [6] | STEINER T, ROSAND J, DIRINGER M. Intracerebral hemorrhage associated with oral anticoagulant therapy:current practices and unresolved questions[J]. Stroke, 2006, 37: 256–262. DOI: 10.1161/01.STR.0000196989.09900.f8 |
| [7] | MARIETTA M, PEDRAZZI P, GIRARDIS M, TORELLI G. Intracerebral haemorrhage:an often neglected medical emergency[J]. Intern Emerg Med, 2007, 2: 38–45. DOI: 10.1007/s11739-007-0009-y |
| [8] | 金科, 兰青. 重型颅脑损伤后局部脑氧饱和度的监测及意义[J]. 中华微侵袭神经外科杂志, 2004, 9: 248–251. |
| [9] | OTTO C M. Heartbeat:warfarin therapy for mechanical heart valves[J]. Heart, 2017, 103: 175–176. DOI: 10.1136/heartjnl-2016-311110 |
| [10] | GRZYMALA-LUBANSKI B, SVENSSON P J, RENLUND H, JEPPSSON A, SJÄLANDER A. Warfarin treatment quality and prognosis in patients with mechanical heart valve prosthesis[J]. Heart, 2017, 103: 198–203. DOI: 10.1136/heartjnl-2016-309585 |
| [11] | NISHIMURA K, KOGA M, MINEMATSU K, TAKAHASHI J C, NAGATSUKA K, KOBAYASHI J, et al. Intracerebral hemorrhage in patients after heart valve replacement[J]. J Neurol Sci, 2016, 363: 195–199. DOI: 10.1016/j.jns.2016.02.033 |
 2018, Vol. 39
2018, Vol. 39


