脊髓栓系综合征(tethered cord syndrome,TCS)是一组复杂的临床综合征[1]。传统定义上,TCS是指由于各种原因导致脊髓圆锥受到牵拉,出现低位圆锥[2],引起脊髓发生病理改变、圆锥缺血、电生理活动性降低,以及氧代谢活动障碍等病理变化[3-4],从而出现以双下肢感觉、运动功能及膀胱、肠道肛门括约肌功能障碍等神经损害的综合征[5]。TCS的发病机制被认为是由脊髓圆锥受到异常增粗的终丝、骶管内脂肪瘤或其他原因导致的轴性牵拉所致,因而以往针对TCS的动物模型研究大多通过对终丝施加压力来模拟TCS的临床症状[6-7]。然而随着研究逐渐深入,多位学者指出TCS栓系的结构包括终丝、脊髓和马尾神经[8],其不仅存在脊髓圆锥的牵拉损伤,还包括马尾神经和周围神经根的牵拉损伤[9],因此以往单纯通过牵拉终丝制备的TCS动物模型同TCS真实的发病机制和临床症状存在较大差异。本研究首次探索依据脊髓、神经根轴性损伤机制,通过轴性增长脊柱骨性结构建立TCS的动物模型。
1 材料和方法 1.1 实验动物及分组选用清洁级雌性家猪共18只,体质量44~46 kg。实验动物由上海汇智赢华医疗科技研发公司提供,实验动物许可证号:SYXK(沪)2010-0108。实验过程中动物的饲养及实验操作过程遵守实验动物管理与保护的有关规定。本研究获得第二军医大学实验动物研究伦理道德委员会批准许可。将实验动物随机分为假手术组、对照组和实验组3组,每组6只。
1.2 模型制作方法氯胺酮基础麻醉(15 mg/kg),气管插管后改为异氟烷吸入麻醉。麻醉生效后,留置导尿,猪取俯卧位,将四肢捆绑固定于手术台上,剪去背部毛发,以5%碘伏消毒皮肤,手术区域铺单。C形臂X线计算机透视定位第3腰椎(L3)为中点,作后正中切口,依次切开皮肤、深筋膜后,向两侧剥离椎旁肌肉,充分显露出L1~5两侧椎板。以咬骨钳咬除L1~5棘突及双侧部分关节突,用神经剥离子配合咬骨钳逐渐剥离并切除黄韧带及双侧椎板残留软组织,显露L1~5段脊髓。假手术组不作置钉和撑开手术;对照组和实验组动物在C形臂X线计算机透视引导下,依次于L1~5双侧椎弓根各置入椎弓根螺钉1枚。对照组不作撑开手术;实验组动物置钉后,松解腰椎后柱的小关节,安装连接杆后,依次均匀撑开L1/2、L2/3、L3/4、L4/5椎间隙并螺帽锁紧。各组动物均用丝线逐层缝合伤口,术后用生理盐水、碘伏冲洗背部伤口,并每天予头孢拉定针剂2 g静脉注射,预防感染。术后留置导尿,并人工辅助排尿、排便。
1.3 检测指标 1.3.1 X线检查假手术组动物于术前、术后拍摄腰椎X线片,对照组动物于置钉前、置钉后分别拍摄腰椎X线片,实验组动物于撑开前、后分别拍摄腰椎X线片,各组动物均以L1、L5椎体中心(腰椎侧位片上椎体四角连线的交点即为椎体的中心)分别作水平线,两条水平线之间的距离即为L1~5椎体间高度。
1.3.2 后肢运动神经功能评分分别于术前和术后第7天采用双盲法对各组动物后肢运动神经功能进行评分。评分参照Tarlov 5评分标准[10]:0分,后肢完全瘫痪,不能有任何活动;1分,可观察到轻微的后肢关节活动;2分,后肢可自由运动但是无法站立;3分,可以站立但是无法行走;4分,无瘫痪,后肢行走自如。
1.3.3 尿流动力学检查采用尿流动力学数据作为实验模型膀胱功能的检查指标。术前及术后第7天,动物麻醉成功后,留置导尿管,经尿道将压力传感器放置于膀胱内测量膀胱内压,将另一个压力传感器放置于直肠内测量腹内压(即直肠压);同时在肛周放置针电极,记录肛门括约肌肌电活动。检查时向膀胱缓慢灌注生理盐水使膀胱逐渐充盈直至其自动排尿,同步测定膀胱从充盈至排尿时的膀胱内压、腹内压、逼尿肌收缩压(膀胱内压减去腹内压)和尿流率的变化情况,通过检查仪器内电子线路运算后,计算机记录器将同时描记出4条相应的曲线,并记录肛门外括约肌的肌电活动情况。
1.3.4 躯体感觉诱发电位(somatosensory evoked potential,SEP)检测采用棘突间法检测SEP。在电生理检测设备连接时,将记录电极插在L2/3棘突间组织,刺激电极插在股后肌肉组织间,设刺激强度(强度10 mA,时间50 ms,重复周期10) 以猪后肢出现轻微的抽搐为宜,观察并记录P波的潜伏期和波幅变化情况。假手术组动物在麻醉生效后,暴露L1~5双侧椎板后检测SEP,然后切除L1~5棘突、黄韧带和残留的软组织,暴露脊髓,再次检测SEP。对照组动物在暴露脊髓后检测SEP,然后于L1~5双侧椎弓根各置入椎弓根螺钉1枚,再次检测SEP。实验组动物在暴露脊髓并于L1~5双侧椎弓根置入螺钉后检测SEP,然后安装连接杆,依次均匀撑开L1/2、L2/3、L3/4、L4/5椎间隙,最后用螺帽锁紧,再次检测SEP。
1.3.5 神经血流检测激光散斑血流成像利用激光光束照射到预定的血流检测区域的组织上,经过散射后,不同波幅的散射光相互干扰,形成随机干涉图样(即散斑),经过CDD成像系统分析获得高空间和高时间分辨率二维流速分布图。首先利用LASCI获得目标区域(L2~3段脊髓表面)组织图像,然后改用激光束,连续采集40帧。假手术组动物只在充分暴露脊髓之后检测1次血流情况,采集血流散斑图像;对照组动物在暴露脊髓及置钉后各进行1次血流检测,分别采集血流散斑图像;实验组动物在置钉及撑开后各进行1次血流检测,分别采集血流散斑图像。LASCI血流检测包括目标区域内的实时伪彩色血流图和单位时间内目标区域内的血液流通量。应用Matlab软件将提取的散斑图像数据进行分析处理,转换成散斑称比图和伪彩色血流图;然后应用IPP 6.0软件对图像数据进行分析处理,以各个像素点的平均光密度值代表该点的血流相对值。
1.3.6 组织病理学观察各组动物于术后第7天处死,于L2~3段脊髓及双侧L2神经根取材,按照固定、冲洗、梯度脱水、透明、浸蜡、包埋、切片、展片、贴片、脱蜡、脱苯、水化等过程进行处理,然后进行Harris苏木精染色、冲洗、分化、浸泡,再进行0.5%的伊红染色、梯度脱水、透明、封片等处理,最后在显微镜下观察并拍照记录相关结果。
1.4 统计学处理采用SPSS 18.0软件进行数据分析。X线检查测量结果以x±s表示,各组组内比较采用配对t检验,组间比较采用方差分析。后肢运动神经功能评分分析采用秩和检验。尿流动力学检查数据分析采用Fisher精确检验。体感诱发电位检查结果用x±s表示,各组组内比较采用配对t检验,组间比较采用协方差分析。神经血流检测数据用x±s表示,各组组内比较采用配对t检验,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 X线检查结果假手术组和对照组动物L1~5椎体间高度术后与术前比较差异无统计学意义;实验组动物L1~5椎体间高度术后比术前增高,差异有统计学意义(P<0.01),平均增高约23.413 mm。3组术前与术后L1~5椎体间高度的差值比较差异有统计学意义(F=1 270.069,P<0.01),其中假手术组与对照组比较差异无统计学意义(P=0.260),实验组与另外两组比较差异均有统计学意义(P<0.01)。见表 1。
|
|
表 1 各组动物L1~5椎体间高度 Tab 1 L1-5 intervertebral height of each group |
2.2 后肢运动神经功能评分
术前3组动物后肢运动功能均正常。术后第7天,假手术组和对照组动物后肢运动神经功能评分无改变,运动功能均正常;实验组6只动物的运动功能评分均在2分以内,可以观察到下肢、臀部皮肤有不同程度的磨损,其中1只动物完全瘫痪,2只动物无法站立,3只动物仅可观察到轻微的后肢关节活动。术后第7天,实验组动物的后肢运动神经功能评分低于假手术组和对照组(P<0.05)。见表 2。
|
|
表 2 各组动物后肢运动神经功能评分 Tab 2 Hindlimb motor function scores of each group |
2.3 尿流动力学检查
术前3组动物尿流动力学检查结果均正常。术后第7天,假手术组和对照组动物尿流动力学检查未见明显改变;实验组5只动物出现逼尿肌-括约肌协同功能障碍以及膀胱顺应性降低,顺应性为1.15 mL/cmH2O(正常值>101.15 mL/cmH2O,1 cmH2O=0.098 kPa),见图 1。术后第7天,实验组发生逼尿肌-括约肌协同功能障碍的动物数量与假手术组和对照组比较差异均有统计学意义(P<0.05),见表 3。

|
图 1 实验组动物术前与术后7 d尿流动力学检查结果 Fig 1 Pre-and post-operative urodynamics examination results of experiment group A: Pre-operative urodynamics results were nearly normal; B: Urodynamics results at 7 d after operation showed decreased bladder compliance, which was 1.15 mL/cmH2O (normal value >101.15 mL/cmH2O, 1 cmH2O=0.098 kPa), and detrusor-sphincter dyssynergia. Qura: Urine flow rate; Pdet: Detrusor pressure; Pves: Intravesical pressure; Pabd: Abdominal pressure; EMG: Urethral sphincter electromyography |
|
|
表 3 各组动物逼尿肌-括约肌协同功能 Tab 3 Detrusor-sphincter synergia of each group |
2.4 SEP检查结果
术前3组动物SEP P波波幅和潜伏期差异均无统计学意义。术后各组P波波幅和潜伏期与术前比较差异有统计学意义(P<0.05);其中实验组术后P波波幅降低,潜伏期延长,与假手术组和对照组相比差异均有统计学意义(P<0.01)。见表 4。
|
|
表 4 各组动物P波的波幅和潜伏期 Tab 4 Amplitude and latency of P-wave of each group |
2.5 神经血流检测结果
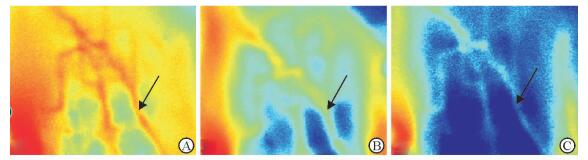
从伪彩色血流图上可以看到,未进行椎间隙撑开的各动物血管及其分支红色区域较多,提示血管及其分支循环状态良好,血液充盈丰富;行椎间隙撑开后可见红色部分逐渐减少,提示脊髓表面血管血流量逐渐减少,甚至完全阻断(图 2)。经过软件将数据结果转换成脊髓表面血管的血流相对值进行比较,实验组动物撑开后脊髓血流相对值较术前降低(P<0.01),且低于对照组(P<0.01),见表 5。
|
图 2 各组激光散斑血流图 Fig 2 Laser speckle blood flow imaging of each group A: The laser speckle imaging of sham and control groups showed tip vessels and their branches were circulating in good condition and filling with rich blood (arrow); B: The imaging of experiment group after operation showed that red vascular branch gradually decreased (arrow), suggesting that the blood flows on surface of the spinal cord gradually reduced; C: The imaging of experiment group after 0.5 h of operation showed that the vascular branches were almost blue (arrow), suggesting that the blood flows on surface of the spinal cord disappeared, or completely blocked |
|
|
表 5 各组动物脊髓表面血流相对值 Tab 5 Blood flows on surface of spinal cord of each group |
2.6 组织病理学结果
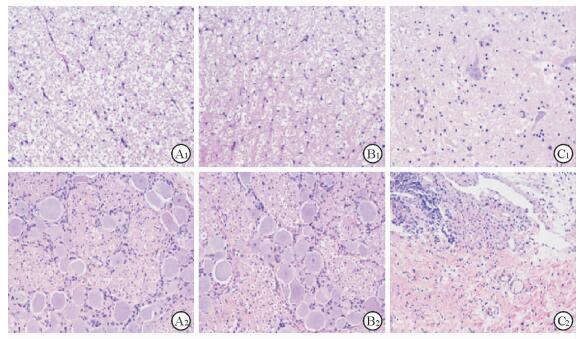
H-E染色结果显示,假手术组动物的脊髓组织灰质、白质界限清楚,神经细胞形态完整;神经根神经纤维排列整齐,轴突及树突结构完整,未见轴突断裂情况,髓鞘排列紧密,未见脱髓鞘现象,未见组织水肿或出血现象。对照组动物的脊髓和神经根组织H-E染色结果与假手术组类似。实验组动物的脊髓组织灰质、白质界限模糊,可见不同程度的神经细胞坏死,胞质内可见颗粒变性和空泡变性;神经根组织可见组织水肿、细胞结构疏松,可见出血、变性、坏死,部分神经束膜损伤。见图 3。
|
图 3 各组脊髓、神经根H-E染色结果 Fig 3 H-E staining of spinal cords and nerve roots in each group A1, B1: H-E staining of spinal cords in sham and control groups showed that the boundaries of gray matter and white matter were clear, and the nerve cells were morphologically intact; A2, B2: H-E staining of nerve roots in sham and control groups showed that the root fibers arranged neatly, structure of the axons and dendrites were intact, myelin sheathes arranged closely, and no broken axon myelin, demyelination, interstitial edema or bleeding was observed; C1: H-E staining of spinal cords in experiment group showed that the boundaries of gray matter and white matter were fuzzy, and varying degrees of nerve cells necrosis and granular, vacuolar degeneration in the cytoplasm were observed; C2: H-E staining of nerve roots in experiment group showed that edema, sparse cell structure, partial injured perineurium, and hemorrhage; degeneration and necrosis were observed in nerve root tissues. Original magnification: ×200 |
3 讨论
TCS的概念由Garceau首次提出,并定义为位于L1/2水平的脊髓圆锥受到增厚的膜性结构即终丝的牵张力而引起的临床综合征[11]。基于此致病机制,部分学者进行了通过对终丝施加压力模拟TCS。Yamada等[6]通过切除猫的椎板,对终丝施加压力制作TCS动物模型,研究发现越近尾端, 终丝牵拉对脊髓产生的影响越大,脊髓功能的损害越严重。Koçak等[7]用氰基丙烯酸盐黏合剂将豚鼠的终丝末端固定于骶骨周围来制作TCS动物模型,发现脊髓存在缺血性损害, 运动及感觉神经纤维的传导速度都减慢。但随着研究的深入,临床上发现了一种隐匿型的终丝紧张综合征,其临床表现与TCS相符,而患者的脊髓圆锥处于正常位置[9, 12]。Warker和Oakes[13]通过观察一系列TCS患者提出低位脊髓圆锥并不是TCS的必要条件,并指出TCS诊断的必要条件应该是渐进性的神经功能障碍和终丝的增厚。至此,终丝增厚不再作为诊断TCS的标志。Warder[14]将TCS定义为由各种类型的脊柱发育异常引起的渐进性神经功能障碍。此外,以往基于终丝牵拉理论作为TCS外科治疗金标准的终丝切断术、神经松解术也在近年的研究中被发现并发症多、远期术后效果不满意等诸多弊端[15-16],不断被学者质疑。近来提出的通过脊柱短缩截骨手术间接缓解由轴向异常牵拉导致的脊髓损伤,获得了满意的临床效果[17]。因此,TCS中脊髓的轴向牵拉是由多条神经根、马尾神经和终丝共同作用的结果,单纯对终丝施加压力难以模拟TCS真实的致病机制和临床症状。本实验拟通过对猪多个连续腰椎间隙进行均匀撑开造成相应节段脊髓、神经根轴性牵拉损伤的动物模型来模拟TCS。
本实验通过于猪L1~5椎弓根置入螺钉、切除L1~5棘突、松解部分小关节以达到松解后柱结构的目的,然后对L1/2、L2/3、L3/4、L4/5 4个间隙进行均匀撑开,实验组动物平均能够撑开约23.413 mm,单个间隙平均增加约5.853 mm,证明通过松解后柱结构达到椎间隙撑开的目的是可行的。实验组术后第7天的神经功能评分较对照组升高,表明通过椎间隙均匀撑开的方法实验动物出现明显的运动功能障碍。
当脊髓神经长期处于过度牵拉的状态时,其血流、代谢和电生理等方面会发生改变,供养血管受牵拉变形变细,神经元缺氧,细胞内线粒体高度减少,三磷酸腺苷的产生明显减少,使脊髓由机械性损伤发展为代谢性损伤,长期处于这种状态使脊髓发生变性、坏死、软化、萎缩和脊髓空洞等病理变化,进而出现一系列神经功能损害的临床表现[8, 18]。Koçak等[7]研究发现TCS模型中躯体感觉电位和运动诱发电位潜伏期延长,波幅下降,表明运动和感觉神经纤维的传导功能出现损害;此外,研究者还在TCS模型中观察到水肿反应,证实神经纤维、轴突以及髓鞘发生病理改变。本实验中实验组动物的脊髓和神经根组织发生神经细胞坏死、胞质内颗粒变性和空泡变性、神经纤维断裂、组织水肿严重、变性、坏死以及脱髓鞘等病理改变,提示猪的腰椎间隙撑开后,脊髓、神经根发生损伤,与以往研究的病理改变相符合。LASCI系统具有较高的空间分辨率和时间分辨率,能够动态、非接触性地检测血流速度、血管管径以及血流量等指标,获得血流动力学的多个检测指标,并且通过计算机软件转换为二维图像和数据进行分析。本实验将LASCI技术应用于脊髓表面血流检测,同时应用经典的神经功能评价方法SEP评价同节段神经功能状况,根据检查结果可以看到椎间隙撑开后,脊髓表面血流减少甚至中断,从而引起脊髓组织缺血缺氧,严重影响脊髓功能;SEP检查发现撑开后P波潜伏期延长,波幅下降,表明神经根发生严重损伤,从而影响下肢功能,进一步验证了该动物模型的可靠性和稳定性。
TCS患者常常伴有难以逆转的膀胱功能损害[19-20]。约73%的患者出现泌尿系统症状,其中最常见的是逼尿肌收缩功能受损,主要表现为低顺应性膀胱、漏尿点压力降低、安全容量减低、逼尿肌功能弱、括约肌不协调等[6, 18]。本实验中未行椎间隙撑开的假手术组和对照组动物在术前及术后第7天的逼尿肌-括约肌协同功能均表现为正常,而进行椎间隙撑开后实验组动物的逼尿肌-括约肌协同功能障碍以及膀胱顺应性降低,结果与TCS患者的尿流动力学表现基本符合。
本实验首次根据脊髓、终丝、马尾神经轴向损伤机制成功地模拟了TCS的相关临床表现,具备临床相似性和一定的可调控性,但撑开后各指标之间的协同变化关系、以及各节段撑开高度与损伤程度的线性关系等仍需进一步研究。此外,该模型操作相对复杂,实验材料耗费较高,进展大量可重复性实验有一定的难度。多指标、大样本的综合分析对于动物模型的研究是非常重要的,通过全面地对各指标的变化进行分析,获得更加全面的信息,从生化、生理功能以及病理机制等方面对模型进行论证是我们接下来的研究内容。
综上所述,通过于猪腰椎置入螺钉、松解后柱结构、撑开椎间隙的方法,可以建立脊髓、神经根轴性牵拉损伤模型,该模型比较客观地模拟了TCS的括约肌功能障碍、下肢感觉及运动功能障碍等疾病特征,为深入研究TCS的病理机制奠定了实验基础。
| [1] | LEE G Y, PARADISO G, TATOR C H, GENTILI F, MASSICOTTE E M, FEHLINGS M G. Surgical management of tethered cord syndrome in adults:indications, techniques, and long-term outcomes in 60 patients[J]. J Neurosurg Spine, 2006, 4: 123–131. DOI: 10.3171/spi.2006.4.2.123 |
| [2] | YAMADA S, KNERIUM D S, MANDYBUR G M, SCHULTZ R L, YAMADA B S. Pathophysiology of tethered cord syndrome and other complex factors[J]. Neurol Res, 2004, 26: 722–726. DOI: 10.1179/016164104225018027 |
| [3] | YAMADA S, WON D J, YAMADA S M. Pathophysiology of tethered cord syndrome:correlation with symptomatology[J]. Neurosurg Focus, 2004, 16: E6. DOI: 10.3171/foc.2004.16.2.7 |
| [4] | FILIPPIDIS A S, KALANI M Y, THEODORE N, REKATE H L. Spinal cord traction, vascular compromise, hypoxia, and metabolic derangements in the pathophysiology of tethered cord syndrome[J]. Neurosurg Focus, 2010, 29: E9. DOI: 10.3171/2010.3.FOCUS1085 |
| [5] | STETLER W R Jr, PARK P, SULLIVAN S. Pathophysiology of adult tethered cord syndrome:review of the literature[J]. Neurosurg Focus, 2010, 29: E2. DOI: 10.3171/2010.3.FOCUS1080 |
| [6] | YAMADA S, ZINKE D E, SANDERS D. Pathophysiology of "tethered cord syndrome"[J]. J Neurosurg, 1981, 54: 494–503. DOI: 10.3171/jns.1981.54.4.0494 |
| [7] | KOÇAK A, KILIÇ A, NURLU G, KONAN A, KILINÇ K, CIRAK B, et al. A new model for tethered cord syndrome:a biochemical, electrophysiological, and electron microscopic study[J]. Pediatr Neurosurg, 1997, 26: 120–126. |
| [8] | YAMADA S, WON D J, PEZESHKPOUR G, YAMADA B S, YAMADA S M, SIDDIQI J, et al. Pathophysiology of tethered cord syndrome and similar complex disorders[J]. Neurosurg Focus, 2007, 23: E6. DOI: 10.3171/Fol-07/08/E6 |
| [9] | 陈可夫, 贾连顺, 史建刚. 脊髓栓系综合征病因的研究进展[J]. 中国矫形外科杂志, 2016, 24: 55–57. |
| [10] | TATOR C H. Acute spinal cord injury in primates produced by an inflatable extradural cuff[J]. Can J Surg, 1973, 16: 222–231. |
| [11] | GARCEAU G J. The filum terminale syndrome (the cord-traction syndrome)[J]. J Bone Joint Surg Am, 1953, 35-A: 711–716. |
| [12] | TU A, STEINBOK P. Occult tethered cord syndrome:a review[J]. Childs Nerv Syst, 2013, 29: 1635–1640. DOI: 10.1007/s00381-013-2129-1 |
| [13] | WARDER D E, OAKES W J. Tethered cord syndrome and the conus in a normal position[J]. Neurosurgery, 1993, 33: 374–378. |
| [14] | WARDER D E. Tethered cord syndrome and occult spinal dysraphism[J]. Neurosurg Focus, 2001, 10: e1. DOI: 10.3171/fol.2001.10.1.2 |
| [15] | PHI J H, LEE D Y, JAHNG T A, CHUNG C K, KIM H J. Tethered cord syndrome in adulthood:reconsidering the prognosis[J]. J Korean Neurosurg Sot, 2004, 36: 114–119. |
| [16] | GARCÉS-AMBROSSI G L, MCGIRT M J, SAMUELS R, SCIUBBA D M, BYDON A, GOKASLAN Z L, et al. Neurological outcome after surgical management of adult tethered cord syndrome[J]. J Neurosurg Spine, 2009, 11: 304–309. DOI: 10.3171/2009.4.SPINE08265 |
| [17] | SHI J, JIA L, YUAN W, CHEN D. Multisegmental spinal-shortening osteotomy for the treatment of tethered cord syndrome:a retrospective study of six consecutive cases[J]. Global Spine J, 2014, 04(S 01). DOI: 10.1055/s-0034-1376546 |
| [18] | KONDO A, KATO K, KANAI S, SAKAKIBARA T. Bladder dysfunction secondary to tethered cord syndrome in adults:is it curable?[J]. J Urol, 1986, 135: 313–316. DOI: 10.1016/S0022-5347(17)45622-9 |
| [19] | PANG D, WILBERGER J E Jr. Tethered cord syndrome in adults[J]. J Neurosurg, 1982, 57: 32–47. DOI: 10.3171/jns.1982.57.1.0032 |
| [20] | GIDDENS J L, RADOMSKI S B, HIRSHBERG E D, HASSOUNA M, FEHLINGS M. Urodynamic findings in adults with the tethered cord syndrome[J]. J Urol, 1999, 161: 1249–1254. DOI: 10.1016/S0022-5347(01)61648-3 |
 2017, Vol. 38
2017, Vol. 38


