脓毒症是机体对感染的反应失调而导致的危及生命的器官功能障碍[1]。该病发病率高,病情进展迅速,全球每年有超过1 800万严重脓毒症病例,病死率高达30%~70%,且这一数字还在逐年递增[2]。一般认为,脓毒症早期机体出现全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),而后出现免疫抑制反应,导致继发感染[3]。研究发现,脓毒症炎症反应可诱导淋巴细胞凋亡、辅助性T(Th)细胞由Th1细胞向Th2细胞漂移和调节性T细胞(Treg细胞)增多等免疫抑制表现,这不但有助于阐明脓毒症的免疫调控机制,也为脓毒症的治疗提供新的靶点[4]。
恒定自然杀伤T (invariant natural killer T, iNKT)细胞是兼具T细胞和自然杀伤(natural killer, NK)细胞表型和功能的特殊T细胞亚群,具有特殊的免疫调节功能和细胞毒作用,是目前的研究热点。近年来研究表明,iNKT细胞作为免疫应答的重要细胞,在肿瘤、自身免疫性疾病及脓毒症中起到重要作用[5-7]。本研究拟通过小鼠盲肠结扎穿孔(cecal ligation and puncture, CLP)脓毒症模型以及临床对照研究探讨脓毒症早期iNKT细胞与炎症反应、预后以及病情严重程度之间的相互关系,明确iNKT细胞在脓毒症发生、发展中的作用。
1 材料和方法 1.1 动物实验 1.1.1 动物分组和造模健康雄性C57BL/6小鼠(6~8周龄,体质量20~25 g)由第二军医大学实验动物中心提供,许可证号:SYXK(沪)2012-0003。采用随机数字表法,将小鼠随机分为假手术组、CLP手术脓毒症组(CLP组)和抗-CD1d组。假手术组开腹后不进行CLP手术,CLP组和抗-CD1d组构建CLP脓毒症模型;抗-CD1d组于术前3 h给予抗-CD1d阻断性抗体,假手术组及CLP组给予相应的同型对照进行干预。造模后每天背部注射头孢呋辛钠(意大利GlaxoSmithKline公司,批号:J670) 50 mg/kg抗感染及1 mL生理盐水补充容量,自由饮食饮水。
1.1.2 小鼠iNKT细胞、细胞因子及细菌负荷检测假手术组、CLP组和抗-CD1d组小鼠各8只,于CLP 24 h后,采集全部小鼠外周血(心脏采血)及腹腔灌洗液,并取脾脏及胸腺标本。脾脏及胸腺标本加入1 mL灭菌PBS后碾压均匀,滤网滤出细胞悬液,吹打均匀后置入离心管中备用。用TCRβ-FITC、α-GalCer/CD1d-PE(BD公司,美国)标记细胞,应用流式细胞仪检测外周血、脾脏和胸腺中iNKT细胞水平,TCRβ、α-GalCer/CD1d标记双阳的细胞为小鼠iNKT细胞。分离外周血血清,应用ELISA试剂盒(eBioscience公司,美国)检测外周血细胞因子肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6、干扰素γ(IFN-γ)和IL-4水平。小鼠外周血及腹腔灌洗液稀释后均匀涂于铺好的灭菌琼脂糖凝胶上,37 ℃恒温培养24 h后进行菌落计数。菌落计数根据稀释浓度最终换算到原液菌落数目,以菌落形成单位(clonal formation unit, CFU)为计量单位。
1.1.3 小鼠生存情况观察假手术组、CLP组和抗-CD1d组小鼠各10只,造模后连续观察10 d,记录小鼠生存情况。
1.2 临床研究 1.2.1 受试者筛选采用病例对照方法进行前瞻性分析。病例组选取2016年4月至2017年3月第二军医大学长海医院ICU收治的脓毒症患者20例,年龄18~70岁,原发病主要为急诊腹腔感染及腹腔术后感染,记录其入ICU 24 h内急性生理和慢性健康(APACHE Ⅱ)评分的最低评分。纳入标准:根据Sepsis 3.0诊断标准及患者临床症状评估脓毒症,患者血液或体液细菌学培养连续2次一致且同时伴有临床感染症状,序贯器官衰竭估计(SOFA)评分≥2分。排除标准:慢性心、肝、肺、肾、血液系统疾病史;恶性肿瘤;长期服用免疫抑制剂。对照组选取同期20名健康成人志愿者,年龄18~70岁,不限制性别及职业,来源主要为健康体检者及医院工作人员。本研究获得第二军医大学长海医院伦理委员会批准,所有入选患者均签署知情同意书。
病例组20例患者中,男14例,女6例;年龄(51.35±10.52) 岁;SOFA评分为6.75±3.77,APACHE Ⅱ评分21.90±5.79;细菌培养结果:大肠埃希菌13例,粪肠球菌1例,阴沟肠杆菌7例,鹑鸡肠球菌1例,屎肠球菌5例,金黄色葡萄球菌1例,洋葱伯克霍尔德菌1例,鲍蔓不动杆菌1例,铜绿假单孢菌2例,黄单孢菌1例;其中2例检出3株细菌,9例检出2株细菌,9例检出1株细菌。对照组20名健康志愿者中,男12名,女8名,年龄(50.32±11.35) 岁。
1.2.2 受试者iNKT细胞和细胞因子检测取入组病例清晨空腹静脉血4 mL,300×g离心10 min。取血清,加入无菌PBS稀释1倍,采用ELISA试剂盒(R & D公司,美国)检测TNF-α、IL-6、IFN-γ和IL-4水平;沉淀细胞使用红细胞裂解液裂解红细胞,用1 mL PBS洗涤后按照推荐剂量加入荧光标记的单克隆抗体抗人Vb11-FITC和抗人Vα24-PE(BD公司,美国),避光孵育30 min,加入1 mL PBS洗涤,300×g离心5 min,再加入200 μL PBS,上流式细胞仪(BD公司,美国)检测,Vα24和Vb11双阳的细胞为iNKT细胞。
1.3 统计学处理使用SPSS 22.0 (SPSS Inc, 美国)及GraphPad Prism 5.0(Graphpad Software,美国)软件进行数据处理和分析。正态分布的计量资料以x±s表示,3组数据先经one-way ANOVA检测,两组比较采用t检验,相关性采用Pearson相关性分析,小鼠生存率采用log-rank检测。检验水准(α)为0.05。
2 结果 2.1 脓毒症小鼠iNKT细胞水平如图 1所示,CLP组小鼠外周血、脾脏、胸腺中的iNKT细胞水平相较假手术组增加,差异有统计学意义(P<0.01);而给予抗-CD1d阻断性抗体后,iNKT细胞活化减少(P<0.05,P<0.01)。

|
图 1 流式细胞术检测小鼠外周血、脾脏、胸腺iNKT细胞水平 Fig 1 iNKT cell frequencies of peripheral blood, spleen and thymus of sepsis mice were detected by flow cytometry iNKT: Invariant natural killer T; CLP: Cecal ligation and puncture. **P < 0.01 vs sham group; △P < 0.05, △△P < 0.01 vs CLP group. n=8, x±s |
2.2 脓毒症小鼠iNKT细胞水平与细胞因子的相关性
如图 2所示,CLP组小鼠外周血细胞因子TNF-α、IL-6、IFN-γ和IL-4水平相比假手术组均升高(P<0.05,P<0.01);给予抗-CD1d阻断性抗体预处理后,小鼠细胞因子TNF-α、IL-6、IFN-γ、IL-4水平较CLP组下降(P<0.05,P<0.01)。相关性分析结果显示,脓毒症小鼠iNKT细胞水平与IFN-γ和IL-4呈正相关(r=0.593,P=0.046;r=0.689,P=0.02),而与TNF-α、IL-6无明显相关性;给予抗-CD1d阻断性抗体的脓毒症小鼠外周血iNKT细胞与细胞因子间无明显相关性。
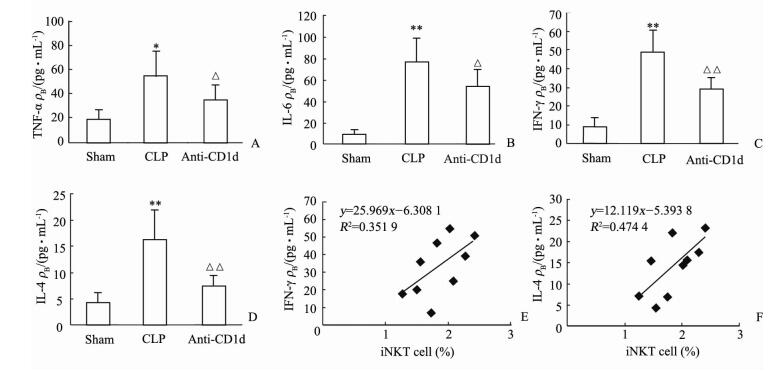
|
图 2 脓毒症小鼠外周血细胞因子水平及iNKT细胞与细胞因子相关性分析 Fig 2 Correlations of peripheral blood iNKT cells and serum cytokine level in sepsis mice A-D: TNF-α, IL-6, IFN-γ, and IL-4 level in peripheral blood, respectively; E, F: Correlation between iNKT cell frequency with IFN-γ and IL-4, respectively. iNKT: Invariant natural killer T; CLP: Cecal ligation and puncture; TNF-α: Tumor necrosis factor-α; IL: Interleukin; IFN-γ: Interferon-γ. *P < 0.05, **P < 0.01 vs sham group; △P < 0.05, △△P < 0.01 vs CLP group. n=8, x±s |
2.3 抗-CD1d抗体对脓毒症小鼠细菌负荷的影响
CLP组小鼠外周血及腹腔灌洗液中细菌菌落数相比假手术组增加(P<0.01),而抗-CD1d组与CLP组相比细菌菌落数减少(P<0.01,图 3)。
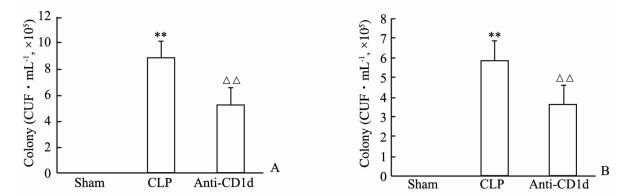
|
图 3 给予抗-CD1d抗体后小鼠外周血及腹腔灌洗液中细菌负荷比较 Fig 3 Effects of anti-CD1d antibody on bacterial burden in peripheral blood and peritoneal lavage fluid of sepsis mice A: Bacterial burden in peripheral blood; B: Bacterial burden in lavage fluid. CLP: Cecal ligation and puncture; CFU: Clonal formation unit. **P < 0.01 vs sham group; △△P < 0.01 vs CLP group. n=8, x±s |
2.4 抗-CD1d抗体对脓毒症小鼠生存率的影响
CLP组小鼠每天死亡数分别为2、2、1、1、2、1、1,第7天已全部死亡;抗-CD1d组小鼠每天死亡数分别为1、1、1、0、0、1、1、0、1、0,第10天时剩余4只;假手术组无小鼠死亡。统计分析发现,CLP组小鼠死亡率高于假手术组,而给予抗-CD1d阻断性抗体后死亡率下降(P<0.01,图 4)。
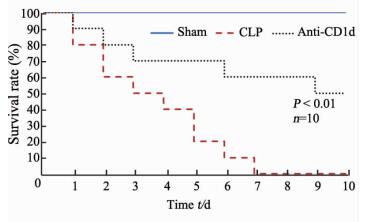
|
图 4 给予抗-CD1d抗体后脓毒症小鼠生存率变化 Fig 4 Survival rate of sepsis mice treated with anti-CD1d blocking antibody |
2.5 脓毒症患者外周血iNKT细胞比例与细胞因子及病情的相关性
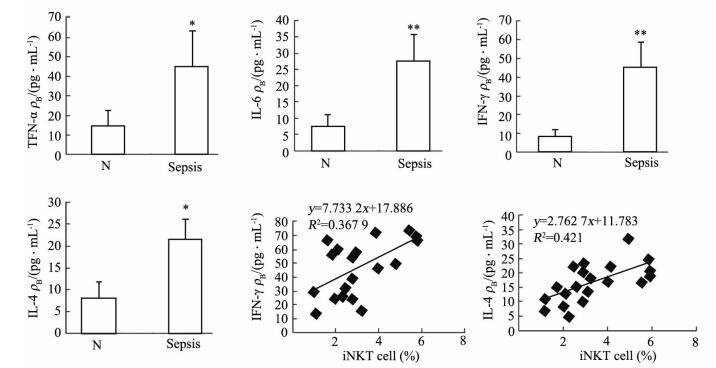
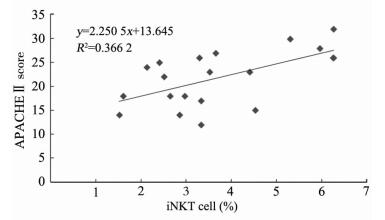
脓毒症患者外周血中iNKT细胞比例高于健康对照组[(3.67±1.52)% vs (0.58±0.29)%,P<0.01,图 5];同时,脓毒症患者外周血血浆中细胞因子TNF-α、IL-6、IFN-γ、IL-4的水平均高于健康对照组(P<0.05, P<0.01;图 6)。相关性分析结果显示,iNKT细胞水平分别与IFN-γ、IL-4呈正相关(r=0.607,P=0.005;r=0.649,P=0.002;图 6),而与TNF-α、IL-6之间无明显相关性。同时,脓毒症患者外周血iNKT细胞比例与APACHE Ⅱ评分也呈正相关(r=0.605,P=0.005,图 7)。
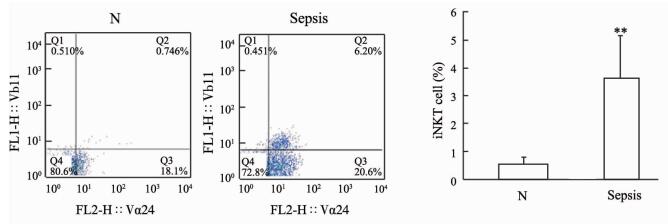
|
图 5 流式细胞术检测脓毒症患者和健康对照者外周血iNKT细胞水平 Fig 5 Frequencies of peripheral blood iNKT cells detected by flow cytometry in septic patients and healthy volunteers iNKT: Invariant natural killer T; N: Healthy volunteers. **P < 0.01 vs N group. n=20, x±s |
|
图 6 脓毒症患者外周血细胞因子水平及iNKT细胞比例与细胞因子IFN-、IL-4的相关性 Fig 6 Correlations of peripheral blood iNKT cells proportion and serum levels of IFN-γ and IL-4 in septic patients iNKT: Invariant natural killer T; N: Healthy volunteers; TNF-α: Tumor necrosis factor-α; IL: Interleukin; IFN-γ: Interferon-γ. *P < 0.05, **P < 0.01 vs N group. n=20, x±s |
|
图 7 脓毒症患者外周血iNKT细胞比例与APACHE Ⅱ评分的相关性 Fig 7 Correlation of peripheral blood iNKT cell proportion and APACHEⅡscore iNKT: Invariant natural killer T; APACHE Ⅱ: Acute Physiology and Chronic Health Evaluation Ⅱ |
3 讨论
脓毒症的发病机制极其复杂,其炎症反应是由巨噬细胞、树突状细胞(DC)、T细胞、NK细胞等一系列炎性细胞相继激活,释放炎性介质引起级联瀑布样反应,诱发全身炎症反应,最终导致多器官功能障碍综合征(MODS)及死亡[8]。
iNKT细胞是一类天然存在的介导先天免疫和获得性免疫的新型免疫调节细胞,是具有NK受体及功能的T细胞亚群,其中TCRVot链高度保守(在人类由Vα24-Jα18和Vb11链组成),能特异性识别CD1d递呈的糖脂类抗原[9]。iNKT细胞活化后既可以通过分泌多种细胞因子影响T细胞、NK细胞和细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)的功能,又能够直接杀伤肿瘤细胞等靶细胞[5],是固有免疫系统的重要组成部分之一。iNKT细胞具有特殊的双向免疫调节作用。iNKT细胞经经典的外源性刺激剂α-GalCer作用活化后可迅速增殖,选择性产生促炎性细胞因子(IFN-γ等)或抑炎性细胞因子(IL-4等),进一步扩大免疫反应,激活下游巨噬细胞、NK细胞和DC等固有免疫细胞,促进Th1或Th2细胞极化,从而影响免疫应答类型,对纠正免疫系统紊乱和维持免疫环境稳态至关重要[10]。近年来研究发现,iNKT细胞数量和功能的变化在疾病中起着重要作用。iNKT细胞对假单胞菌、链球菌、螺旋体感染等所导致的脓毒症都起着重要的免疫调节作用,还可影响脓毒症时中性粒细胞对肝脏的损害、抑制单核细胞向巨噬细胞转变及调节巨噬细胞功能[11]。基于上述特点,iNKT细胞越来越受到关注,是近年来研究感染免疫应答的重要细胞。
本研究结果发现脓毒症早期小鼠和脓毒症患者的iNKT细胞都明显增加。iNKT的激活主要有“直接激活”和“间接激活”两种机制,直接激活途径是病原微生物的胞壁鞘糖脂(GSL)成分与CD1d结合后为iNKT细胞的T细胞受体(TCR)识别[12];间接激活是病原微生物及其产物通过Toll样受体激活抗原递呈细胞(APC),进而通过细胞因子等激活iNKT细胞[12-13]。iNKT细胞通过TCR识别CD1d递呈的抗原后大量活化,产生大量细胞因子,这种快速的应答反应可以扩大感染部位的内源性免疫应答,促进炎性因子的释放,给予抗-CD1d抗体可抑制iNKT细胞的直接激活,影响外周血iNKT细胞的活化。本研究结果证实,脓毒症小鼠外周血TNF-α、IL-6、IFN-γ、IL-4水平均升高,且外周血iNKT细胞水平与细胞因子IFN-γ、IL-4呈正相关,给予抗-CD1d抗体后脓毒症小鼠的外周血、肝脏、胸腺中活化iNKT细胞减少,TNF-α、IL-6、IFN-γ、IL-4水平下降,由此说明脓毒症早期iNKT细胞大量激活,活化iNKT细胞与细胞因子分泌关系密切。这种炎性因子的大量释放可能与脓毒症早期器官功能损害相关。
有研究提示,iNKT细胞缺失的小鼠(Vα24-Jα18-/-)在CLP后死亡率可明显下降[14],这可能与iNKT细胞活化被抑制后可降低脓毒症导致的“细胞因子风暴”对脏器功能的损害有关。有研究发现在金黄色葡萄球菌内毒素B导致的小鼠中毒性休克中,iNKT细胞活化与死亡率相关,而给予抗-CD1d抗体部分抑制iNKT细胞活化通路却可加速外周血及腹腔中细菌的清除,降低脓毒症小鼠的死亡率,最终影响脓毒症小鼠的疾病病程及预后[15]。iNKT细胞对免疫的双向调节作用在脓毒症早期是以促炎性(IFN-γ)还是以抑炎性(IL-4) 为主仍不得而知。本研究提示通过抗-CD1d抗体部分抑制iNKT细胞活化通路可减轻脓毒症小鼠细菌负荷,同时减少细胞因子的释放,从而减少机体脏器功能损害,最终使脓毒症小鼠的死亡率降低。这可能与脓毒症早期过度炎症反应导致机体免疫细胞耗竭有一定关系,而抗-CD1d抗体可部分抑制这种过度炎症反应,从而维持机体细菌清除能力。
临床研究结果同样提示脓毒症患者外周血iNKT细胞水平及细胞因子TNF-α、IL-6、IFN-γ、IL-4水平均增加,且外周血iNKT细胞水平与IFN-γ、IL-4呈正相关。由此说明,脓毒症早期患者有大量iNKT细胞迁移到外周循环中,分泌IFN-γ、IL-4等细胞因子,参与机体免疫应答。本研究还发现,脓毒症患者外周血iNKT细胞比例与患者APACHE Ⅱ评分呈正相关。APACHE Ⅱ评分是客观评价危重病患者病情轻重的指标[16]。本研究选择脓毒症患者时排除了长期慢性心、肺、肝、肾等重要脏器疾病及长期服用免疫抑制药等对慢性健康评估有影响的患者,主要观察的是脓毒症早期对急性生理功能的影响,避免了其他慢性疾病因素对结果的干扰。结果提示,APACHE Ⅱ评分越高的患者,其外周血iNKT细胞水平也越高,提示iNKT细胞的过度活化导致大量炎性因子释放可引起机体脏器功能损害,从而影响疾病的严重程度及预后。由于临床脓毒症诊断的复杂性,本研究所纳入的脓毒症患者原发病及病情严重程度有所不同,且患者就医时间不同、导致不同患者取样本的时机不一致,加之样本量的局限,都对结果产生一定影响。
本研究初步表明脓毒症早期iNKT细胞活化增加,其与炎性因子水平升高以及病情危重情况有一定的相关性,但iNKT细胞参与脓毒症免疫应答的具体作用机制仍有待深入研究。
| [1] | SINGER M, DEUTSCHMAN C S, SEYMOUR C W, SHANKAR-HARI M, ANNANE D, BAUER M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315: 801–810. DOI: 10.1001/jama.2016.0287 |
| [2] | STOLLER J, HALPIN L, WEIS M, APLIN B, QU W, GEORGESCU C, et al. Epidemiology of severe sepsis:2008-2012[J]. J Crit Care, 2016, 31: 58–62. DOI: 10.1016/j.jcrc.2015.09.034 |
| [3] | HOTCHKISS R S, COOPERSMITH C M, McDUNN J E, FERGUSON T A. The sepsis seesaw:tilting toward immunosuppression[J]. Nat Med, 2009, 15: 496–497. DOI: 10.1038/nm0509-496 |
| [4] | LI J, LI M, SU L, WANG H, XIAO K, DENG J, et al. Alterations of T helper lymphocyte subpopulations in sepsis, severe sepsis, and septic shock:a prospective observational study[J]. Inflammation, 2015, 38: 995–1002. DOI: 10.1007/s10753-014-0063-3 |
| [5] | HEFFERNAN D S, MONAGHAN S F, CHUNG C S, CIOFFI W G, GRAVENSTEIN S, AYALA A. A divergent response of innate regulatory T-cells to sepsis in humans:circulating invariant natural killer T-cells are preserved[J]. Hum Immunol, 2014, 75: 277–282. DOI: 10.1016/j.humimm.2013.11.004 |
| [6] | MOTOHASHI S, OKAMOTO Y, YOSHINO I, NAKAYAMA T. Anti-tumor immune responses induced by iNKT cell-based immunotherapy for lung cancer and head and neck cancer[J]. Clin Immunol, 2011, 140: 167–176. DOI: 10.1016/j.clim.2011.01.009 |
| [7] | TUDHOPE S J, VON DELWIG A, FALCONER J, PRATT A, WOOLRIDGE T, WILSON G, et al. Profound invariant natural killer T-cell deficiency in inflammatory arthritis[J]. Ann Rheum Dis, 2010, 69: 1873–1879. DOI: 10.1136/ard.2009.125849 |
| [8] | ROSSAINT J, ZARBOCK A. Pathogenesis of multiple organ failure in sepsis[J]. Crit Rev Immunol, 2015, 35: 277–291. DOI: 10.1615/CritRevImmunol.v35.i4 |
| [9] | EXLEY M, GARCIA J, BALK S P, PORCELLI S. Requirements for CD1d recognition by human invariant Valpha24+ CD4-CD8- T cells[J]. J Exp Med, 1997, 186: 109–120. DOI: 10.1084/jem.186.1.109 |
| [10] | TANIGUCHI M, SEINO K, NAKAYAMA T. The NKT cell system:bridging innate and acquired immunity[J]. Nat Immunol, 2003, 4: 1164–1165. DOI: 10.1038/ni1203-1164 |
| [11] | WINTERMEYER P, CHENG C W, GEHRING S, HOFFMAN B L, HOLUB M, BROSSAY L, et al. Invariant natural killer T cells suppress the neutrophil inflammatory response in a mouse model of cholestatic liver damage[J]. Gastroenterology, 2009, 136: 1048–1059. DOI: 10.1053/j.gastro.2008.10.027 |
| [12] | EMOTO M, SHIMIZU T, KOIKE H, YOSHIZAWA I, HURWITZ R, KAUFMANN S H, et al. Dissociated expression of natural killer 1.1 and T-cell receptor by invariant natural killer T cells after interleukin-12 receptor and T-cell receptor signalling[J]. Immunology, 2010, 129: 62–74. DOI: 10.1111/(ISSN)1365-2567 |
| [13] | NAGARAJAN N A, KRONENBERG M. Invariant NKT cells amplify the innate immune response to lipopolysaccharide[J]. J Immunol, 2007, 178: 2706–2713. DOI: 10.4049/jimmunol.178.5.2706 |
| [14] | HU C K, VENET F, HEFFERNAN D S, WANG Y L, HORNER B, HUANG X, et al. The role of hepatic invariant NKT cells in systemic/local inflammation and mortality during polymicrobial septic shock[J]. J Immunol, 2009, 182: 2467–2475. DOI: 10.4049/jimmunol.0801463 |
| [15] | SZABO P A, RUDAK P T, CHOI J, XU S X, SCHAUB R, SINGH B, et al. Invariant natural killer T cells are pathogenic in the HLA-DR4-transgenic humanized mouse model of toxic shock syndrome and can be targeted to reduce morbidity[J]. J Infect Dis, 2017, 215: 824–829. |
| [16] | JIN H, TANG L Q, PAN Z G, PENG N, WEN Q, TANG Y Q, et al. Ten-year retrospective analysis of multiple trauma complicated by pulmonary contusion[J]. Mil Medi Res, 2014, 1: 7. DOI: 10.1186/2054-9369-1-7 |
 2017, Vol. 38
2017, Vol. 38


