石菖蒲、安息香和苏合香为中药方剂中常用的芳香开窍药物,对脑缺血再灌注损伤大鼠的血脑屏障均具有明显的保护作用[1-2]。安息香、苏合香可提高小鼠大脑皮质和下丘脑中伊文思蓝含量,苏合香能增加海马和纹状体中罗丹明123(Rho-123) 的分布,且两者不影响血脑屏障的超微结构[3]。石菖蒲能松弛大鼠血脑屏障的紧密连接,增加脑内伊文思蓝和苯妥英钠的含量[4]。本研究组也发现,石菖蒲、安息香和苏合香可促进Caco-2细胞对Rho-123的摄取[5],石菖蒲能增加远志成分3, 4, 5-三甲氧基肉桂酸在兔体内的吸收[6],促进白芷成分花椒毒酚、水合氧化前胡素和白当归素在大鼠空肠和回肠的吸收以及在Caco-2细胞单层模型中的转运[7],但石菖蒲、安息香和苏合香促进药物吸收的机制仍不清晰。本研究采用大鼠肠外翻模型和Caco-2细胞,探讨石菖蒲、安息香和苏合香挥发油对Rho-123肠转运的作用及其机制,为这3种药物与P糖蛋白(P-glycoprotein,P-gp)介导的药物配伍提供实验依据。
1 材料和方法 1.1 动物与细胞SD雄性大鼠,SPF级,体质量(280±20) g,由西安交通大学医学院实验动物中心提供,动物生产许可证号:SCXK(陕) 2012-003。人结肠癌细胞株Caco-2购于中国科学院上海细胞库。
1.2 试剂石菖蒲、安息香和苏合香购于西安市药材市场,由西北大学生命科学学院房敏峰教授鉴定,分别为石菖蒲Acorus tatarinowii Schott.的干燥根茎、安息香科植物白花树Styrax tonkinensis(Pierre)Craib ex Hart的干燥树脂和苏合香树Liquidambar orientalis Mill.树干分泌的香树脂。DMEM高糖培养液、胎牛血清、乙二胺四乙酸二钠(EDTA-2Na)和胰蛋白酶(美国Gibco公司);二甲基亚砜(DMSO)和Rho-123(美国Sigma-Aldrich公司);盐酸维拉帕米注射液(Ver;上海禾丰制药有限公司,生产批号:140127)。PE-UIC2荧光抗体、PE-IgG2a荧光同型对照抗体(美国eBioscience公司);SYBR® Premix Ex TaqTMⅡ试剂盒、PrimeScript® RT reagent试剂盒和RNAiso Plus试剂(大连TaKaRa公司);琼脂糖(法国Biowest公司);DL2000 DNA Marker(北京鼎国昌盛生物公司)。
1.3 仪器1100系列高效液相色谱仪(美国Agilent公司);C150 CO2培养箱(德国Binder公司);FACSCalibur型流式细胞仪(美国BD公司);TE2000-U型倒置显微镜(日本Nikon公司);5804-R型高速冷冻离心机(德国Eppendorf公司);JY300C电泳仪(北京君意东方电泳设备有限公司);WD-9413型凝胶成像分析仪(北京市六一仪器厂);iCycle荧光定量分析仪(美国Bio-Rad公司)。
1.4 石菖蒲、安息香和苏合香挥发油供试品溶液的制备称取石菖蒲、安息香和苏合香干燥至恒质量的粉末(24~65目) 200.0 g,分别置于2 000 mL圆底烧瓶中,按照《中华人民共和国药典》挥发油测定法[8],收集石菖蒲(β-细辛醚70.8%,α-细辛醚5.4%)、安息香(安息香醛4.5%,香草醛0.56%、樟脑0.34%)和苏合香(安息香酸苄酯30.4%,安息香醛1.8%)挥发油。精密称取各挥发油适量,加入DMSO溶解,制备石菖蒲、安息香和苏合香挥发油10% DMSO供试品溶液,4 ℃冷藏备用。实验时,用相应的溶剂稀释成一定浓度。
1.5 肠外翻实验按文献[9-10]方法,大鼠麻醉后,腹正中线切口2.0~3.0 cm,快速取出大鼠小肠,置于K-R营养液中,用冰凉的K-R液冲洗干净。分别量取空肠及回肠段10 cm,用光滑的玻璃棒翻转肠部,冲洗干净黏液,一端用丝线扎紧,另一端插入塑料套管(4.0 mm,外径)后用丝线结扎,向肠囊内注入1.0 mL K-R营养液。将外翻肠囊悬浮于45.0 mL 37 ℃的K-R溶液中,并通入95% O2+5% CO2。分别向肠囊外的K-R溶液中加入石菖蒲、安息香和苏合香挥发油(终浓度均为60 μg/mL),阳性对照组加入100 μg/mL Ver,正常对照组加入等容积的DMSO K-R溶液(DMSO终浓度均为0.05%)。孵育30 min后,向肠囊外K-R溶液中加入Rho-123(终浓度为1.9 μg/mL),分别于15、30、45、60、75、90 min时从塑料套管端取样0.2 mL,取样后向浆膜的腔室补充K-R营养液保持固定体积。K-R溶液中Rho-123的浓度采用高效液相色谱-荧光检测(HPLC-FLD)方法[5]进行测定。Rho-123吸收量(Q)、吸收速率常数(Ka)和表观通透系数(Papp)按下列公式[10-11]计算:
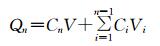
|
(1) |
Qn为第n个取样点Rho-123的吸收量;n为取样次数;V为肠囊的容积;Vi为取样量;Cn为第n个取样点Rho-123的浓度。
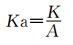
|
(2) |
K为Rho-123的吸收量Q对取样时间t所得直线回归方程的斜率;A为肠囊转运药物的有效面积。
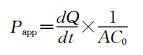
|
(3) |
dQ/dt为单位时间Rho-123的吸收量;A为肠囊转运药物的有效面积;C0为肠囊外Rho-123的初始浓度。
1.6 MTT实验将Caco-2细胞接种于含DMEM培养液的细胞培养瓶中,培养液中含10%胎牛血清、1%非必需氨基酸和1% L-谷氨酰胺。置于5% CO2、37 ℃的培养箱中培养。隔天更换培养液,当细胞生长至80%~90%融合时,用EDTA和胰酶消化并传代。
将Caco-2细胞(1×104/mL)接种于96孔培养板,培养24 h后,分别加入含有0.01%、0.1%、0.3%、0.8%和1.0%的Ver或石菖蒲、安息香和苏合香挥发油培养液2 μL,并设阴性对照孔和空白调零孔(各孔含DMSO的终浓度均为0.1%)。继续培养48 h,吸弃各孔的培养液,加5.0 mg/mL MTT溶液20 μL,继续培养4 h,弃去上清液后,用150 μL DMSO振荡10 min溶解结晶,酶标仪(490 mn)测定光密度(D)值。细胞存活率(%) =(给药孔D值/阴性对照孔D值)×100%。
1.7 流式细胞术测定Caco-2细胞P-gp蛋白的表达取浓度均为80 μg/mL的石菖蒲、安息香和苏合香挥发油及10 μg/mL Ver分别与Caco-2细胞作用48 h后,消化并吹打制成单细胞悬液。4 ℃ 300×g离心10 min,用4 ℃冷藏的PBS洗涤2次。将细胞稀释至1×107/mL,加药组各取100 μL细胞。未加药细胞取2份,一份设为同型对照组,加入PE-IgG2a同型对照抗体5 μL;另一份设为阴性细胞组,与加药物组一起各加入PE-UIC2荧光抗体5 μL,4 ℃孵育30 min,冰冷的PBS洗涤2次,300×g离心10 min,用0.5 mL PBS重悬,流式细胞仪测定荧光强度。
1.8 qPCR测定Caco-2细胞P-gp基因MDR1 mRNA的表达用TRIzol法提取总RNA,cDNA合成按照PrimeScript® RT reagent试剂盒说明书操作:37 ℃ 15 min×3反转录,85 ℃ 5 s失活。qPCR按照SYBR® Premix Ex TaqTMⅡ试剂盒说明书进行操作。MDR1上游引物序列:5′-TCA GAC AGG ATG TGA GTT G-3′,下游引物序列:5′-AAT TAC AGC AAG CCT GGA ACC-3′。内参GAPDH上游引物序列:5′-GAA GGT GAA GGT CGG AGT C-3′,下游引物序列:5′-GAA GAT GGT GAT GGG ATT TC-3′。反应条件:95 ℃预变性30 s;95 ℃ 3 s、60 ℃ 30 s,40个循环。采用相对量分析法计算药物组MDR1 mRNA表达。
1.9 统计学处理应用SPSS 16.0软件处理数据,两组间差异比较采用独立样本t检验,检验水准(α)为0.05。
2 结果 2.1 各挥发油对大鼠肠外翻模型肠囊Rho-123 Ka和Papp的影响实验结果(表 1)表明,石菖蒲、安息香和苏合香挥发油均可增加Rho-123的Ka和Papp(P均<0.01);空肠和回肠的Ka分别为正常对照组的1.41、1.16和1.17倍及1.36、1.73和1.65倍,Papp分别为正常对照组的1.47、1.21和1.22倍及1.28、1.73和1.68倍。
|
|
表 1 石菖蒲、安息香和苏合香挥发油对大鼠外翻肠囊Rho-123 Ka和Papp的影响 Tab 1 Effects of volatile oils (VOs) of Shichangpu, benzoin and storax on absorption rate constant (Ka) and apparent permeability coefficient (Papp) of Rhodamine (Rho)-123 in rat everted gut sac |
2.2 各挥发油对Caco-2细胞存活率的影响
1.0~80.0 μg/mL石菖蒲、安息香和苏合香挥发油作用48 h后,细胞的存活率均大于90.0%,说明在此剂量范围内石菖蒲、安息香和苏合香挥发油对Caco-2细胞均无明显的毒性作用(表 2)。
|
|
表 2 石菖蒲、安息香和苏合香挥发油对Caco-2细胞存活率的影响 Tab 2 Effects of volatile oils (VOs) of Shichangpu, benzoin and storax on survival rate of Caco-2 cells |
2.3 各挥发油对Caco-2细胞P-gp蛋白表达的影响
选择80 μg/mL浓度研究了石菖蒲、安息香和苏合香挥发油对Caco-2细胞P-gp蛋白表达的影响。结果表明,石菖蒲、安息香和苏合香挥发油均可降低P-gp蛋白表达(P<0.01),其降低率分别为53.15%、55.10%和61.86%。苏合香挥发油作用优于石菖蒲和安息香挥发油,而石菖蒲和安息香挥发油的作用差异无统计学意义(表 3)。
|
|
表 3 石菖蒲、安息香和苏合香挥发油对P-gp蛋白及其基因MDR1表达的影响 Tab 3 Effects of volatile oils (VOs) of Shichangpu, benzoin and storax on protein and MDR1 mRNA expression of P-glycoprotein (P-gp) |
2.4 各挥发油对Caco-2细胞MDR1 mRNA表达的影响
80 μg/mL石菖蒲、安息香和苏合香挥发油作用48 h能降低Caco-2细胞P-gp基因MDR1 mRNA的表达,其降低率分别为55.41%、16.24%和38.46%。同等浓度下,石菖蒲挥发油作用最强,苏合香挥发油的作用次之,安息香挥发油作用最弱(表 3)。
3 讨论P-gp为多药耐药性基因MDR表达的产物,是机体产生多药耐药性的主要原因[12-13]。P-gp不仅在肿瘤细胞上高表达,而且在机体的胃肠道、脑微血管内皮细胞、脑腔面膜、肾近曲小管上皮细胞、睾丸毛细血管内皮细胞、肝小管膜和合体滋养层细胞表面等部位均有表达[14-19],能将外源性物质排出体外,从而影响药物的吸收和分布[20]。
在中药方剂中,石菖蒲、安息香和苏合香常作为使药,可引导其他药物直达病所,从而发挥治疗作用[21-22]。本研究组前期证实,苏合香、安息香和石菖蒲有效成分安息香醛、香草醛和β-细辛醚可促进Rho-123在Caco-2细胞内的聚集,降低细胞培养液中Rho-123的含量[5]。本研究结果表明,石菖蒲、安息香和苏合香挥发油均可促进大鼠空肠和回肠对P-gp底物Rho-123的吸收,增加Rho-123的Ka和Papp。结果提示,石菖蒲、安息香和苏合香挥发油促进Rho-123的吸收作用可能与抑制P-gp有关。
总之,本研究结果表明石菖蒲、安息香和苏合香挥发油均可使Caco-2细胞P-蛋白及其基因MDR1 mRNA的表达降低,提示抑制P-gp及其基因的表达可能为石菖蒲、安息香和苏合香促进药物吸收和分布的主要作用机制之一。同时本研究还发现,石菖蒲、安息香和苏合香挥发油对P-gp蛋白的表达和对MDR1 mRNA的表达的抑制作用强弱并不一致,可能是由于石菖蒲、安息香和苏合香挥发油对P-gp的转录和翻译作用不同所致。
| [1] | 肖一鑫, 章纪叶, 刘佳奕, 洪咪凯, 张江松, 周慧, 等. 石菖蒲煎剂对不同时长急性脑缺血再灌注大鼠BBB保护效应的研究[J]. 成都中医药大学学报, 2016, 39: 32–35. |
| [2] | 倪彩霞, 曾南, 许福会, 苟玲, 刘金伟, 王建, 等. 芳香开窍药对脑缺血再灌注损伤大鼠血脑屏障影响的实验研究[J]. 中国中药杂志, 2011, 36: 2562–2564. |
| [3] | 丁洁, 张莹, 巫悦, 夏婷婷, 李博, 喻斌. 麝香、安息香和苏合香对血脑屏障脑区特异性开放作用及其机制[J]. 中国医院药学杂志, 2015, 35: 279–282. |
| [4] | 胡园, 袁默, 刘屏, 穆丽华, 王虹. 石菖蒲对血脑屏障超微结构及通透性的影响[J]. 中国中药杂志, 2009, 33: 349–351. DOI: 10.3321/j.issn:1001-5302.2009.03.026 |
| [5] | 杨洋, 王世祥, 房敏峰, 杨凌鉴, 孟雪, 郑晓晖. 安息香醛、香草醛和β-细辛醚对P-糖蛋白功能的影响[J]. 中成药, 2012, 34: 1364–1366. DOI: 10.3969/j.issn.1001-1528.2012.07.041 |
| [6] | 房敏峰, 李云峰, 张文娟, 王亚洲, 郑晓晖, 王世祥. 石菖蒲对远志药代动力学的影响[J]. 西北大学学报(自然科学版), 2010, 40: 85–88. |
| [7] | 张倩. 白芷-石菖蒲配伍机制与P-糖蛋白调控机制研究[D]. 西安: 西北大学, 2015. |
| [8] | 国家药典委员会. 中华人民共和国药典[S]. 四部. 北京: 中国医药科技出版社, 2015: 203. |
| [9] | CHULA S, HANG L, YINYING B, JIANNING S, SHI R. The effects of notoginsenoside R1 on the intestinal absorption of geniposide by the everted rat gut sac model[J]. J Ethnopharmacol, 2012, 142: 136–143. DOI: 10.1016/j.jep.2012.04.027 |
| [10] | LI H, DONG L, LIU Y, WANG G, ZHANG L, QIAO Y. Comparison of two approaches of intestinal absorption by puerarin[J]. J Pharmacol Toxicol Methods, 2014, 70: 6–11. DOI: 10.1016/j.vascn.2014.03.170 |
| [11] | 谢小珂, 闫利华, 朱晶晶, 姚丽, 易红, 刘晓谦, 等. 外翻肠囊法研究扶正消症方中黄连碱类在大鼠肠内的吸收[J]. 中国中药杂志, 2016, 41: 2144–2148. |
| [12] | JULIANO R L, LING V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants[J]. Biochim Biophys Acta, 1976, 455: 152–162. DOI: 10.1016/0005-2736(76)90160-7 |
| [13] | CHEN Z, SHI T, ZHANG L, ZHU P, DENG M, HUANG C, et al. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family in multidrug resistance:a review of the past decade[J]. Cancer Lett, 2016, 370: 153–164. DOI: 10.1016/j.canlet.2015.10.010 |
| [14] | THIEBAUT F, TSURUO T, HAMADA H, GOTTESMAN M M, PASTAN I, WILLINGHAM M C. Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues[J]. Proc Natl Acad Sci USA, 1987, 84: 7735–7738. DOI: 10.1073/pnas.84.21.7735 |
| [15] | THÖRN M, FINNSTRÖM N, LUNDGREN S, RANE A, LÖÖF L. Cytochromes P450 and MDR1 mRNA expression along the human gastrointestinal tract[J]. Br J Clin Pharmacol, 2005, 60: 54–60. DOI: 10.1111/bcp.2005.60.issue-1 |
| [16] | LIU Z, MI J, YANG S, ZHAO M, LI Y, SHENG L. Effects of P-glycoprotein on the intestine and blood-brain barrier transport of YZG-331, a promising sedative-hypnotic compound[J]. Eur J Pharmacol, 2016, 791: 339–347. DOI: 10.1016/j.ejphar.2016.08.039 |
| [17] | TUCKER T G, MILNE A M, FOURNEL-GIGLEUX S, FENNER K S, COUGHTRIE M W. Absolute immunoquantification of the expression of ABC transporters P-glycoprotein, breast cancer resistance protein and multidrug resistance-associated protein 2 in human liver and duodenum[J]. Biochem Pharmacol, 2012, 83: 279–285. DOI: 10.1016/j.bcp.2011.10.017 |
| [18] | VÄHÄKANGAS K, MYLLYNEN P. Drug transporters in the human blood-placental barrier[J]. Br J Pharmacol, 2009, 158: 665–678. DOI: 10.1111/j.1476-5381.2009.00336.x |
| [19] | KONG L L, SHEN G L, WANG Z Y, ZHUANG X M, XIAO W B, YUAN M, et al. Inhibition of P-glycoprotein and multidrug resistance-associated protein 2 regulates the hepatobiliary excretion and plasma exposure of thienorphine and its glucuronide conjugate[J]. Front Pharmacol, 2016, 7: 242. DOI: 10.3389/fpnar.2016.00242 |
| [20] | SILVA R, VILAS-BOAS V, CARMO H, DINIS-OLIVEIRA R J, CARVALHO F, DE LOURDES BASTOS M, et al. Modulation of P-glycoprotein efflux pump:induction and activation as atherapeutic strategy[J]. Pharmacol Ther, 2015, 149: 1–123. DOI: 10.1016/j.pharmthera.2014.11.013 |
| [21] | 纪娟, 周安, 张亚中, 张莉. 芳香开窍类中药促进药物体内吸收的研究进展[J]. 江西中医药大学学报, 2016, 28: 106–108. |
| [22] | 刘超, 刘敬霞, 刘抒雯, 甘佳乐. 芳香开窍药调控血脑屏障机制研究及脑病治疗[J]. 长春中医药大学学报, 2016, 32: 874–877. |
 2017, Vol. 38
2017, Vol. 38


