肝细胞肝癌(以下简称肝癌)是我国常见的实体恶性肿瘤,虽然其诊断及治疗手段不断发展完善,但由于其发生和发展过程复杂,涉及因素众多,且具有侵袭力强和病死率高的特点,因此阐明新的肝癌发病机制及寻找新的作用靶点仍不容忽视[1-3]。
肝细胞核因子(hepatocyte nuclear factors,HNFs)家族包括HNF1、HNF3、HNF4、HNF6以及CCAAT/增强子结合蛋白(C/EBP),是一种在肝脏优势表达并对维持肝细胞功能和分化状态起关键作用的转录因子[4-6],其中HNF4α在肝癌的发生、发展及治疗中发挥重要作用[7-10]。在探讨HNF4α作用机制的过程中,研究发现HNF4α上调DLK1-DIO3印记基因区的miR-379-656簇的多个miRNA[11],miR-544即是其中之一。既往研究表明miR-544与多种恶性肿瘤的形成与发展密切相关,如胶质母细胞瘤[12-13]、骨肉瘤[14]、宫颈癌[15]、乳腺癌[16]、鼻咽癌[17]和胃癌[18]等,但miR-544在肝癌中的表达及作用未见报道。本研究检测了miR-544在二乙基亚硝胺(diethylinitrosamine,DEN)造模大鼠肝组织[10]及20对肝癌患者的癌组织和癌旁组织中的表达,并在体外探讨了miR-544对肝癌细胞恶性生物学行为的作用,旨在明确miR-544在肝癌中的作用,为肝癌的诊治提供新靶点。
1 材料和方法 1.1 DEN模型大鼠肝组织以及人肝癌组织和癌旁组织的获取选用清洁级Wistar大鼠,体质量120~150 g,委托第二军医大学实验动物中心培育[许可证号:SYXK(沪)2012-0003]。腹腔注射DEN制备大鼠原发性肝癌模型[10],分别于DEN诱导后0、10、18、22周时取大鼠肝组织,冻存于-80 ℃备用。选取20对人肝癌组织及相应的癌旁组织,均来自在第二军医大学东方肝胆外科医院接受肝癌切除术的患者,所有患者均同意提供手术标本用于医学研究并签署知情同意书,本研究获得第二军医大学东方肝胆外科医院伦理委员会批准。
1.2 qPCR检测miR-544的表达利用TRIzol试剂(宝生物工程大连有限公司)抽取组织RNA,为增加miRNA提取量,抽提液加入等体积异丙醇后于-80 ℃沉淀30 min,85%乙醇洗涤。采用茎环法反转录获取cDNA,以U6为内参,运用SteponeTM实时荧光定量PCR仪(美国ABI公司)进行PCR扩增。反应条件为94 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 34 s,共进行40个循环;检测熔解曲线,计算miR-544的相对表达量。MiR-544正向引物:5′-ATT CTG CAT TTT TAG CAA GTT C-3′,反向引物:5′-GCG AGC ACA GAA TTA ATA CGA C-3′;U6正向引物:5′-CTC GCT TCG GCA GCA CA-3′,反向引物:5′-AAC GCT TCA CGA ATT TGC GT-3′。
1.3 肝癌细胞株的培养及转染miRNA mimic和inhibitor人肝癌细胞株Hep3B购自中国科学院细胞库,培养于含有10%胎牛血清(Gibco公司)和1%非必需氨基酸(Gibco公司)的MEM培养液(Gibco公司)中,置于37 ℃含5% CO2的培养箱中培养。取对数生长期的肝癌细胞,利用LipofectamineTM2000(美国Invitrogen公司)进行转染,转染剂量及方法按试剂盒说明书进行。实验设置4组,分别转染miR-544 mimic(5′-AUU CUG CAU UUU UAG CAA GUU C-3′)、NC mimic(5′-UUC UCC GAA CGU GUC ACG UTT-3′)、miR-544 inhibitor(5′-GAA CUU GCU AAA AAU GCA GAA U-3′)、NC inhibitor(5′-CAG UAC UUU UGU GUA GUA CAA-3′),均购自上海吉玛公司。
1.4 细胞增殖能力的测定与平板克隆形成实验Hep3B细胞转染24 h后,消化、计数,以3 000/孔或3 000/皿的密度分别接种于96孔板或10 cm细胞皿中,接种当天记为第0天。接种于96孔板者运用CCK8法(CCK8试剂盒购自日本株式会社同仁化学研究所)检测细胞增殖能力,用酶标仪测定其在450 nm波长处的光密度(D)值,绘制生长曲线;接种于10 cm细胞皿者定期更换培养液,2周后去除培养液,染色后观察克隆形成情况。每组设2个复孔,实验重复2次。
1.5 流式细胞仪检测细胞凋亡情况Hep3B细胞转染miR-544 mimic或NC mimic 48、72 h后,收集培养液上清和贴壁细胞(胰酶消化),用0.1% Triton X-100和20 μg/mL RNase A常温处理1 h,再加入50 μg/mL PI避光常温孵育30 min,流式细胞仪检测、记录并分析结果。每组实验设2个复孔,重复2次。
1.6 肝癌细胞成球培养取Hep3B细胞种植于低吸附性细胞培养皿中,使用含以下配方的培养液进行培养:10 g/mL EGF、1 μg/mL FGF、1×B27、1×ITS、1×L-Glutamine溶于DMEM-F12培养液(Gibco)中,终体积50 mL。每10 cm培养皿种植细胞数为40 000。此后每日观察,3 d左右镜下可见球体形成,此后定期传代,收取第0代(普通Hep3B细胞)、第3代和第8代球体的RNA,检测miR-544的表达。Hep3B细胞分别转染miR-544 mimic和NC mimic,转染后利用成球培养体系进行培养,观察细胞成球能力的变化,收集两组球体行CCK-8法检测数量差异。
1.7 统计学处理采用SPSS 18.0软件分析数据。数据以x±s表示。两组间方差齐性则采用双尾Student T检验进行比较,方差非齐性则采用非参数秩和检验Mann-Whitney U检验。检验水准(α)为0.05。
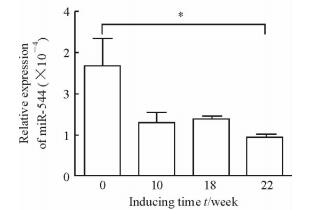
2 结果 2.1 MiR-544在DEN造模大鼠肝组织和人肝癌组织中表达下调在DEN诱导的大鼠原发性肝癌模型肝组织中,DEN处理后10周时miR-544的表达开始下降,至22周时与0周时相比差异有统计学意义(P<0.05,图 1)。在人肝癌组织中miR-544的表达也低于癌旁组织(P<0.01,图 2A),20对人肝癌和癌旁组织中有17对(85%)miR-544的表达显著下调(图 2B)。
|
图 1 MiR-544在DEN诱导的大鼠原发性肝癌模型肝组织中的表达 Fig 1 Expression of miR-544 in liver tissues of DEN-treated rats DEN: Diethylinitrosamine. *P < 0.05. n=4, x±s |

|
图 2 MiR-544在人肝癌组织及癌旁组织中的表达 Fig 2 Expression of miR-544 in HCC tissues and adjacent non-tumor tissues from HCC patients A: MiR-544 was repressed in the HCC tissues compared with the adjacent non-tumor tissues; B: Expression of miR-544 was significantly decreased in 17 of 20 pairs of HCC and adjacent tissues. N: Adjacent non-tumor tissues; T: HCC tissues. HCC: Hepatocellular carcinoma. **P < 0.01. n=20, x±s |
2.2 MiR-544抑制肝癌细胞增殖及克隆形成能力、促进细胞凋亡
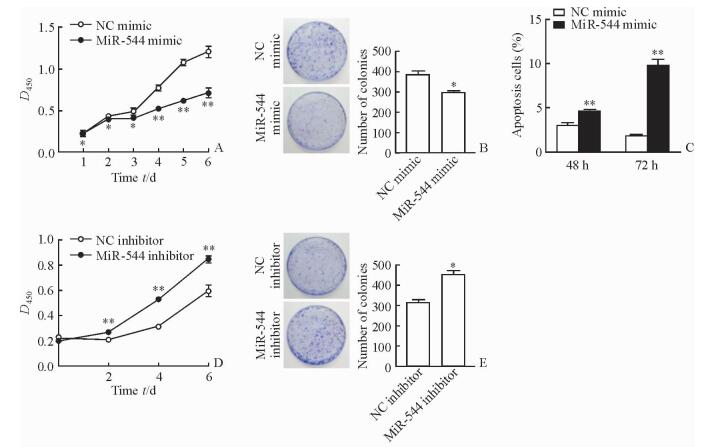
过表达miR-544后,Hep3B细胞的增殖能力较对照NC组下降(P<0.05,P<0.01;图 3A),平板克隆形成能力受到抑制(P<0.05,图 3B)。流式细胞检测结果可见,Hep3B细胞转染miR-544 mimic后48、72 h时的细胞凋亡率均较对照NC组上调,且该效应具有时间依赖性(P<0.01,图 3C)。而利用miR-544 inhibitor抑制miR-544的作用后,Hep3B细胞的增殖能力(P<0.01,图 3D)和平板克隆形成能力(P<0.05,图 3E)均较对照NC组增强。
|
图 3 MiR-544对Hep3B细胞的增殖能力、平板克隆形成能力及凋亡的影响 Fig 3 Effect of miR-544 on proliferation, colony-formation potential and apoptosis of Hep3B cells A: Overexpression of miR-544 significantly suppressed proliferation of hepatocellular carcinoma (HCC) cells; B: Overexpression of miR-544 significantly suppressed colony-formation potential of HCC cells; C: Overexpression of miR-544 promoted apoptosis of HCC cells; D: Inhibition of miR-544 enhanced the proliferation of HCC cells; E: Inhibition of miR-544 enhanced colony-formation potential of HCC cells. *P < 0.05, **P < 0.01 vs NC group. n=4, x±s |
2.3 MiR-544对肝癌细胞成球能力的影响
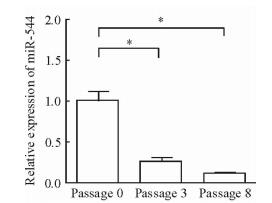
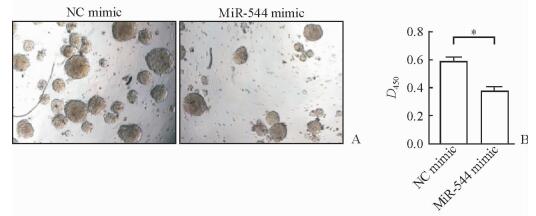
成球培养富集Hep3B细胞的肝癌干细胞,qPCR检测不同培养代数的球体中miR-544的表达,结果显示随着肿瘤干细胞的富集,肝癌细胞中miR-544的表达下降(P<0.05,图 4)。过表达miR-544后,Hep3B细胞的成球数量低于对照NC组(P<0.05,图 5A),收集球体后CCK-8检测结果显示,miR-544过表达组干细胞球中的细胞数量少于对照NC组(P<0.05,图 5B)。
|
图 4 MiR-544在富集肿瘤干细胞的干细胞球中的表达 Fig 4 Expression of miR-544 in sphere-forming Hep3B cells *P < 0.05. n=4, x±s |
|
图 5 MiR-544抑制肝癌细胞形成干细胞球的能力 Fig 5 MiR-544 inhibited the sphere formation of HCC cells A: Sphere from Hep3B cells transfected with NC (left) and miR-544 mimic (right); B: CCK-8 analysis of the number of spheres from Hep3B cells transfected with NC and miR-544 mimic. Original magnification: ×40 (A). *P < 0.05. n=4, x±s |
3 讨论
MiRNA在肝癌发生、发展过程中的作用已成为研究热点,诸多研究表明miRNA可能是肝癌诊治的新靶点[19]。既往研究发现多个位于DLK1-DIO3区的miRNA可抑制肝癌的发生、发展,其中miR-370通过抑制肿瘤细胞干性相关的RNA结合蛋白LIN28A阻遏p65(RelA)蛋白的表达,抑制肝癌细胞的增殖和转移[20];miR-134通过负调控癌基因KRAS抑制肝癌细胞的恶性表型[11]。其他研究也显示在人肝癌组织中表达增加的miRNA可能对肝癌具有促进作用,Xie等[21]研究发现人肝癌组织中高表达的miR-155可通过靶向SOX6促进肝癌细胞的增殖,抑制其表达可作为肝癌治疗的重要靶点。此外,miR-424等多个miRNA在肝癌组织中的表达水平与患者生存率显著相关,为肝癌诊断及判断预后提供了重要标志物[22]。还有研究发现可以通过检测血清或肿瘤组织中miR-34a的表达水平预测肝癌骨转移情况[23]。这些研究表明miRNA在肝癌的临床诊治及预后评估等方面均可能发挥重要作用,应用前景广阔。
MiR-544是位于DLK1-DIO3印记基因区的miRNA,是miR-379-656簇的重要成员[24]。既往研究表明该印记基因区上的许多miRNA均与肿瘤密切相关[25],目前关于miR-544的研究亦主要报道了其在恶性肿瘤中的作用。有研究报道miR-544在恶性胶质母细胞瘤组织中的表达降低,可能为胶质瘤恶性转化的标志物[12],而另一研究发现上调miR-544的表达可通过抑制帕金森蛋白7而抑制神经胶质瘤细胞的增殖、侵袭、迁移,并促进其凋亡[13]。还有研究发现miR-544在骨肉瘤中的表达显著降低,并可与DLK1-DIO3区域中的其他miRNA共同抑制cMYC的表达,从而促进骨肉瘤细胞的凋亡[14]。Mao等[15]研究发现miR-544在宫颈癌组织中的表达较癌旁组织下调,Krueppel因子4可作用于其启动子区域上调其表达,进而靶向抑制癌基因YWHAZ,从而抑制肿瘤。Haga等[16]研究发现,在缺氧应激条件下,抑制miR-544的作用可以选择性诱导三阴性乳腺癌细胞的凋亡,增加乳腺癌细胞对化疗药物5-氟尿嘧啶的敏感性,并抑制乳腺癌细胞在小鼠体内的增殖。亦有研究显示miR-544在鼻咽癌组织中表达上调[17]。还有研究表明上调miR-544的表达可促进胃癌细胞的增殖,miR-544靶向调控抑癌基因IRX1从而促进胃癌的发生[18]。以上研究均提示miR-544在肿瘤的发生、发展过程中具有重要作用,但对于其在肝癌中的表达和作用未见报道。
本研究发现在DEN诱导的大鼠原发性肝癌模型肝组织及人肝癌组织中,miR-544的表达均下调,提示其可能在肝癌中发挥抑癌作用。研究进一步利用体外上调(gain-of-function)和抑制(loss-of-function)实验证实miR-544可抑制肝癌细胞的增殖、克隆形成能力,促进肝癌细胞凋亡。同时,在成球培养富集肿瘤干细胞的过程中,miR-544的表达逐渐下调,过表达miR-544可抑制肝癌细胞的成球能力,提示miR-544可能抑制了肿瘤干细胞的自我更新,从而抑制肝癌的进展。既往关于miR-544在恶性肿瘤中的作用仍有争议,有研究认为它是抑癌miRNA[12-15],另有研究则认为它发挥了促肿瘤作用[16-18],这可能与其作用于不同的靶基因有关,本研究证实miR-544发挥了抑制肝癌的作用,但其在肝癌细胞中的靶基因尚不明确,需要进一步研究。
| [1] | SHERMAN M. Surveillance for hepatocellular carcinoma[J]. Best Pract Res Clin Gastroenterol, 2014, 28: 783–793. DOI: 10.1016/j.bpg.2014.08.008 |
| [2] | 许文萍, 谢渭芬. 原发性肝癌的治疗[J]. 中华消化杂志, 2009, 9: 578–581. DOI: 10.3760/cma.j.issn.0254-1432.2009.09.022 |
| [3] | LAFARO K J, DEMIRJIAN A N, PAWLIK T M. Epidemiology of hepatocellular carcinoma[J]. Surg Oncol Clin N Am, 2015, 24: 1–17. DOI: 10.1016/j.soc.2014.09.001 |
| [4] | PARVIZ F, MATULLO C, GARRISON W D, SAVATSKI L, ADAMSON J W, NING G, et al. Hepatocyte nuclear factor 4alpha controls the development of a hepatic epithelium and liver morphogenesis[J]. Nat Genet, 2003, 34: 292–296. DOI: 10.1038/ng1175 |
| [5] | BATTLE M A, KONOPKA G, PARVIZ F, GAGGL A L, YANG C, SLADEK F M, et al. Hepatocyte nuclear factor 4alpha orchestrates expression of cell adhesion proteins during the epithelial transformation of the developing liver[J]. Proc Natl Acad Sci USA, 2006, 103: 8419–8424. DOI: 10.1073/pnas.0600246103 |
| [6] | SANTANGELO L, MARCHETTI A, CICCHINI C, CONIGLIARO A, CONTI B, MANCONE C, et al. The stable repression of mesenchymal program is required for hepatocyte identity:a novel role for hepatocyte nuclear factor 4alpha[J]. Hepatology, 2011, 53: 2063–2074. DOI: 10.1002/hep.24280 |
| [7] | WALESKY C, EDWARDS G, BORUDE P, GUNEWARDENA S, O'NEIL M, YOO B, et al. Hepatocyte nuclear factor 4alpha deletion promotes diethylnitrosamine-induced hepatocellular carcinoma in rodents[J]. Hepatology, 2013, 57: 2480–2490. DOI: 10.1002/hep.26251 |
| [8] | ZENG X, LIN Y, YIN C, ZHANG X, NING B F, ZHANG Q, et al. Recombinant adenovirus carrying the hepatocyte nuclear factor-1alpha gene inhibits hepatocellular carcinoma xenograft growth in mice[J]. Hepatology, 2011, 54: 2036–2047. DOI: 10.1002/hep.24647 |
| [9] | YIN C, LIN Y, ZHANG X, CHEN Y X, ZENG X, YUE H Y, et al. Differentiation therapy of hepatocellular carcinoma in mice with recombinant adenovirus carrying hepatocyte nuclear factor-4alpha gene[J]. Hepatology, 2008, 48: 1528–1539. DOI: 10.1002/hep.22510 |
| [10] | NING B F, DING J, YIN C, ZHONG W, WU K, ZENG X, et al. Hepatocyte nuclear factor 4 alpha suppresses the development of hepatocellular carcinoma[J]. Cancer Res, 2010, 70: 7640–7651. DOI: 10.1158/0008-5472.CAN-10-0824 |
| [11] | YIN C, WANG P Q, XU W P, YANG Y, ZHANG Q, NING B F, et al. Hepatocyte nuclear factor-4α reverses malignancy of hepatocellular carcinoma through regulating miR-134 in the DLK1-DIO3 region[J]. Hepatology, 2013, 58: 1964–1976. DOI: 10.1002/hep.26573 |
| [12] | MA R, ZHANG G, WANG H, LV H, FANG F, KANG X. Downregulation of miR-544 in tissue, but not in serum, is a novel biomarker of malignant transformation in glioma[J]. Oncol Lett, 2012, 4: 1321–1324. |
| [13] | JIN S G, DAI Y, LI C, FANG X, HAN H J, WANG D X. MicroRNA-544 inhibits glioma proliferation, invasion and migration but induces cell apoptosis by targeting PARK7[J]. Am J Transl Res, 2016, 8: 1826–1837. |
| [14] | THAYANITHY V, SARVER A L, KARTHA R V, LI L, ANGSTADT A Y, BREEN M, et al. Perturbation of 14q32 miRNAs-cMYC gene network in osteosarcoma[J]. Bone, 2012, 50: 171–181. DOI: 10.1016/j.bone.2011.10.012 |
| [15] | MAO L, ZHANG Y, DENG X, MO W, YU Y, LU H. Transcription factor KLF4 regulates microRNA-544 that targets YWHAZ in cervical cancer[J]. Am J Cancer Res, 2015, 5: 1939–1953. |
| [16] | HAGA C L, VELAGAPUDI S P, STRIVELLI J R, YANG W Y, DISNEY M D, PHINNEY D G. Small molecule inhibition of miR-544 biogenesis disrupts adaptive responses to hypoxia by modulating ATM-mTOR signaling[J]. ACS Chem Biol, 2015, 10: 2267–2276. DOI: 10.1021/acschembio.5b00265 |
| [17] | LUO Z, ZHANG L, LI Z, LI X, LI G, YU H, et al. An in silico analysis of dynamic changes in microRNA expression profiles in stepwise development of nasopharyngeal carcinoma[J]. BMC Med Genomics, 2012, 5: 3. DOI: 10.1186/1755-8794-5-3 |
| [18] | ZHI Q, GUO X, GUO L, ZHANG R, JIANG J, JI J, et al. Oncogenic miR-544 is an important molecular target in gastric cancer[J]. Anticancer Agents Med Chem, 2013, 13: 270–275. DOI: 10.2174/1871520611313020013 |
| [19] | YANG N, EKANEM N R, SAKYI C A, RAY S D. Hepatocellular carcinoma and microRNA:new perspectives on therapeutics and diagnostics[J]. Adv Drug Deliv Rev, 2015, 81: 62–74. DOI: 10.1016/j.addr.2014.10.029 |
| [20] | XU W P, YI M, LI Q Q, ZHOU W P, CONG W M, YANG Y, et al. Perturbation of microRNA-370/Lin-28 homolog A/nuclear factor kappa B regulatory circuit contributes to the development of hepatocellular carcinoma[J]. Hepatology, 2013, 58: 1977–1991. DOI: 10.1002/hep.26541 |
| [21] | XIE Q, CHEN X, LU F, ZHANG T, HAO M, WANG Y, et al. Aberrant expression of microRNA 155 may accelerate cell proliferation by targeting sex-determining region Y box 6 in hepatocellular carcinoma[J]. Cancer, 2012, 18: 2431–2442. |
| [22] | LU M, KONG X, WANG H, HUANG G, YE C, HE Z. A novel microRNAs expression signature for hepatocellular carcinoma diagnosis and prognosis[J]. Oncotarget, 2017, 8: 8775–8784. |
| [23] | XIANG Z L, ZHAO X M, ZHANG L, YANG P, FAN J, TANG Z Y, et al. MicroRNA-34a expression levels in serum and intratumoral tissue can predict bone metastasis in patients with hepatocellular carcinoma[J]. Oncotarget, 2016, 7: 87246–87256. |
| [24] | KIRCHER M, BOCK C, PAULSEN M. Structural conservation versus functional divergence of maternally expressed microRNAs in the Dlk1/Gtl2 imprinting region[J]. BMC Genomics, 2008, 9: 346. DOI: 10.1186/1471-2164-9-346 |
| [25] | BENETATOS L, HATZIMICHAEL E, LONDIN E, VARTHOLOMATOS G, LOHER P, RIGOUTSOS I, et al. The microRNAs within the DLK1-DIO3 genomic region:involvement in disease pathogenesis[J]. Cell Mol Life Sci, 2013, 70: 795–814. DOI: 10.1007/s00018-012-1080-8 |
 2017, Vol. 38
2017, Vol. 38


