2. 中国科学院上海药物研究所药物发现与设计中心, 上海 201203;
3. 第二军医大学长征医院消化内科, 上海 200003
2. Drug Discovery and Design Center, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Department of Gastroenterology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
肝细胞核因子4α(hepatocyte nuclear factor 4α,HNF4α)是肝细胞核因子家族的重要成员,为核受体型转录因子,因其可调控大量肝细胞特异基因的表达,通常被认为是肝脏分化和功能维持的主要调控者[1]。既往研究表明,上调HNF4α的表达可抑制肝脏纤维化并诱导肝癌细胞向成熟肝细胞分化,抑制其成瘤性[2-3]。其他研究还发现,HNF4α可抑制促有丝分裂基因的表达和c-Myc通路的激活,并促进抑癌基因p21的表达[4-5],具有显著的抑癌作用。因此,探索调控HNF4α活性的小分子化合物在肝纤维化和肝癌的治疗中具有潜在的应用价值。
HNF4α具有保守的DNA结合结构域和配体结合结构域[6-7],是肝脏中含量最丰富的转录因子,肝细胞中转录活化的基因约40%含有HNF4α反应元件(HNF4α response element,HNF4α-RE)[8]。Chandra等[9]发现,HNF4α以同源二聚体形式与其DNA反应元件和共激活因子衍生肽结合形成特殊四级结构,小分子变构调节剂可通过影响该四级结构调节HNF4α的功能。为筛选可调控HNF4α活性的小分子化合物,本研究选取HNF4α下游靶基因Ninjurin 1(NINJ1) 启动子区的HNF4α反应元件(NINJ1-p)[10],构建了含有多个拷贝NINJ1-p片段的荧光素酶报告基因载体,并在此基础上建立了一个HNF4α活性检测系统,为发现用于治疗慢性肝病的小分子药物提供工具。
1 材料和方法 1.1 主要材料及试剂含有3个拷贝和9个拷贝NINJ1-p片段(5′-CAG GAA AAC CTA AGG TCA GGG AG-3′)的NINJ1-3p和PUC-NINJ1-9p质粒委托生工生物(上海)股份有限公司合成,载体构建相关试剂购自TaKaRa公司。双荧光素酶报告基因检测试剂盒购自Promega公司。
人肝癌细胞株Huh7、Hep3B、PLC和HepG2由第二军医大学长征医院消化内科实验室保存,用含有10%胎牛血清的DMEM培养液于37 ℃、5% CO2细胞培养箱中培养,细胞培养相关试剂购自Thermo公司。实验所用HNF4α腺病毒Ad-HNF4α及对照病毒Ad-GFP由第二军医大学长征医院消化内科实验室构建。转染试剂Lipofectamine 2000购自Invitrogen公司。PCR引物由华大基因合成。
木犀草素(luteolin)和阿尔维林(alvernine)购于上海陶素生化科技有限公司。Protein Thermal ShiftTM Dye Kit购于Sigma公司,96孔板购于帝恩生物科技有限公司。HisTrap FF(5 mL)、Superdex 75(10/30) 购于GE Healthcare公司。
1.2 HNF4α蛋白纯化原核蛋白的表达方法参考第二军医大学长征医院消化内科实验室前期工作[11],HNF4α蛋白的相对分子质量约为54 000。分别取0.1、0.2、0.4 μg HNF4α蛋白行聚丙烯酰胺凝胶电泳,考马斯亮蓝R250染色过夜,确定其纯度达90%以上后用于蛋白热迁移实验(protein thermal shift),在体外确证HNF4α与DNA片段、小分子化合物是否存在直接相互作用。
1.3 蛋白热迁移实验取稀释至不同终浓度的HNF4α蛋白(0、1.25、2.5、5、10、20 μmol/L)与SYPRO Orange(2×、5×、10×、20×)加于96孔PCR板中,反应体积为20 μL。置于7500 Fast RT-PCR System(ABI)仪器上,设置反应程序为25 ℃保温1 min,再以0.05 ℃/s的升温速率从25 ℃逐渐升至95 ℃,95 ℃保温15 s,在此过程中每隔20 s记录1次荧光信号。所有条件均设3个复孔,在不同条件下检测得到HNF4α蛋白质的熔解温度(Tm)。通过上述正交实验,最终选择5 μmol/L HNF4α蛋白和10×SYPRO Orange行HNF4α与DNA、待检测小分子的相互作用确证实验。
1.4 荧光素酶报告基因质粒的构建合成含有KpnⅠ和BglⅡ双酶切位点的大小为81 bp的NINJ1-3p片段,或利用KpnⅠ和BglⅡ对pUC-NINJ1-9p质粒进行分步双酶切得到大小为219 bp的NINJ1-9p片段,将NINJ1-3p片段和NINJ1-9p片段分别插入同样用KpnⅠ和BglⅡ双酶切的pGL3-promoter空载质粒中,测序成功的重组质粒命名为pGL3-NINJ1-3p和pGL3-NINJ1-9p,用于荧光素酶报告基因法检测细胞中HNF4α的活性。
1.5 双荧光素酶报告基因实验肝癌细胞Huh7、Hep3B、PLC、HepG2感染腺病毒Ad-HNF4α或Ad-GFP过夜后,分别转染pGL3-NINJ1-3p、pGL3-NINJ1-9p和对照质粒pGL3-promoter,共转染pRL-SV40为内参,转染48 h后检测相对荧光素酶活性。
人肝癌细胞株HepG2共转染pGL3-NINJ1-9p和pRL-SV40,6~8 h后更换为终浓度为20 μmol/L的木犀草素或阿尔维林培液(DMEM+2%胎牛血清),以二甲基亚砜(DMSO)处理为对照,处理24 h后,使用Dual-Luciferase® Reporter Assay System试剂盒检测细胞内的相对荧光素酶活性
1.6 qPCR检测HNF4α及下游基因的表达按照RNAiso Plus(TaKaRa)抽提法,分别抽提20 μmol/L木犀草素或阿尔维林处理24 h的HepG2细胞总RNA。使用反转录试剂盒(TaKaRa)将抽提RNA反转录为cDNA。设计PCR引物(表 1),以β-actin为内参,检测HNF4α及其下游基因载脂蛋白C (apolipoprotein C Ⅲ,APOCⅢ)、对羟基苯丙酮酸双氧化酶(4-hydroxyphenylpyruvate dioxygenase,HPD)和转甲状腺蛋白(transthyretin,TTR)的表达。
|
|
表 1 各基因的qPCR引物 Tab 1 Primers for qPCR |
1.7 统计学处理
使用GraphPad Prism 6统计软件进行绘图与数据分析。所有数据均以x±s表示,组间比较采用配对t-test检验。检验水准(α)为0.05。
2 结果 2.1 HNF4α转录活性报告基因检测系统的构建与鉴定纯化获得纯度达90%以上的HNF4α蛋白(图 1A),可用于验证HNF4α蛋白与NINJ1-p DNA片段结合能力的蛋白热迁移实验。蛋白热迁移实验结果显示,NINJ1-p片段可在体外与HNF4α蛋白结合,且结合强度具有浓度依赖性, 当NINJ1-p片段浓度为25 μmol/L时迁移温度可达2.71 ℃(图 1B)。结果验证了NINJ1-p确实为HNF4α的DNA反应元件。
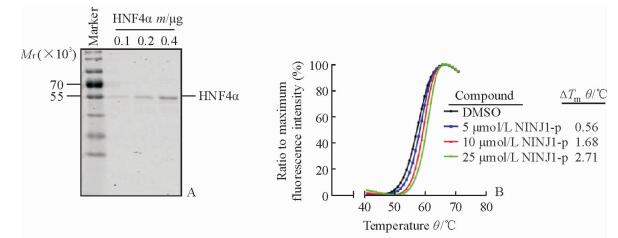
|
图 1 蛋白热迁移实验确定NINJ1-p片段与HNF4α的结合 Fig 1 Binding of NINJ1-p to HNF4α confirmed by thermal shift assay A: Eletrophoresis followed by Coomassie brilliant blue staining was used to verify the purity of HNF4α protein; B: Thermal shift assay of HNF4α. NINJ1: Ninjurin 1; HNF4α: Hepatocyte nuclear factor 4α; DMSO: Dimethyl sulfoxide |
为获得具有高灵敏度的检测细胞内HNF4α活性的报告基因系统,研究构建了报告基因载体pGL3-NINJ1-3p和pGL3-NINJ1-9p(图 2A)。双荧光素酶报告基因实验结果显示,HNF4α过表达时,转染pGL3-NINJ1-3p的HepG2细胞报告基因活性较转染pGL3-promoter的对照组提高到3.5倍(P<0.05),而转染pGL3-NINJ1-9p的细胞报告基因活性较对照组则提高到55倍(P<0.01,图 2B);同样的实验条件下,pGL3-NINJ1-9p转染Hep3B细胞的相对荧光素酶活性提高到85倍(P<0.01),而pGL3-NINJ1-3p组则提高到5倍(P<0.01,图 2C);在PLC和Huh7细胞中,pGL3-NINJ1-9p转染细胞的检测灵敏度也均高于pGL3-NINJ1-3p(P<0.01或P<0.05,图 2D、2E)。表明增加HNF4α反应元件的拷贝数可提高报告基因的检测灵敏度,因此选择pGL3-NINJ1-9p质粒作为检测HNF4α活性的报告基因质粒。

|
图 2 荧光素酶报告基因系统的构建与鉴定 Fig 2 Construction and identification of luciferase reporter gene system A: Schematic illustration of the luciferase reporter plasmid pGL3-NINJ1-9p; B-E: Luciferase reporter assay was performed in HepG2 (B), Hep3B (C), PLC (D) and Huh7 (E) cells transfected with pGL3-NINJ1-3p, pGL3-NINJ1-9p or pGL3-promoter, respectively. NINJ1: Ninjurin 1; HNF4α: Hepatocyte nuclear factor 4α; GFP: Green fluorescent protein. *P < 0.05, **P < 0.01. n=3, x±s |
2.2 木犀草素和阿尔维林与HNF4α的结合及对HNF4α下游基因的调控作用
蛋白热迁移实验结果显示,200 μmol/L的木犀草素可使HNF4α蛋白的Tm迁移达4.85 ℃(图 3A);而阿尔维林浓度为400 μmol/L时,Tm正向迁移1.97 ℃(图 3B),表明木犀草素和阿尔维林均可与HNF4α蛋白直接结合。进一步检测木犀草素和阿尔维林对HNF4α及其下游基因表达的影响,将DMSO处理的对照组的值标准化为1,可见木犀草素处理细胞的HNF4α表达无明显变化,而其下游基因APOCⅢ、HPD、TTR的表达均下调(P<0.05或P<0.01;图 3C)。阿尔维林处理细胞后,HNF4α基因的表达较对照组差异无统计学意义,而APOCⅢ、HPD、TTR基因的表达均上调(P<0.05,图 3D),说明木犀草素和阿尔维林分别为HNF4α的抑制剂和激活剂。

|
图 3 木犀草素和阿尔维林与HNF4α的结合及对HNF4α下游基因的调控 Fig 3 Interaction of HNF4α with luteolin and alvernine and its regulation of HNF4α down-stream genes A: Thermal shift assay of HNF4α in cells treated by luteolin; B: Thermal shift assay of HNF4α in cells treated by alvernine; C, D: Expression of HNF4α target genes in HepG2 cells treated with luteolin (C) or alverine (D). The red line means standardizing the DMSO control group to 1. HNF4α: Hepatocyte nuclear factor 4α; APOCⅢ: Apolipoprotein C Ⅲ; HPD: 4-Hydroxyphenylpyruvate dioxygenase; TTR: Transthyretin; DMSO: Dimethyl sulphoxide. *P < 0.05, **P < 0.01 vs DMSO group. n=3, x±s |
2.3 HNF4α转录活性报告基因检测系统的小分子化合物验证
利用木犀草素和阿尔维林验证pGL3-NINJ1-9p是否可检测到小分子化合物对HNF4α转录活性的调控。结果显示,在利用腺病毒过表达HNF4α的HepG2细胞中转染pGL3-NINJ1-9p后,20 μmol/L木犀草素可使报告基因活性下降40%(P<0.05,图 4A);而20 μmol/L阿尔维林则可使细胞中报告基因的活性提高60%(P<0.05,图 4A)。此外,在HepG2细胞株中,DMSO、木犀草素和阿尔维林处理后,转染pGL3-NINJ1-9p的细胞报告基因活性较转染对照质粒的细胞升高(P<0.05,图 4B)。比较转染pGL3-NINJ1-9p的各组细胞报告基因活性发现,与对照组相比木犀草素处理组HNF4α的活性降低(P<0.05),而阿尔维林处理组HNF4α的活性升高(P<0.05,图 4B),表明报告基因载体pGL3-NINJ1-9p可灵敏地检测小分子化合物对HNF4α的活性影响。

|
图 4 利用HNF4α抑制剂和激活剂验证HNF4α活性检测系统 Fig 4 Validation of screen system of HNF4α activity by inhibitor and activator of HNF4α A: HepG2 cells with HNF4α overexpression were treated with 20 μmol/L luteolin or 20 μmol/L alverine for 24 h; B: HepG2 cells transfected with pGL3-promoter or pGL3-NINJ1-9p were treated with 20 μmol/L luteolin or 20 μmol/L alverine for 24 h. HNF4α: Hepatocyte nuclear factor 4α; DMSO: Dimethyl sulfoxide; NINJ1: Ninjurin 1. *P < 0.05. n=3, x±s |
3 讨论
HNF4α为高度保守的配体依赖型核受体蛋白[1],通过同源二聚体的形式与多种参与调控肝脏功能的下游靶基因启动子结合并发挥作用,包括脂质转运、葡萄糖代谢、脂肪酸代谢、尿素生成、蛋白合成等相关分子;近期大量研究显示,HNF4α在调控参与药物代谢基因的过程中也起到重要作用[12-16],表明HNF4α是维持肝脏功能的重要转录因子。同时,我们和其他研究者的工作也证实,在肝纤维化和肝癌中HNF4α的表达或活性下降[2-3],从而发现调控HNF4α活性的方法,为肝纤维化或肝癌治疗提供了新策略。
HNF4α早期因其无明确的配体而被认为是孤儿核受体(orphan nuclear receptor)。但Hertz等[17]研究表明,脂肪酸可作为配体与HNF4α结合,并认为脂肪酸对HNF4α的调控取决于脂肪酰基CoA硫酯的链长和配体的饱和程度,但这一发现缺乏具体的结构证据。Yuan等[18]利用亲和分离层析法证明亚油酸(linoleic acid)可作为HNF4α的内源性可逆结合配体,但对HNF4α的转录激活无明显作用。此外,有文献报道某些临床药物可调控HNF4α的活性,如Lee等[19]在筛选逆转脂肪酸棕榈酸酯对人胰岛素启动子活性抑制作用的化合物时,发现阿尔维林是HNF4α的潜在激活剂,但其影响HNF4α活性的机制及两者的结合情况均不明确。此外,有研究报道木犀草素可与HNF4α的配体结构域结合,是HNF4α的抑制剂[20],但这些药物在临床上存在难吸收和心脑血管不良反应等缺点。近年来,研究人员在利用胰岛细胞筛选人胰岛素启动子的调控效应物时,获得了调控HNF4α活性的异咪唑类化合物BI6015[21]等小分子化合物,虽然其对肝细胞的作用尚不明确,但这一利用HNF4α下游基因启动子筛选化合物的方法为我们构建肝细胞中调节HNF4α活性的小分子化合物提供了支持。NINJ1基因是Bolotin等[10]发现的HNF4α直接靶基因,其启动子序列同时满足以下3个条件:具有HNF4α结合位点(由PBM/SVM检索获得);在体内与HNF4α结合(ChIP分析证实);当HNF4α表达下调时其表达量也降低(RNA干扰实验证实)。他们的研究表明,其他HNF4α调控的下游基因大多只满足以上3个条件中的1~2个。因此利用NINJ1启动子序列建立的筛选系统能更直接反映肝细胞HNF4α的活性。
本研究通过报告基因实验比较了报告基因质粒pGL3-NINJ1-3p和pGL3-NINJ1-9p检测肝癌细胞内HNF4α活性的灵敏度,发现pGL3-NINJ1-9p相比pGL3-NINJ1-3p具有更高的检测灵敏度,表明HNF4α反应元件拷贝数的增加可提高报告基因系统的灵敏度。蛋白热迁移实验是筛选与蛋白发生直接结合的小分子的高通量技术,当蛋白被加热时,荧光染料SYPRO Orange可与蛋白结构中暴露的疏水域结合并产生荧光,进而获得蛋白的熔解温度(Tm)。若小分子能够结合蛋白并影响蛋白的热稳定性,则蛋白的Tm将会发生迁移,通过监测Tm的改变便可判断小分子在体外是否能与蛋白相互结合。本研究利用该技术进一步明确了木犀草素和阿尔维林与HNF4α蛋白的结合,同时发现pGL3-NINJ1-9p能灵敏地检测出木犀草素和阿尔维林处理后HepG2细胞中HNF4α的转录活性变化,表明pGL3-NINJ1-9p可用于通过高通量筛选所获得的小分子化合物对HNF4α转录活性影响的复筛研究。此外,pGL3-NINJ1-9p可灵敏检测出HNF4α表达量的改变,表明该系统还可用于筛选调控HNF4α表达的小分子化合物。
综上,本研究建立了一种基于报告基因系统检测小分子化合物调控HNF4α转录活性的实验方法,有望用于筛选调控HNF4α表达或转录活性的小分子化合物,为基于调控HNF4α活性的肝纤维化和肝癌治疗候选药物的筛选提供有效工具。
| [1] | WALESKY C, APTE U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer[J]. Gene Expr, 2015, 16: 101–108. DOI: 10.3727/105221615X14181438356292 |
| [2] | YIN C, LIN Y, ZHANG X, CHEN Y X, ZENG X, YUE H Y, et al. Differentiation therapy of hepatocellular carcinoma in mice with recombinant adenovirus carrying hepatocyte nuclear factor-4α gene[J]. Hepatology, 2008, 48: 11–21. |
| [3] | YUE H Y, YIN C, HOU J L, ZENG X, CHEN Y X, ZHONG W, et al. Hepatocyte nuclear factor 4α attenuates hepatic fibrosis in rats[J]. Gut, 2010, 59: 236–246. DOI: 10.1136/gut.2008.174904 |
| [4] | HANSE E A, MASHEK D G, BECKER J R, SOLMONSON A D, MULLANY L K, MASHEK M T, et al. Cyclin D1 inhibits hepatic lipogenesis via repression of carbohydrate response element binding protein and hepatocyte nuclear factor 4α[J]. Cell Cycle, 2012, 11: 2681–2690. DOI: 10.4161/cc.21019 |
| [5] | CHIBA H, ITOH T, SATOHISA S, SAKAI N, NOGUCHI H, OSANAI M, et al. Activation of p21CIP1/WAF1 gene expression and inhibition of cell proliferation by overexpression of hepatocyte nuclear factor-4alpha[J]. Exp Cell Res, 2005, 302: 11–21. DOI: 10.1016/j.yexcr.2004.08.014 |
| [6] | SLADEK F M, ZHONG W M, LAI E, DARNELL J E Jr. Liver-enriched transcription factor HNF-4 is a novel member of the steroid hormone receptor superfamily[J]. Genes Dev, 1990, 4(12B): 2353–2365. DOI: 10.1101/gad.4.12b.2353 |
| [7] | MANGELSDORF D J, EVANS R M. The RXR heterodimers and orphan receptors[J]. Cell, 1995, 83: 841–850. DOI: 10.1016/0092-8674(95)90200-7 |
| [8] | WALLERMAN O, MOTALLEBIPOUR M, ENROTH S, PATRA K, BYSANI M S, KOMOROWSKI J, et al. Molecular interactions between HNF4α, FOXA2 and GABP identified at regulatory DNA elements through ChIP-sequencing[J]. Nucleic Acids Res, 2009, 37: 7498–7508. DOI: 10.1093/nar/gkp823 |
| [9] | CHANDRA V, HUANG P, POTLURI N, WU D, KIM Y, RASTINEJAD F. Multidomain integration in the structure of the HNF-4α nuclear receptor complex[J]. Nature, 2013, 495: 394–398. DOI: 10.1038/nature11966 |
| [10] | BOLOTIN E, LIAO H, TA T C, YANG C, HWANG-VERSLUES W, EVANS J R, et al. Integrated approach for the identification of human hepatocyte nuclear factor 4α target genes using protein binding microarrays[J]. Hepatology, 2010, 51: 642–653. DOI: 10.1002/hep.23357 |
| [11] |
邓龙飞, 丁晨红, 谢渭芬, 张新. PEP-1介导的重组肝细胞核因子4α蛋白转导对肝癌细胞的抑制作用[J]. 第二军医大学学报, 2015, 36: 929–935.
DENG L F, DING C H, XIE W F, ZHANG X. Inhibitory effect of PEP-1-mediated recombinant hepatocyte nuclear factor 4 alpha transduction on hepatocellular carcinoma cells[J]. Acad J Sec Mil Med Univ, 2015, 36: 929–935. |
| [12] | HAYHURST G P, LEE Y H, LAMBERT G, WARD J M, GONZALEZ F J. Hepatocyte nuclear factor 4alpha (nuclear receptor 2A1) is essential for maintenance of hepatic gene expression and lipid homeostasis[J]. Mol Cell Biol, 2001, 21: 1393–1403. DOI: 10.1128/MCB.21.4.1393-1403.2001 |
| [13] | BARRY W E, THUMMEL C S. The Drosophila HNF4 nuclear receptor promotes glucose-stimulated insulin secretion and mitochondrial function in adults[J]. Elife, 2016, 5: e11183. DOI: 10.7554/eLife.11183 |
| [14] | INOUE Y, PETERS L L, YIM S H, INOUE J, GONZALEZ F J. Role of hepatocyte nuclear factor 4alpha in control of blood coagulation factor gene expression[J]. J Mol Med, 2006, 84: 334–344. DOI: 10.1007/s00109-005-0013-5 |
| [15] | DESAI S S, TUNG J C, ZHOU V X, GRENERT J P, MALATO Y, REZVANI M, et al. Physiological ranges of matrix rigidity modulate primary mouse hepatocyte function in part through hepatocyte nuclear factor 4 alpha[J]. Hepatology, 2016, 64: 261–275. DOI: 10.1002/hep.v64.1 |
| [16] | TRACY T S, CHAUDHRY A S, PRASAD B, THUMMEL K E, SCHUETZ E G, ZHONG X B, et al. Interindividual variability in cytochrome P450-mediated drug metabolism[J]. Drug Metab Dispos, 2016, 44: 343–351. DOI: 10.1124/dmd.115.067900 |
| [17] | HERTZ R, MAGENHEIM J, BERMAN I, BAR-TANA J. Fatty acyl-CoA thioesters are ligands of hepatic nuclear factor-4α[J]. Nature, 1998, 392: 512–516. DOI: 10.1038/33185 |
| [18] | YUAN X, TA T C, LIN M, EVANS J R, DONG Y, BOLOTIN E, et al. Identification of an endogenous ligand bound to a native orphan nuclear receptor[J]. PLoS One, 2009, 4: e5609. DOI: 10.1371/journal.pone.0005609 |
| [19] | LEE S H, ATHAVANKAR S, COHEN T, PIRAN R, KISELYUK A, LEVINE F. Identification of alverine and benfluorex as HNF4α activators[J]. ACS Chem Biol, 2013, 8: 1730–1736. DOI: 10.1021/cb4000986 |
| [20] | LI J, INOUE J, CHOI J M, NAKAMURA S, YAN Z, FUSHINOBU S, et al. Identification of the flavonoid luteolin as a repressor of the transcription factor hepatocyte nuclear factor 4α[J]. J Biol Chem, 2015, 290: 24021–24035. DOI: 10.1074/jbc.M115.645200 |
| [21] | KISELYUK A, LEE S H, FARBER-KATZ S, ZHANG M, ATHAVANKAR S, COHEN T, et al. HNF4α antagonists discovered by a high-throughput screen for modulators of the human insulin promoter[J]. Chem Biol, 2012, 19: 806–818. DOI: 10.1016/j.chembiol.2012.05.014 |
 2017, Vol. 38
2017, Vol. 38


