2. 同济大学附属第一妇婴保健院药剂科, 上海 201204;
3. 第二军医大学长海医院神经内科, 上海 200433;
4. 第二军医大学长海医院药材科, 上海 200433
2. Department of Pharmacy, First Maternity and Infant Hospital Affliated to Tongji University, Shanghai 201204, China;
3. Department of Neurology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
4. Department of Pharmacy, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
多巴胺(DA)、去甲肾上腺素(NE)和5-羟色胺(5-HT)是中枢神经调节系统中最重要的神经递质,它们在维持、调节神经系统和各器官的功能中发挥着重要作用[1-4]。研究发现,一些重要的疾病与神经递质含量的变化关系密切,如帕金森病是一种神经退行性疾病,与脑内DA含量的变化密切相关[5-7]。血管性抑郁是老年迟发性抑郁症的一种主要类型,与脑血管疾病及其危险因素相关[8]。近年研究显示一些炎症细胞因子可导致5-HT含量下降、色氨酸代谢物的毒性增加,并促使海马神经元坏死和凋亡,导致了抑郁症的发生和认知功能障碍[9-10]。因此有必要建立一种灵敏的单胺类神经递质含量测定方法,用于体液中单胺类神经递质的含量测定和疾病诊断。
高效液相色谱(HPLC)、气相色谱(GC)和毛细管电泳(CE)均可用于生物样品中神经递质的检测。其中HPLC仪器较为常见,且可以搭配紫外(UV)、荧光(FLD)、质谱(MS)以及电化学(ECD)等不同的检测器进行检测。然而这些检测器都有其局限性和缺点,其中UV检测器不够灵敏;ECD受流动相的组成限制,且缺乏重现性;MS分析生物样品时,干扰峰常常发生在低质荷比区域,导致灵敏度和特异性较差。因此,对生物样品中的神经递质进行准确测定仍面临着很多挑战。
本研究拟分别采用UV、FLD和MS检测器建立小鼠不同脑组织中单胺类神经递质DA、NE和5-HT的含量测定方法,并进行方法比较,然后将最优方法应用于血管性抑郁小鼠不同脑组织中单胺类神经递质的含量测定。
1 材料和方法 1.1 药品与试剂DA、NE、5-HT和吡嗪酰胺(纯度均>98%;美国Sigma-Aldrich公司)。甲醇、乙腈(色谱纯;美国Honeywell公司);甲酸、乙酸(色谱纯;美国Tedia公司);生理盐水、醋酸钠、乙二胺四乙酸二钠(EDTA-2Na)及高氯酸(国药集团化学试剂有限公司);纯水采用Milli-Q系统制备(美国Millipore公司)。
1.2 仪器与检测条件采用Agilent 1100系列高效液相色谱系统(美国Agilent公司)行色谱分析,包括二元泵、在线脱气机、自动进样系统和柱温箱。色谱柱为Agilent ZORBAX SB-C18色谱柱,柱温30 ℃,UV检测波长为254 nm,流动相为水(含0.1%甲酸):甲醇(93:7, V/V),流速为1.0 mL/min,进样量为20 μL。FLD检测器(Agilent 1260系列荧光检测器)发射波长为290 nm、激发波长为330 nm,流动相为乙酸溶液(pH 5.1,含有0.1 mmol/L乙酸钠及0.01 mmol/L EDTA-2Na):甲醇(93:7, V/V),流速为1.0 mL/min,进样量为20 μL。MS检测器(Agilent 1100系列质谱检测器)采用ESI源、SIM检测方法、正离子检测模式,毛细管电压为3.5 kV,雾化气压力为35 psig(241.3 kPa),干燥气体流速为9 L/min,气体温度为350 ℃。DA、NE和5-HT的检测离子为m/z 154、170和177,流速为0.8 mL/min,进样量为2 μL。
1.3 标准溶液与质控样品的制备分别称取适量DA、NE和5-HT于离心管中,加入2%高氯酸溶液,制得浓度分别为1.035、1.075和0.936 mg/mL的溶液。称取适量吡嗪酰胺于1.5 mL离心管中,加入甲醇,配制浓度为2.238 mg/mL的溶液。用2%高氯酸溶液对上述溶液进行逐级稀释,配制一系列标准曲线溶液用于含量测定;其中分别为UV法(DA:103.5~4 140 ng/mL, NE:107.5~4 300 ng/mL,5-HT:93.6~3 740 ng/mL)、FLD法(DA:10.35~414 ng/mL, NE:10.75~430 ng/mL,5-HT:9.36~374 ng/mL)、MS法(DA:10.35~414 ng/mL, NE:32.25~1 290 ng/mL,5-HT:9.36~374 ng/mL,内标吡嗪酰胺浓度为22.38 ng/mL)。采用上述相同方法分别制备质控样品溶液。
1.4 实验动物分组及血管性抑郁模型构建20只CD1雄性小鼠,体质量25~30 g,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2007-0005]。小鼠随机分为实验组(n=10) 和假手术组(n=10),常规饲养1周。实验组小鼠根据文献[9]的方法构建血管性抑郁模型,小鼠经腹腔注射3%水合氯醛(0.1 mL/10 g小鼠体质量),麻醉成功后,取仰卧位,门齿及四肢固定,剪开颈前皮肤及筋膜,在气管两侧分别分离出左右颈动脉,使用小号动脉夹阻断双侧颈动脉供血5 min后,松开动脉夹恢复供血10 min,再次阻断供血5 min后移除动脉夹。假手术组除不阻断颈动脉供血外,其余手术操作与实验组相同。术后第8天通过悬尾实验、旷场实验进行小鼠抑郁行为检测[11-12],发现实验组小鼠较假手术组悬尾不动时间显著增长、旷场运动总路程短、中央区活动时间长,表明动物模型构建成功。
1.5 样品处理小鼠断头,将脑取出,使用冰冷的生理盐水溶液洗涤。分离海马、皮层及纹状体。组织称量并加入3倍体积的生理盐水,然后进行匀浆处理。取50 μL匀浆后的溶液加入到1.5 mL离心管中,然后加入100 μL 4%的高氯酸溶液,涡旋30 s,于4 ℃、9 600×g条件下离心10 min,取上清液进样分析。
1.6 方法学验证方法学验证主要包括线性、检测限(LOD)、定量限(LOQ)、重复性、回收率及稳定性。以待测化合物的峰面积与内标峰面积之比对应浓度绘制校正曲线图,采用最小二乘法计算线性回归方程的斜率、截距、相关系数。最低定量限(LLOQ)和最低检测限(LLOD)的确定方法为待测物信噪比的比例分别为10和3。将低、中、高3组质控样品在1 d内分别进样分析5次,计算日内准确度和精密度;将低、中、高3组质控样品在连续3 d内每天进样分析,计算日间准确度和精密度。提取回收率为含有已知各神经递质浓度的样品的峰面积除以空白匀浆样品经前处理后加入同等浓度的药物的峰面积的比值。基质效应为加入一定浓度药物的经前处理后的空白匀浆样品的峰面积除以相应浓度标准溶液的峰面积的比值。样品稳定性通过计算不同条件下3组质控样品进样峰面积的相对标准偏差(n=3) 所得,包括短期稳定性(室温放置6 h)、长期稳定性(-40 ℃放置30 d)、3次冻融循环(-40 ℃)。
1.7 统计学处理应用SPSS 20.0软件进行数据分析,以x±s表示,组间比较采用t检验。检验水准(α)为0.05。
2 结果和讨论 2.1 分析方法 2.1.1 色谱条件的考察单胺类神经递质的极性较强。如果采用水作为流动相进行洗脱,则它们在反相色谱柱上的保留比较弱,因此需要加入适量的有机溶剂进行洗脱。本研究在行UV检测时考察了不同比例的水和甲醇作为流动相(50:50、60:40、70:30、85:15、90:10、92:8、93:7、95:5),结果发现随着甲醇比例的增加,DA、NE、5-HT的保留时间均显著缩短,甚至出现峰重叠。故最终选择水(含有0.1%醋酸):甲醇(93:7,V/V)作为流动相。
2.1.2 小鼠脑组织中单胺类神经递质提取方法的考察研究分别考察了蛋白质沉淀法和液液萃取法对脑组织中3种单胺类神经递质的提取效率,结果表明,乙酸乙酯和正丁基醇两种试剂的提取效率和回收率较差,不能满足生物定量分析的要求。随后又考察了三氯乙酸和高氯酸作为蛋白质沉淀试剂的提取效率,结果表明高氯酸的提取回收率高于三氯乙酸,且随着高氯酸浓度的增加提取效率增加。故最终采用4%高氯酸用作蛋白质沉淀试剂提取脑组织中单胺类神经递质。
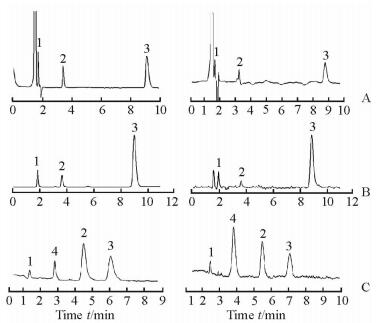
2.2 方法学验证 2.2.1 线性和检测限标准混合样品和脑组织样本的HPLC-UV、HPLC-FLD和HPLC-MS法检测的典型色谱如图 1所示,可见DA、NE、5-HT 3种成分在10 min内都可以实现明显分离。
|
图 1 标准混合样品(左侧)和脑组织样本(右侧)的HPLC-UV(A)、HPLC-FLD(B)和HPLC-MS(C)法检测的典型色谱 Fig 1 Representative chromatograms of standard mixture (left) and brain tissue sample (right) of neurotransmitters by HPLC-UV (A), HPLC-FLD (B) and HPLC-MS (C) 1: Dopamine; 2: Norepinephrine; 3: 5-Hydroxytryptamine; 4: Pyrazinamide. HPLC: High-performance liquid chromatography; UV: Ultraviolet; FLD: Fluorescence detector; MS: Mass spectrometry |
HPLC-UV、HPLC-FLD和HPLC-MS法测定DA、NE、5-HT 3种成分所得的线性方程如表 1所示,3种方法线性关系均良好(r>0.99),其中HPLC-FLD法最灵敏,而HPLC-UV法的检测限较低。
|
|
表 1 HPLC-UV、HPLC-FLD和HPLC-MS测定方法的线性、定量限及检测限 Tab 1 Linear range, limit of quantification and limit of detection of HPLC-UV, HPLC-FL and HPLC-MS |
2.2.2 准确度和精密度
日内和日间准确度及精密度如表 2所示,HPLC-UV和HPLC-FLD法具有较好的准确度和精密度,HPLC-MS法的准确度和精密度较差。3种方法中,HPLC-UV法的准确度和精密度最高,HPLC-FLD法次之,HPLC-MS法最差。
|
|
表 2 日内及日间精密度和准确度 Tab 2 Intra-day and inter-day precision and accuracy |
2.2.3 基质效应和提取回收率
待测成分的基质效应和提取回收率如表 3所示。HPLC-UV法的提取回收率最高,HPLC-FLD法次之,而HPLC-MS法的提取回收率最低。所有成分的提取回收率均超过85%,并且不同浓度之间无明显差异。待测成分的基质效应超过10%,无明显基质效应存在。
|
|
表 3 3种单胺类神经递质在小鼠脑组织中的提取回收率 Tab 3 Recoveries of three monoamine neurotransmitters in mice brain tissues |
2.2.4 稳定性
所有样品稳定性于85.0%~103.0%,不同条件下样品稳定性良好。
2.3 3种方法检测不同脑组织中单胺类神经递质含量的比较样品测定结果如表 4所示,不同脑组织中的DA、NE、5-HT含量都可以采用HPLC-FLD法进行检测。而HPLC-UV法和HPLC-MS法检测限较高,无法测定一些浓度较低的样品。结果表明,与HPLC-UV法和HPLC-MS法相比,HPLC-FLD法更适用于小鼠不同脑组织中单胺类神经递质的含量测定。
|
|
表 4 不同小鼠脑组织中单胺类神经递质含量测定结果 Tab 4 Contents of three monoamine neurotransmitters in different brain tissues of mice |
2.4 不同脑组织中单胺类神经递质的含量
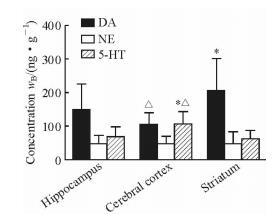
由于HPLC-FLD法具有较高的灵敏度,因此本实验采用HPLC-FLD法测定小鼠不同脑组织中单胺类神经递质的含量,结果如图 2所示。DA在纹状体组织中的含量高于海马组织和大脑皮层(P<0.05),而海马组织和大脑皮层间差异无统计学意义(P>0.05)。5-HT在大脑皮层中的含量高于海马组织和纹状体(P<0.05),而海马组织和纹状体间差异无统计学意义(P>0.05)。3种组织中NE的含量差异无统计学意义(P>0.05)。
|
图 2 HPLC-FLD法测定不同脑组织中单胺类神经递质的含量 Fig 2 Concentrations of three analytes in different brain tissues by HPLC-FLD HPLC: High-performance liquid chromatography; FLD: Fluorescence detector; DA: Dopamine; NE: Norepinephrine; 5-HT: 5-Hydroxytryptamine. *P < 0.05 vs hippocampus; △P < 0.05 vs striatum. n=10, x±s |
2.5 各组小鼠海马组织中单胺类神经递质的含量
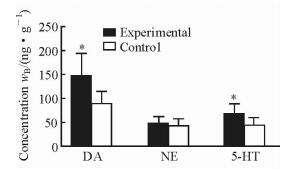
如图 3所示,与正常小鼠相比,血管性抑郁小鼠中DA和5-HT的含量较高,差异有统计学意义(P<0.05),而NE含量差异无统计学意义。表明DA和5-HT可以被用作血管性抑郁疾病诊断的标志物。
|
图 3 实验组和对照组海马组织中DA、NE和5-HT的含量比较 Fig 3 Comparison of DA, NE and 5-HT concentrations in hippocampal tissues between two groups DA: Dopamine; NE: Norepinephrine; 5-HT: 5-Hydroxytryptamine. *P < 0.05 vs control. n=10, x±s |
3 结论
本研究分别采用HPLC仪器搭配UV、FLD和MS检测器建立了小鼠脑组织中3种单胺类神经递质DA、NE和5-HT的含量测定方法,并进行了比较。结果表明HPLC-FLD检测方法更灵敏,故采用HPLC-FLD法对血管性抑郁小鼠不同脑组织中的3种单胺类神经递质的含量进行测定,结果表明DA含量在纹状体组织中最高,大脑皮层中5-HT含量最高,而不同脑组织中的NE含量无明显差别;此外,DA和5-HT可以作为血管性抑郁的诊断标志物。
| [1] | PARROT S, NEUZERET P C, DENOROY L. A rapid and sensitive method for the analysis of brain monoamine neurotransmitters using ultra-fast liquid chromatography coupled to electrochemical detection[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879: 3871–3878. DOI: 10.1016/j.jchromb.2011.10.038 |
| [2] | DE BENEDETTO G E, FICO D, PENNETTA A, MALITESTA C, NICOLARDI G, LOFRUMENTO D D, et al. A rapid and simple method for the determination of 3, 4-dihydroxyphenylacetic acid, norepinephrine, dopamine, and serotonin in mouse brain homogenate by HPLC with fluorimetric detection[J]. J Pharm Biomed Anal, 2014, 98: 266–270. DOI: 10.1016/j.jpba.2014.05.039 |
| [3] | KOEHLER P J, JENNEKENS F G. Vinken and Bruyn's Handbook of Clinical Neurology. A witness of late-twentieth century neurological progress[J]. J Hist Neurosci, 2008, 17: 46–55. DOI: 10.1080/09647040600820050 |
| [4] | NACCARATO A, GIONFRIDDO E, SINDONA G, TAGARELLI A. Development of a simple and rapid solid phase microextraction-gas chromatography-triple quadrupole mass spectrometry method for the analysis of dopamine, serotonin and norepinephrine in human urine[J]. Anal Chim Acta, 2014, 810: 17–24. DOI: 10.1016/j.aca.2013.11.058 |
| [5] | CHEN L, ZHANG L, WANG X, LIN H, DU L. Determination of dopamine and its relativity of baicalin in rat nuclei after intravenous administration of flavonoids from Scutellariae radix[J]. Biomed Chromatogr, 2007, 21: 84–88. DOI: 10.1002/(ISSN)1099-0801 |
| [6] | CHENG H G, SHIDHAYE R, CHARLSON F, DENG F, LYNGDOH T, CHEN S, et al. Social correlates of mental, neurological, and substance use disorders in China and India:a review[J]. Lancet Psychiatry, 2016, 9: 882–899. |
| [7] | BLIER P. Neurobiology of depression and mechanism of action of depression treatments[J]. J Clin Psychiatry, 2016, 77: e319. DOI: 10.4088/JCP.13097tx3c |
| [8] | TAYLOR W D, AIZENSTEIN H J, ALEXOPOULOS G S. The vascular depression hypothesis:mechanisms linking vascular disease with depression[J]. Mol Psychiatry, 2013, 18: 963–974. DOI: 10.1038/mp.2013.20 |
| [9] | BI X, ZHANG Y, YAN B, FANG S, HE J, ZHANG D, et al. Quetiapine prevents oligodendrocyte and myelin loss and promotes maturation of oligodendrocyte progenitors in the hippocampus of global cerebral ischemia mice[J]. J Neurochem, 2012, 123: 14–20. DOI: 10.1111/j.1471-4159.2012.07883.x |
| [10] | YAN Q. Translational implications of inflammatory biomarkers and cytokine networks in psychoneuroimmunology[J]. Methods Mol Biol, 2012, 934: 105–120. DOI: 10.1007/978-1-62703-071-7 |
| [11] | YAN B, HE J, XU H, ZHANG Y, BI X, THAKUR S, et al. Quetiapine attenuates the depressive and anxiolytic-like behavioural changes induced by global cerebral ischemia in mice[J]. Behav Brain Res, 2007, 182: 36–41. DOI: 10.1016/j.bbr.2007.05.002 |
| [12] | JI E S, LEE J M, KIM T W, KIM Y M, KIM Y S, KIM K. Treadmill exercise ameliorates depressive symptoms through increasing serotonin expression in postpartum depression rats[J]. J Exerc Rehabil, 2017: 130–135. |
 2017, Vol. 38
2017, Vol. 38


