蛋白酪氨酸磷酸化修饰广泛存在于真核细胞内,作为一种基础性调节机制参与调节细胞的增殖、凋亡、分化、迁移等多个生物学特性[1]。蛋白酪氨酸磷酸化水平受蛋白酪氨酸激酶(protein tyrosine kinase,PTK)和蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)共同调节,二者通过相互协同或拮抗作用维持体内蛋白酪氨酸磷酸化水平的动态平衡。PTK-PTP的平衡作用一旦被打破,蛋白酪氨酸磷酸化异常,将导致多种疾病的发生和发展[2]。肝脏疾病的发生与蛋白酪氨酸磷酸化有着密切关系。蛋白酪氨酸磷酸化水平的改变与肝细胞的增殖、凋亡密切相关,研究表明PTP家族成员PTP1B可通过调节肝细胞生长因子(HGF)、Smad2/3酪氨酸磷酸化影响肝细胞凋亡[3];PTP1B还可调节信号转导与转录激活因子3(STAT3)、HGF、内皮细胞生长因子(EGF)受体的酪氨酸磷酸水平,抑制肝细胞增殖[4];而含SH2结构域的酪氨酸磷酸酶2(src-homology domain 2-containing protein tyrosine phosphatase 2,SHP-2) 与生长因子受体结合蛋白2(Grb2) 接头蛋白1(Gab1) C末端磷酸化的酪氨酸(Y627、Y659) 结合后可正向调节受体酪氨酸激酶(RTKs)信号,促进肝切除后的肝细胞再生[5]。PTP家族中的其他成员如肝再生磷酸酶(PRL)、低分子量蛋白酪氨酸磷酸酶(LMWPTP)、FAS相关磷酸酯酶1(FAP-1) 等还可调节多种分子的酪氨酸磷酸水平,参与肝脏糖脂代谢、非酒精性肝病、药物性肝病以及肝癌的发生、发展[1]。因此,蛋白酪氨酸磷酸化为肝脏疾病的治疗提供了新靶点。目前已有20余种蛋白酪氨酸激酶靶向小分子抑制剂被美国食品药品监督管理局(FDA)批准用于多种肿瘤的临床治疗,而针对蛋白酪氨酸磷酸酶的临床药物尚有待开发。含SH2结构域的蛋白酪氨酸磷酸酶1(SHP-1) 属于非受体型蛋白酪氨酸磷酸酶,主要表达于造血细胞及上皮细胞,在肝脏、脂肪组织及骨骼肌等组织中亦有表达[6]。SHP-1在造血系统和免疫应答系统中的功能已有广泛研究,近年来其在消化系统疾病中的研究也逐渐引起重视,尤其是在肝脏疾病中的研究取得了很大进展,本文主要就SHP-1在肝脏糖脂代谢、肝炎、肝纤维化和肝癌等肝脏疾病中的研究现状作一综述。
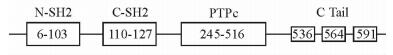
1 SHP-1的蛋白结构与功能SHP-1编码基因PTPN6位于人染色体12p12-13,包含17个外显子。SHP-1蛋白由两个位于N末端的SH2结构域(N-SH2,C-SH2)、一个具有催化活性的结构域(PTP)和一个含有多个磷酸化位点的C末端构成[7](图 1)。SHP-1构象的改变可影响其酪氨酸磷酸酶的活性。晶体结构显示,在无配体结合的状态下,N端SH2结构域的β片层中连接β4和β5的多肽链延伸至催化结构域,从而阻止底物与催化部位结合,使SHP-1处于自我抑制状态;同时,这种结合也为催化部位容易被氧化失活的半胱氨酸残基提供保护[8]。当酪氨酸磷酸化多肽与N末端SH2结构域结合时,SHP-1蛋白构象发生改变,PTP结构域暴露并发挥催化活性,SHP-1被激活。C末端亦可通过酪氨酸(Y536、Y564) 及丝氨酸(S591) 等磷酸化位点调节SHP-1的催化活性[9]。
|
图 1 SHP-1蛋白的结构示意图 Fig 1 Schematic diagram of SHP-1 structure SHP: Src-homology 2 domain-containing protein tyrosine phosphatase; PTP: Protein tyrosine phosphatase |
作为蛋白酪氨酸磷酸酶家族中的重要成员,SHP-1主要通过去磷酸化多种底物分子特异性下调部分生长因子受体(c-kit、CSF-1、TrkA、EGF)、细胞因子受体(Epo-R、IFN-α/β、IL-3R、EGF)和免疫应答相关受体(BCR、TCR、CD19、CD5) 等跨膜受体的信号发挥负向调节作用,影响细胞的增殖、凋亡、黏附及转移等生物学功能。此外,SHP-1还可去磷酸化胞质中的两面神激酶(JAK)或STAT蛋白,终止JAK/STAT信号通路转导,抑制多种细胞增殖[10]。有研究发现,SHP-1基因突变小鼠motheaten (me/me)和viable motheaten(mev/mev)的中性粒细胞增多、淋巴细胞减少、脾脏肿大和血清免疫球蛋白增多,出现严重的联合免疫缺陷和自身免疫缺陷[2, 11]。此外,在乳腺癌、卵巢癌及前列腺癌中SHP-1蛋白均出现不同程度的表达异常。表明SHP-1通过调节靶蛋白酪氨酸磷酸水平在机体内发挥着重要作用[12]。
2 SHP-1与肝脏疾病 2.1 SHP-1与肝脏糖脂代谢肝脏是调节糖脂代谢的重要器官,是糖代谢的重要枢纽[13]。而胰岛素相关信号转导与肝脏糖代谢密切相关。既往研究表明PTP家族成员中的LAR和PTP1B能够下调胰岛素受体(IR)和胰岛素受体底物(IRS)的磷酸化,抑制胰岛素信号转导[14]。SHP-1也与肝脏糖代谢密切相关,Dubois等[15]研究发现与野生型小鼠相比,SHP-1基因突变小鼠mev/mev的糖耐量增加,胰岛素敏感性增强;在正常小鼠肝脏中通过腺病毒表达失去催化活性的SHP-1突变体或通过短发卡RNA沉默SHP-1后,小鼠的糖耐量和胰岛素敏感性增加。Oriente等[16]发现通过过表达转录因子Prep1激活SHP-1基因转录后,肝细胞中的胰岛素信号通路转导受到抑制。Xu等[17]发现在高脂饮食诱发的肥胖小鼠中,骨骼肌、内脏脂肪组织、肝脏等胰岛素靶向组织中SHP-1的mRNA和蛋白水平均上调;与野生型(Ptpn6f/f)小鼠相比,高脂饮食肝细胞特异性敲除SHP-1(Ptpn6H-KO)小鼠的骨骼肌等胰岛素外周靶器官的胰岛素抵抗无明显变化,但肝脏的胰岛素抵抗得到明显改善。此外,研究发现经血小板源性生长因子(PDGF)、T细胞受体(TCR)、白介素(IL)-4等刺激后,SHP-1可下调磷酸酰肌醇3激酶(PI3K) p-85调节亚基酪氨酸磷酸化水平[18-20]。Dubois等[15]研究也表明,SHP-1缺失后IR、IRS、p-85等胰岛素信号通路蛋白的酪氨酸磷酸化均增强,IR-IRS-PI3K-AKT信号通路被激活;同时SHP-1缺失还可导致参与胰岛素清除的细胞表面跨膜糖蛋白癌胚抗原相关细胞黏附因子(CEACAM1) 的酪氨酸磷酸化增强,提高肝脏及血清胰岛素清除率。这些研究均表明SHP-1可降低小鼠的胰岛素敏感性,负向调节糖代谢。
SHP-1在肝脏脂质代谢中也发挥着重要作用。Xu等[17]研究发现给予Ptpn6H-KO小鼠高脂饮食后肝脏脂肪沉积增多,主要表现为肝脂肪合成增多,脂肪酸摄取增加、输出减少,推测可能与SHP-1敲除后胰岛素信号通路激活相关。基于SHP-1在肝脏糖脂代谢中发挥着重要的调控作用,肝脏内SHP-1可能成为糖尿病、非酒精性脂肪肝等代谢疾病的治疗新靶点。
2.2 SHP-1与肝脏炎症独立的致病因素、慢性肝损伤和肝脏炎症是肝脏疾病发展的关键因素。SHP-1可调节炎性细胞的增殖、分化和炎性因子分泌及信号转导,在炎症反应中发挥重要作用。一项对Ptpn6me-v/me-v小鼠的研究表明,SHP-1缺失后免疫细胞处于高敏状态,炎性因子分泌增多,二者共同促发严重的自身免疫性疾病及炎症反应,如过敏性哮喘、中性皮肤病、过敏性皮炎、类风湿性关节炎、多发性硬化等[21]。SHP-1在肝脏炎症中的作用有不同的报道。肝脏组织中抗增殖蛋白(prohibitin 1) 部分缺失可导致SHP-1的表达下降,其对TRC信号通路的负调节作用减弱,脾脏细胞增殖能力增高,淋巴细胞激活,继而产生多种炎性因子,促进肝脏炎症的发生及造成损伤[22],提示SHP-1具有抑制肝脏炎症的作用。另有研究发现,在高脂饮食导致的脂肪肝模型中,尽管SHP-1缺失可促进肝脂肪合成,但肝脏炎症及肝脏损伤并未随之增加,这可能与过氧化物酶增殖体激活受体γ(PPARγ)的表达改变相关[23]。PPARγ是调节目标基因表达的核内受体转录因子超家族成员,具有极强的成脂作用,同时可负调节炎症信号[24-26],SHP-1缺失后PPARγ的活性及表达均增加[23]。因此,SHP-1与肝脏炎症的关系还需进一步明确。
2.3 SHP-1与肝纤维化肝硬化是临床常见的慢性进行性肝病,是由一种或多种病因长期或反复作用形成的弥漫性肝损害,其主要特征是细胞外基质的沉积,而肝星状细胞在细胞外基质的沉积中发挥着重要作用,肝星状细胞活化依赖肝脏损伤后多种炎症因子的作用,尤其是PDGF。研究表明SHP-1和SHP-2均参与调节血小板源性生长因子受体(PDGFR)依赖的肝星状细胞增殖信号转导,但二者发挥的作用不同。SHP-1可使PDGFR-β酪氨酸去磷酸化,从而抑制PDGFR依赖信号通路的转导,减少肝星状细胞的增殖及细胞外基质的沉积,发挥抗纤维化作用;而SHP-2与PDGFR-β结合后作为该信号通路的下游分子传导信号,激活细胞外调节蛋白激酶1/2(ERK1/2) 和蛋白激酶B(AKT),促进肝星状细胞的增殖[27]。本实验室前期研究发现,在二甲基亚硝胺(DMN)和胆总管结扎(BDL)等大鼠肝纤维化模型以及人肝硬化组织中肝细胞核因子1α(HNF1α)的表达下降,且伴随着SHP-1的表达下调。相关机制研究发现HNF1α可直接与SHP-1的启动子结合,提高SHP-1的转录和蛋白表达,增强其对p65、STAT3等蛋白的去磷酸化作用,抑制核转录因子κB(NF-κB)及JAK/STAT等炎症信号通路。肝细胞中HNF1α表达下调后IL-6、转化生长因子β1(TGF-β1)、肿瘤坏死因子α(TNF-α)等细胞因子的表达升高,介导肝细胞与肝星状细胞的相互作用,促进肝星状细胞活化,使细胞外基质的产生及沉积增加。此外,活化的肝星状细胞还可分泌IL-6、TNF-α,导致肝细胞中HNF1α的表达降低,造成恶性循环,促进肝纤维化的发展,表明SHP-1可通过抑制炎症信号通路介导HNF1α的抗肝纤维化作用[28]。索拉非尼是多种蛋白激酶的抑制剂,临床主要用于晚期肝癌的治疗,近期研究发现其对门脉高压、肝脏炎症、肝脏急慢性损伤和肝脏纤维化也有作用。Su等[29]发现晚期肝硬化患者肝星状细胞内STAT3的磷酸化水平升高,索拉非尼及其衍生物SC-1可通过调节STAT3的磷酸化水平及其下游与细胞周期及凋亡相关的细胞周期素1(Mcl-1) 的表达,改善肝纤维化,二者主要是通过SHP-1发挥作用,进一步明确了SHP-1的抗肝纤维化作用。
2.4 SHP-1与肝癌JAK/STAT信号传导通路的激活,特别是STAT的异常活化与肝癌的发生、发展、侵袭和转移密切相关[30]。SHP-1是JAK/STAT信号通路中主要的负向调节因子之一。目前研究发现多种药物可通过SHP-1下调STAT3磷酸化,诱导细胞凋亡而发挥抗肿瘤作用。索拉非尼是唯一被FDA批准用于治疗晚期肝癌的药物,既往认为其主要通过抑制相关的酪氨酸蛋白激酶发挥作用,而近期研究发现索拉非尼可直接与SHP-1的N-SH2结构域结合,消除SHP-1的自我抑制作用,促进SHP-1活化,降低STAT3的磷酸化水平,降低JAK/STAT信号通路活性,从而抑制肝癌的发生和发展[31]。索拉非尼的衍生物YC-1、SC-43与索拉非尼结构相似,但不具有激酶抑制作用,其与SHP-1结合同样可降低STAT3的磷酸化水平,抑制其下游基因表达,减少细胞增殖,诱导细胞凋亡[32-33],表明索拉非尼通过SHP-1抑制肝癌的功能而不依赖其激酶剂的作用。另有研究发现,多韦替尼及植物中提取的和厚朴酚(honokiol)、大黄素(emodin)同样可通过SHP-1抑制JAK/STAT信号通路发挥抗肝癌作用[34-35]。近年来索拉非尼耐药现象受到越来越多的关注,而索拉非尼长期治疗后STAT3磷酸化升高,伴随着SHP-1转录因子RFX-1/SHP-1活性降低是其耐药机制之一。RFX-1可与SHP-1启动子结合,增加SHP-1的表达和活性,联合应用索拉非尼和Bcl-2蛋白抑制剂obataclax小分子结构类似物(SC-2001) 可以增加RFX-1的表达,促进RFX-1向细胞核内转移,增加SHP-1的活性,降低STAT3的磷酸化水平,克服索拉非尼耐药[36-38]。索拉非尼及其衍生物YC-1联合应用较单独应用索拉非尼能更大程度地提高SHP-1的活性,降低STAT3磷酸化及其下游基因的表达水平,克服索拉非尼耐药[33]。此外,肝癌细胞抵抗肿瘤坏死因子相关性凋亡诱导配体(TRAIL)诱导的凋亡也十分常见,联合应用多韦替尼和促凋亡受体DR5的新型抗体tigatuzumab亦可增加SHP-1活性,降低STAT3磷酸化水平,增加肝癌细胞对TNF相关性凋亡诱导配体的敏感性,从而诱导肝癌细胞凋亡,达到抗肿瘤作用[39]。近期研究发现SHP-1还可通过下调p-STAT3Tyr705磷酸化水平降低TGF-β1诱导的上皮间质转化(EMT)过程,从而抑制肝癌的侵袭及转移[40]。由此可知,SHP-1在肝癌的发生、发展中扮演着重要角色,随着SHP-1研究的深入,以SHP-1为治疗靶点的抗肝癌药物有可能取得突破性进展。
3 总结与展望SHP-1对肝脏糖脂代谢具有显著的调节作用,同时,SHP-1还可通过调节JAK/STAT等信号通路影响肝脏炎症、肝纤维化、肝癌等多种肝脏疾病的发生和发展。目前多种靶向抑制蛋白酪氨酸激酶活性的小分子抑制剂已经被应用于临床,作为蛋白酪氨酸磷酸酶家族的主要成员,SHP-1有望成为肝脏疾病诊治的重要靶点,寻找更多调控SHP-1表达或活性的靶向药物将为肝脏疾病的治疗提供更广的选择。此外,SHP-1与肝脏其他相关疾病,如自身免疫性肝病、酒精性肝病等的研究仍较少,其与肝脏疾病发病风险、发病率的相关性等临床问题也仍需进一步研究明确。
| [1] | HE R J, YU Z H, ZHANG R Y, ZHANG Z Y. Protein tyrosine phosphatases as potential therapeutic targets[J]. Acta Pharmacol Sin, 2014, 35: 1227–1246. DOI: 10.1038/aps.2014.80 |
| [2] | SHARMA Y, BASHIR S, BHARDWAJ P, AHMAD A, KHAN F. Protein tyrosine phosphatase SHP-1:resurgence as new drug target for human autoimmune disorders[J]. Immunol Res, 2016, 64: 804–819. DOI: 10.1007/s12026-016-8805-y |
| [3] | CHEN P J, CAI S P, HUANG C, MENG X M, LI J. Protein tyrosine phosphatase 1B (PTP1B):a key regulator and therapeutic target in liver diseases[J]. Toxicology, 2015, 337: 10–20. DOI: 10.1016/j.tox.2015.08.006 |
| [4] | PAGANO M A, TIBALDI E, GRINGERI E, BRUNATI A M. Tyrosine phosphorylation and liver regeneration:a glance at intracellular transducers[J]. IUBMB Life, 2012, 64: 27–35. DOI: 10.1002/iub.v64.1 |
| [5] | BARD-CHAPEAU E A, YUAN J, DROIN N, LONG S, ZHANG E E, NGUYEN T V, et al. Concerted functions of Gab1 and Shp2 in liver regeneration and hepatoprotection[J]. Mol Cell Biol, 2006, 26: 4664–4674. DOI: 10.1128/MCB.02253-05 |
| [6] | LORENZ U. SHP-1 and SHP-2 in T cells:two phosphatases functioning atmanylevels[J]. Immunol Rev, 2009, 228: 342–359. DOI: 10.1111/imr.2009.228.issue-1 |
| [7] | EVREN S, WAN S, MA X Z, FAHIM S, MODY N, SAKAC D, et al. Characterization of SHP-1 protein tyrosine phosphatase transcripts, protein isoforms and phosphatase activity in epithelial cancer cells[J]. Genomics, 2013, 102: 491–499. DOI: 10.1016/j.ygeno.2013.10.001 |
| [8] | YANG J, LIU L, HE D, SONG X, LIANG X, ZHAO Z J, et al. Crystal structure of human protein-tyrosine phosphatase SHP-1[J]. J Biol Chem, 2003, 278: 6516–6520. DOI: 10.1074/jbc.M210430200 |
| [9] | POOLE A, JONES M L. A SHPing tale:perspectives on the regulation of SHP-1 and SHP-2 tyrosine phosphatases by the C-terminal tail[J]. Cell Signal, 2005, 17: 1323–1332. DOI: 10.1016/j.cellsig.2005.05.016 |
| [10] | XU D, QU C K. Protein tyrosine phosphatases in the JAK/STAT pathway[J]. Front Biosci, 2008, 13: 4925–4932. |
| [11] | LÁPEZ-RUIZ P, RODRIGUEZ-UBREVA J, CARIAGA A E, CORTES M A, COLÁS B. SHP-1 in cell-cycle regulation[J]. Anticancer Agents Med Chem, 2011, 11: 89–98. DOI: 10.2174/187152011794941154 |
| [12] | WU C, SUN M, LIU L, ZHOU G W. The function of the protein tyrosine phosphatase SHP-1 in cancer[J]. Gene, 2003, 306: 1–12. DOI: 10.1016/S0378-1119(03)00400-1 |
| [13] | RUTTER G A. Diabetes:the importance of the liver[J]. Curr Biol, 2000, 10: R736–R738. DOI: 10.1016/S0960-9822(00)00737-5 |
| [14] | XU E, SCHWAB M, MARETTE A. Role of protein tyrosine phosphatases in the modulation of insulin signaling and their implication in the pathogenesis of obesity-linked insulin resistance[J]. Rev Endocr Metab Disord, 2014, 15: 79–97. DOI: 10.1007/s11154-013-9282-4 |
| [15] | DUBOIS M J, BERGERON S, KIM H J, DOMBROWSKI L, PERREAUL M. The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis[J]. Nat Med, 2006, 12: 549–556. DOI: 10.1038/nm1397 |
| [16] | ORIENTE F, IOVINO S, CABARO S. Prep1 controls insulin glucoregulatory function in liver by transcriptional targeting of SHP1 tyrosine phosphatase[J]. Diabetes, 2011, 60: 138–147. DOI: 10.2337/db10-0860 |
| [17] | XU E, CHARBONNEAU A, ROLLAND Y, BELLMANN K, PAO L, SIMINOVITCH K A, et al. Hepatocyte-specific Ptpn6 deletion protects from obesity-linked hepatic insulin resistance[J]. Diabetes, 2012, 61: 1949–1958. DOI: 10.2337/db11-1502 |
| [18] | YU Z, SU L, HOGLINGER O, JARAMILLO M L, BANVILLE D, SHEN S H. SHP-1 associates with both platelet-derived growth factor receptor and the p85 subunit of phosphatidylinositol 3-kinase[J]. J Biol Chem, 1998, 273: 3687–3694. DOI: 10.1074/jbc.273.6.3687 |
| [19] | CUEVAS B, LU Y, WATT S, KUMAR R, ZHANG J, SIMINOVITCH K A, et al. SHP-1 regulates Lck-induced phosphatidylinositol 3-kinase phosphorylation and activity[J]. J Biol Chem, 1999, 274: 27583–275899. DOI: 10.1074/jbc.274.39.27583 |
| [20] | IMANI F, RAGER K J, CATIPOVIC B, MARSH D G. Interleukin-4(IL-4) induces phosphatidylinositol 3-kinase (p85) dephosphorylation. Implications for the role of SHP-1 in the IL-4-induced signals in human B cells[J]. J Biol Chem, 1997, 272: 7927–7931. DOI: 10.1074/jbc.272.12.7927 |
| [21] | SHARMA Y, BASHIR S, BHARDWAJ P, AHMAD A, KHAN F. Protein tyrosine phosphatase SHP-1:resurgence as new drug target for human autoimmune disorders[J]. Immunol Res, 2016, 64: 804–819. DOI: 10.1007/s12026-016-8805-y |
| [22] | SANCHEZ-QUILES V, SEGURA V, BIGAUD E, HE B, O'MALLEY B W, SANTAMARIA E, et al. Prohibitin-1 deficiency promotes inflammation and increases sensitivity to liver injury[J]. J Proteomics, 2012, 75: 5783–5792. DOI: 10.1016/j.jprot.2012.08.009 |
| [23] | XU E, FOREST M P, SCHWAB M, AVRAMOGLU R K, ST-AMAND E, CARON A Z, et al. Hepatocyte-specific Ptpn6 deletion promotes hepatic lipid accretion, but reduces NAFLD in diet-induced obesity:potential role of PPARγ[J]. Hepatology, 2014, 59: 1803–1815. DOI: 10.1002/hep.26957 |
| [24] | TONTONOZ P, HU E, GRAVES R A, BUDAVARI A I, SPIEGELMAN B M. mPPAR gamma 2:tissue-specific regulator of an adipocyte enhancer[J]. Genes Dev, 1994, 8: 1224–1234. DOI: 10.1101/gad.8.10.1224 |
| [25] | MORÁN-SALVADOR E, LÁPEZ-PARRA M, GARCIA-ALONSO V, TITOS E, MARTINEZCLEMENTE M, GONZALEZ-PERIZ A, et al. Role for PPARγ in obesity-induced hepatic steatosis as determined by hepatocyte-and macrophage-specific conditional knockouts[J]. FASEB J, 2011, 25: 2538–2550. DOI: 10.1096/fj.10-173716 |
| [26] | BOUHLEL M A, DERUDAS B, RIGAMONTI E, DIÈVART R, BROZEK J, HAULON S, et al. PPARgamma activation primes human monocytes into alternative M2 macrophages with anti-inflammatory properties[J]. Cell Metab, 2007, 6: 137–143. DOI: 10.1016/j.cmet.2007.06.010 |
| [27] | TIBALDI E, ZONTA F, BORDIN L, MAGRIN E, GRINGERI E, CILLO U, et al. The tyrosine phosphatase SHP-1 inhibits proliferation of activated hepatic stellate cells by impairing PDGF receptor signaling[J]. Biochim Biophys Acta, 2014, 1843: 288–298. DOI: 10.1016/j.bbamcr.2013.10.010 |
| [28] | QIAN H, DENG X, HUANG Z W, WEI J, DING C H, FENG R X, et al. An HNF1α-regulated feedback circuit modulates hepatic fibrogenesis via the crosstalk between hepatocytes and hepatic stellate cells[J]. Cell Res, 2015, 25: 930–945. DOI: 10.1038/cr.2015.84 |
| [29] | SU T H, SHIAU C W, JAO P, LIU C H, LIU C J, TAI W T, et al. Sorafenib and its derivative SC-1 exhibit antifibrotic effects through signal transducer and activator of transcription 3 inhibition[J]. Proc Natl Acad Sci USA, 2015, 112: 7243–7248. DOI: 10.1073/pnas.1507499112 |
| [30] | 王建强, 黄缘. JAK-STAT信号通路在肝癌发生发展中作用的研究进展[J]. 世界华人消化杂志, 2013, 21: 2051–2056. |
| [31] | TAI W T, CHENG A L, SHIAU C W, HUANG H P, HUANG J W, CHEN P J, et al. Signal transducer and activator of transcription 3 is a major kinase-independent target of sorafenib in hepatocellular carcinoma[J]. J Hepatol, 2011, 55: 1041–1048. DOI: 10.1016/j.jhep.2011.01.047 |
| [32] | CHAO T I, TAI W T, HUNG M H, TSAI M H, CHEN M H, CHANG M J, et al. A combination of sorafenib and SC-43 is a synergistic SHP-1 agonist duo to advance hepatocellular carcinoma therapy[J]. Cancer Lett, 2016, 371: 205–213. DOI: 10.1016/j.canlet.2015.11.039 |
| [33] | KONG J, KONG F, GAO J, ZHANG Q, DONG S, GU F, et al. YC-1 enhances the anti-tumor activity of sorafenib through inhibition of signal transducer and activator of transcription 3(STAT3) in hepatocellular carcinoma[J]. Mol Cancer, 2014, 13: 7. DOI: 10.1186/1476-4598-13-7 |
| [34] | SUBRAMANIAM A, SHANMUGAM M K, ONG T H, LI F, PERUMAL E, CHEN L, et al. Emodin inhibits growth and induces apoptosis in an orthotopic hepatocellular carcinoma model by blocking activation of STAT3[J]. Br J Pharmacol, 2013, 170: 807–821. DOI: 10.1111/bph.12302 |
| [35] | TAI W T, CHENG A L, SHIAU C W, LIU C Y, KO C H, LIN M W, et al. Dovitinib induces apoptosis and overcomes sorafenib resistance in hepatocellular carcinoma through SHP-1-mediated inhibition of STAT3[J]. Mol Cancer Ther, 2012, 11: 452–463. DOI: 10.1158/1535-7163.MCT-11-0412 |
| [36] | SU J C, CHIANG H C, TSENG P H, TAI W T, HSU C Y, LI Y S, et al. RFX-1-dependent activation of SHP-1 inhibits STAT3 signaling in hepatocellular carcinoma cells[J]. Carcinogenesis, 2014, 35: 2807–2814. DOI: 10.1093/carcin/bgu210 |
| [37] | CHEN K F, SU J C, LIU C Y, HUANG J W, CHEN K C, CHEN W L, et al. A novel obatoclax derivative, SC-2001, induces apoptosis in hepatocellular carcinoma cells through SHP-1-dependent STAT3 inactivation[J]. Cancer Lett, 2012, 321: 27–35. DOI: 10.1016/j.canlet.2012.03.023 |
| [38] | LIU C Y, SU J C, NI M H, TSENG L M, CHU P Y, WANG D S, et al. Obatoclax analog SC-2001 inhibits STAT3 phosphorylation through enhancing SHP-1 expression and induces apoptosis in human breast cancer cells[J]. Breast Cancer Res Treat, 2014, 146: 71–84. DOI: 10.1007/s10549-014-3000-0 |
| [39] | CHEN K F, CHEN H L, LIU C Y, TAI W T, ICHIKAWA K, CHEN P J, et al. Dovitinib sensitizes hepatocellular carcinoma cells to TRAIL and tigatuzumab, a novel anti-DR5 antibody, through SHP-1-dependent inhibition of STAT3[J]. Biochem Pharmacol, 2012, 83: 769–777. DOI: 10.1016/j.bcp.2011.12.035 |
| [40] | FAN L C, SHIAU C W, TAI W T, HUNG M H, CHU P Y, HSIEH F S, et al. SHP-1 is a negative regulator of epithelial-mesenchymal transition in hepatocellular carcinoma[J]. Oncogene, 2015, 34: 5252–5263. DOI: 10.1038/onc.2014.445 |
 2017, Vol. 38
2017, Vol. 38


