2. 第二军医大学长征医院泌尿外科, 上海 200003
2. Department of Urinary Surgery, Changzheng Hospital, Second Military Medical University, Shanghai 200003, Chinas
随着人们健康意识的提高和影像诊断技术的发展,大部分肾脏肿瘤在早期即可被发现[1]。由于腹腔镜下保留肾单位手术的不断进步及广泛应用,目前多数早期发现的T1期肿瘤能被完整切除并使患者获得良好的预后。但对于完全内生型肿瘤,因其靠近肾集合系统、肿瘤术中定位困难的特点,采用腔镜下保留肾单位的手术方式进行治疗存在困难,往往导致手术时间延长、术后并发症增多,甚至出现手术切缘阳性等情况,与保留肾单位手术“最大化保留正常肾组织,最小化手术副损伤[2]”的目标相悖。故此类肿瘤既往多采用根治性肾切除术进行治疗,给患者术后肾功能保留带来较大影响。近年来,为将保留肾单位手术应用于内生型肿瘤治疗而使患者获益更大并保证手术效果,我们尝试将3D打印技术联合术中超声定位精确切除肿瘤,取得了良好的效果,现报告如下。
1 资料和方法 1.1 一般资料2014年3月至2016年3月共15例完全内生型肾脏肿瘤患者应用3D打印模型及术中超声定位辅助行腹腔镜下肾部分切除术。其中男性11例、女性4例,平均年龄(55.7±10.5) 岁;肾脏肿瘤均为单侧单发内生型肿瘤,其中腹侧3例,背侧12例;TNM分期T1a期13例,T1b期2例;肿瘤直径(2.8±1.0) cm;肿瘤距集合系统的距离(5.3±1.6) mm,其中4例肿瘤距离集合系统小于5 mm; 距肾门肾血管的距离(4.9±0.6) mm。R.E.N.A.L.评分为(8.9±0.9) 分。所有患者均无特殊不适,因健康体检发现肾肿瘤入院;术前均无其他系统严重疾病、孤立肾、肾功能不全、腹部手术等病史。所有患者术前均签署3D模型打印及手术知情同意书。
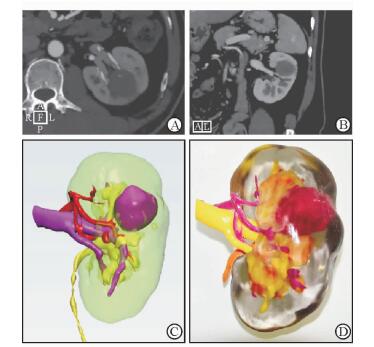
1.2 3D打印模型制作术前行双肾CT平扫+增强检查,包括肾动脉、静脉期影像(典型完全内生型肿瘤病例如图 1A、1B所示)。将采集的患者CT影像资料采用Philips IntelliSpace Portal V5.0.1软件进行3D重建(图 1C),形成标准化的3D打印格式STL,用软件行数字建模后,使用Formlab Form1+ 3D打印机对肾脏模型进行分色打印。模型选用4种颜色聚合物、16 μm厚度逐层打印:动脉为紫色,静脉黄色,集合系统橙色,肾实质半透明,内生肿瘤以红色实体表示。3D打印模型能清晰显示肿瘤与集合系统肾门血管的毗邻关系(图 1D),通过该模型可对肿瘤血供、毗邻关系、切除范围路径进行分析。
|
图 1 R.E.N.A.L.评分9分肾肿瘤术前三维成像和3D打印模型构建 A:CT冠状面;B:CT矢状面;C:三维成像显示肿瘤与血管和集合系统的位置关系;D:3D打印模型 |
初步制定手术方案后利用3D打印模型对患者及家属进行术前谈话、宣教,直观且区分度高的打印模型能促进患者及家属对疾病和手术过程的了解,简化谈话、宣教流程。
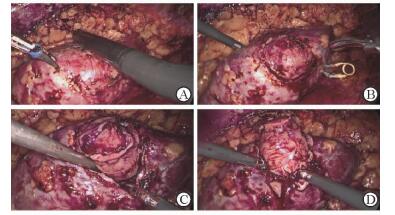
1.3 术中超声定位及手术方法患者采用静吸复合麻醉,取健侧卧位,垫高腰部并调整手术床呈头低足低位,采用Olympus腹腔镜系统经后腹腔入路行肾部分切除术。在腋后线12肋缘下、腋前线肋弓缘下及腋中线髂嵴上2指位置分别置入10 mm、10 mm及12 mm的3个Trocar,常规气囊扩张后腹膜间隙,建立气腹。清除腹膜外脂肪,靠近腰大肌纵行切开肾周筋膜,沿腰大肌表面向肾门分离出肾动脉,注意肾动脉分支及变异,充分游离肿瘤周围的肾周脂肪,完整暴露肾肿瘤及周围部分正常肾组织。在阻断肾血供前,根据术前3D打印模型比对找到肿瘤的大致位置,将腹腔镜超声探头贴于肿瘤投射表面进一步明确肿瘤的大小、深度,另一Trocar中置入双极电凝刀在超声导航系统引导下标记肿瘤肾表面投射边界(图 2A)。标记完成后,行肾动脉完全阻断,冷刀沿预先标记边界剪开肾包膜(图 2B), 沿剪开的肾包膜边界向下仔细分离,寻找肿瘤假包膜边界,吸引器沿该界面外缘钝性游离肿瘤纵深面,充分游离肿瘤(图 2C)。确认肿瘤假包膜无破损后,离断肿瘤底面(图 2D)。
|
图 2 术中运用超声导航系统切除肿瘤过程(开天窗、钝游离、明探底) A:在超声导航系统引导下标记肿瘤肾表面投射边界;B:用冷刀沿预先标记边界行肾包膜开窗;C:仔细寻找肿瘤假包膜界面,用吸引器沿该界面钝性游离肿瘤纵深面;D:离断肿瘤底面 |
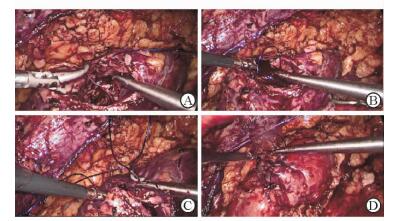
观察肾创面情况,免打结缝合法进行肾集合系统修复:双向倒刺线(Quill SRS线)连续缝合出血点及集合系统,第1针出针时将缝线拉出约总长一半,一半缝线严密缝合关闭集合系统(图 3A),另一半带针缝线继续关闭深层肾组织(图 3B),免去打结及Hem-o-lok夹固定步骤。继续缝合外层肾组织,为减少热缺血时间,在完成第1次缝合后可开放肾血供,观察肾脏表面渗血情况,再次加固缝合外层肾组织(图 3D)。通过髂嵴上切口取出标本并放置负压引流管,逐层关闭切口。记录术中热缺血时间及出血量等指标,标本常规送病理检查。
|
图 3 肾脏创面缝合过程 A:第1层缝合严密关闭集合系统;B:第2层缝合关闭深层肾组织;C:第3层缝合关闭外层肾组织;D:开放肾血供后再次加固缝合外层肾组织 |
1.4 术后处理及随访
术后复查常规实验室检查,予补液对症治疗,引流量低于30 mL/24 h后拔除引流管。患者于术后3个月常规复查肾小球滤过率(肾图),半年内每3个月复查血常规、肝肾功能、电解质;术后半年复查腹部CT、X线胸片等。
1.5 统计学处理应用SPSS 21.0软件进行统计分析。患者手术及热缺血时间、术中出血量、术后住院时间等相关数据采用x±s进行统计描述。
2 结果所有患者均在腹腔镜下顺利完成肾部分切除术,平均手术时间(105.0±20.6) min,平均术中出血量(87.3±15.8) mL,平均热缺血时间(22.8±3.5) min,术中及术后均未输血,肿瘤包膜完整。术后病理提示13例患者为透明肾细胞癌,2例为乳头状肾细胞癌,手术切缘均为阴性。术后未见尿漏、切口感染、高热等并发症,引流管拔除时间(3.7±0.7) d,住院时间(6.7±1.0) d。患者围手术期资料见表 1。
|
|
表 1 15例完全内生型肾肿瘤患者围手术期一般资料 |
术后随访(23.7±11.8) 个月。术后3个月时复查肾小球滤过率未见明显异常,术后6个月时复查双肾CT未见肿瘤复发。以血肌酐为指标长期监测肾功能情况,随访期内未见血肌酐持续增高患者。
3 讨论相较于腹腔镜下肾癌根治性切除,部分切除术在肾功能的保存方面有着巨大优势,同时因其预后与肾癌根治术一致[3],肾部分切除术已被推荐为T1a期肾肿瘤切除的标准术式[4]。但是由于肾部分切除术相对复杂,对于某些特殊类型肿瘤如肾门部或内生型肿瘤,手术切除难度极高,限制了肾部分切除术在这些患者中的应用。近年来,肾部分切除术的进步主要体现在影像辅助诊疗的创新[5]、手术技术的改进及手术理念的发展上。这些技术、理念的革新使得我们能够对以往视为肾部分切除术禁忌的特殊类型肿瘤发起挑战。随着精准切除肿瘤理念的提出,肾部分切除术正逐渐由肾段切除向肾肿瘤剥离剜除转变[6-7]。精准切除肿瘤是源于最大化保留肾实质理念的更新,有研究表明是否施行保留肾单位手术的决定因素是可保留肾实质的大小而非肿瘤的大小[8],故肾部分切除术的适应证也随之逐渐扩大。完全内生型肿瘤以往是腹腔镜下保留肾单位手术的禁忌证,因其术中难以定位且肿瘤位置较深,常毗邻集合系统或血管,对分离、缝合要求较高,易造成术中和术后出血、尿漏甚至手术切缘阳性等情况发生[9]。对于此类型肿瘤,要达到肾部分切除手术精确切除的要求,必须要首先确定肿瘤大小、位置毗邻及切除范围等信息,才能在限定的热缺血时间内保证手术效果并最大限度地保存肾功能。
目前对于内生型肿瘤定义尚不一致,一般认为内生型肿瘤是中央型肾癌的一种亚型[10]。Brown等[11]提出将距离肾窦或集合系统小于5 mm定义为中央型肾癌,Black等[12]则认为肿瘤完全被正常肾组织包绕即为内生型肿瘤。本组15例患者中有4例肿瘤距离集合系统小于5 mm,其R.E.N.A.L.评分≥9分,为高难度完全内生型肿瘤,要在腹腔镜下完成该类型肿瘤切除,精确定位及娴熟的缝合技巧是手术成功的关键。影像辅助诊断技术的发展使得肿瘤的定位更加精确,其方法由传统的超声、CT扫描及三维重建逐步发展为术中图像融合及手术操作中的实时导航[13],对这种高难度完全内生型肿瘤的切除帮助极大。但该技术对设备要求较高,需机器人辅助完成,难以大面积推广。现阶段运用CT三维重建对肿瘤进行评估,虽然可以明确肿瘤与周围组织的关系,但仅限于平面图像观察,对集合系统、动静脉血管及可行的手术路径显示不够直观立体。而基于CT三维重建的3D打印模型能很好地克服上述不足:3D模型能够精准再现肿瘤与周围组织的结构关系,特别是对于高度复杂肿瘤,术前和术中可直接利用3D模型进行手术过程的分析模拟[14],初步判定手术路径、肿瘤切除范围及术中需要注意规避的血管等难点问题,提高手术安全性。我们对15例患者均利用3D打印模型进行术前宣教,改善了患者对肾脏结构、解剖关系、肿瘤位置、切除范围等内容的认知;在术前谈话中,该模型能更直观地反映术中、术后可能出现并发症的原因,有效消除患者的恐惧心理,增进患者对术者的信任。对于术前手术复杂程度的评估,既往我们均采用基于CT或MRI平扫的影像学资料进行分析,采用R.E.N.A.L.、PADUA分型等对难度进行量化[15],而3D打印模型能将这种量化直观呈现并能够加以修正,使术前准备更加充分。
此外,在手术切除过程中可以根据体位、手术视野的变化,由台下助手将打印模型固定至相应角度和方位,与手术视野实时比对,直接定位肿瘤。由于内生型肿瘤在肾脏表面没有明显的生长界限,直接的肉眼定位并不能达到精准切除肿瘤的要求,故此时利用术中超声加以定位修正就显得尤为重要。术中超声使用较多的是腹腔镜超声探头,目前已作为确定肾部分切除术中肿瘤切除范围的常规技术[16],术中应用超声对肿瘤大小及切除范围进一步修正,能保证在完整切除肿瘤的同时,较多地保留正常肾组织,体现了肿瘤精准切除的理念。术中超声的使用主要分为实时定位与肾脏表面标记两种。Chung等[17]提倡边切除肿瘤边对肿瘤边界进行定位,术中能最大限度减少血管及集合系统损伤,但由于内生型肿瘤的切除在肾血供阻断下进行,频繁超声定位必然带来热缺血时间的延长。在机器人辅助肾部分切除术中,由于机械操作臂数量较多且具有良好的活动性,实时超声定位对精准切除肿瘤可能取得较为明确的获益,且热缺血时间可控[18]。而在腹腔镜手术下,由于操作孔及活动度的限制,实时定位会影响手术视野并对其他操作臂产生干扰,故不宜使用[19]。本组15例患者均采用腹腔镜下超声预先标记定位:通过3D打印模型比对找到肿瘤的大致位置,将腹腔镜超声探头贴于肿瘤投射表面进一步明确肿瘤范围,用电钩或双极电凝在超声导航系统引导下标记肿瘤肾表面投射边界,随后阻断肾血供,进行冷刀开窗、钝性分离、底面离断等操作将肿瘤完整切除。
内生型肿瘤纵深面边界定位困难,盲目剪切势必增加切缘阳性风险,同时由于内生型肿瘤与集合系统距离较近,为保证肿瘤完整切除和切缘阴性,在分离肿瘤纵深面时,使用钝性分离至集合系统为止。在肿瘤底面离断过程中,可能会造成集合系统的损伤。由于肾盂肾盏破裂与术后尿漏直接相关,集合系统的有效缝合修补至关重要。内生型肿瘤切除后手术创面较深,且因热缺血时间限制,要求缝合修补准确、迅速,对术者要求较高。对此,我们采用如下步骤进行修补缝合:运用双向倒刺线(Quill SRS线)免打结缝合深部肾创面,其中一侧倒刺线连续缝合修补集合系统,另一侧倒刺线反向连续缝合深面肾组织,彻底修补封闭破损肾集合系统;继续缝合外层肾组织,注意消除死腔,减少术后出血风险。为减少热缺血时间,在完成外层肾组织第1次缝合后可开放肾血供,根据肾脏表面渗血情况,再次加固缝合外层肾组织[20]。利用该方法能在缝合止血、修补确切的前提下有效缩短热缺血时间,使手术热缺血时间控制在30 min以内,最大化地减少对肾功能的损害。
肾部分切除术在精准切除肿瘤、保护肾功能及减少术后并发症方面相比肾癌根治术都有着巨大优势[21],而目前肾部分切除术的发展也正是围绕着上述目标加以改进。在内生型肿瘤的切除中,因肿瘤隐匿在正常肾组织中,且位置往往较深,给手术精准切除带来了极大的挑战[9]。但随着影像辅助技术的发展,内生型肿瘤已由“不可见”变为“可见”,并能通过3D打印模型加以区分呈现。同时,术中超声定位的修正加上优化的缝合方法都给内生型肿瘤的精准切除提供了保障。本组15例患者在经上述方案行术前准备及术中切除后,手术均取得成功,术后病理证实手术切缘阴性,术后无出血、尿漏等常见并发症的发生。随访期内,肾功能均在正常范围内,未见肿瘤复发。
综上所述,3D打印联合术中超声应用于腔镜下治疗完全内生型肾肿瘤安全有效,能预先规划手术路径并精准定位肿瘤。采用3D打印模型能直观呈现肿瘤毗邻关系,对规避手术风险、预判手术路径具有一定价值;而术中超声定位可进一步精确肿瘤切除范围,在确保切缘阴性的同时能最大限度保留正常肾实质,使肾部分切除术手术效果达到最佳。
| [1] | GILL I S, ARON M, GERVAIS D A, JEWETT M A. Clinical practice. Small renal mass[J]. N Engl J Med, 2010, 362: 624–634. DOI: 10.1056/NEJMcp0910041 |
| [2] | KLATTE T, FICARRA V, GRATZKE C, KAOUK J, KUTIKOV A, MACCHI V, et al. A literature review of renal surgical anatomy and surgical strategies for partial nephrectomy[J]. Eur Urol, 2015, 68: 980–992. DOI: 10.1016/j.eururo.2015.04.010 |
| [3] | KIM S P, MURAD M H, THOMPSON R H, BOORJIAN S A, WEIGHT C J, HAN L C, et al. Comparative effectiveness for survival and renal function of partial and radical nephrectomy for localized renal tumors:a systematic review and meta-analysis[J]. J Urol, 2012, pii:S0022-5347(12): 05254-8. DOI: 10.1016/j.juro.2012.10.026 |
| [4] | TOUIJER K, JACQMIN D, KAVOUSSI L R, MONTORSI F, PATARD J J, ROGERS C G, et al. The expanding role of partial nephrectomy:a critical analysis of indications, results, and complications[J]. Eur Urol, 2010, 57: 214–222. DOI: 10.1016/j.eururo.2009.10.019 |
| [5] | KANG S K, CHANDARANA H. Contemporary imaging of the renal mass[J]. Urol Clin North Am, 2012, 39: 161–170. DOI: 10.1016/j.ucl.2012.01.002 |
| [6] | DONG W, LIN T, LI F, FANG Y, LI K, XU K, et al. Laparoscopic partial nephrectomy for T1 renal cell carcinoma:comparison of two resection techniques in a multi-institutional propensity score-matching analysis[J]. Ann Surg Oncol, 2016, 23: 1395–1402. DOI: 10.1245/s10434-015-4985-2 |
| [7] | LARYNGAKIS N A, GUZZO T J. Tumor enucleation for small renal masses[J]. Curr Opin Urol, 2012, 22: 365–371. DOI: 10.1097/MOU.0b013e3283551f84 |
| [8] | LANE B R, FERGANY A F, LINEHAN W M, BRATSLAVSKY G. Should preservable parenchyma, and not tumor size, be the main determinant of the feasibility of partial nephrectomy?[J]. Urology, 2010, 76: 608–609. DOI: 10.1016/j.urology.2010.04.041 |
| [9] | KOMNINOS C, SHIN T Y, TULIAO P, KIM D K, HAN W K, CHUNG B H, et al. Robotic partial nephrectomy for completely endophytic renal tumors:complications and functional and oncologic outcomes during a 4-year median period of follow-up[J]. Urology, 2014, 84: 1367–1373. DOI: 10.1016/j.urology.2014.08.012 |
| [10] | GEORGE A K, HERATI A S, RAIS-BAHRAMI S, WAINGANKAR N, KAVOUSSI L R. Laparoscopic partial nephrectomy for hilar tumors:oncologic and renal functional outcomes[J]. Urology, 2014, 83: 111–115. DOI: 10.1016/j.urology.2013.08.059 |
| [11] | BROWN J A, HUBOSKY S G, GOMELLA L G, STRUP S E. Hand assisted laparoscopic partial nephrectomy for peripheral and central lesions:a review of 30 consecutive cases[J]. J Urol, 2004, 171: 1443–1446. DOI: 10.1097/01.ju.0000117962.54732.3e |
| [12] | BLACK P, FILIPAS D, FICHTNER J, HOHENFELLNER R, THVROFF J W. Nephron sparing surgery for central renal tumors:experience with 33 cases[J]. J Urol, 2000, 163: 737–743. DOI: 10.1016/S0022-5347(05)67794-4 |
| [13] | CHEN Y, LI H, WU D, BI K, LIU C. Surgical planning and manual image fusion based on 3D model facilitate laparoscopic partial nephrectomy for intrarenal tumors[J]. World J Urol, 2014, 32: 1493–1499. DOI: 10.1007/s00345-013-1222-0 |
| [14] | 曹志强, 柳云恩, 刘龙, 侯晓明. 3D打印技术在肾脏部分切除术中的应用[J]. 解放军医药杂志, 2015, 27: 6–9. DOI: 10.3969/j.issn.2095-140X.2015.06.002 |
| [15] | BYLUND J R, GAYHEART D, FLEMING T, VENKATESH R, PRESTON D M, STRUP S E, et al. Association of tumor size, location, R.E.N.A.L., PAD UA and centrality index score with perioperative outcomes and postoperative renal function[J]. J Urol, 2012, 188: 1684–1689. DOI: 10.1016/j.juro.2012.07.043 |
| [16] | GILL I S, DESAI M M, KAOUK J H, MERANEY A M, MURPHY D P, SUNG G T, et al. Laparoscopic partial nephrectomy for renal tumor:duplicating open surgical techniques[J]. J Urol, 2002, 167(2 Pt 1): 469–477. |
| [17] | CHUNG B I, LEE U J, KAMOI K, CANES D A, ARON M, GILL I S. Laparoscopic partial nephrectomy for completely intraparenchymal tumors[J]. J Urol, 2011, 186: 2182–2187. DOI: 10.1016/j.juro.2011.07.106 |
| [18] | 时佳子, 叶华茂, 徐志鹏, 吴震杰, 吕晨, 王林辉. 专用超声在机器人辅助腹腔镜肾部分切除术中的应用初探[J]. 临床泌尿外科杂志, 2016, 31: 29–30. |
| [19] | 陈雷, 林宁殊, 殷民, 许建挺, 张鹏. 腔内超声引导下腹腔镜肾部分切除术治疗完全肾内型肾肿瘤5例报告[J]. 临床泌尿外科杂志, 2015, 30: 231–234. |
| [20] | 刘溪, 潘秀武, 杨启维, 李霖, 黄海, 吕建敏, 等. 后腹腔镜下肾部分切除术治疗中度复杂性肾癌的方法改进及疗效分析(附84例报道)[J]. 临床泌尿外科杂志, 2016, 31: 533–537. |
| [21] | HUNG A J, CAI J, SIMMONS M N, GILL I S. "Trifecta" in partial nephrectomy[J]. J Urol, 2013, 189: 36–42. DOI: 10.1016/j.juro.2012.09.042 |
 2017, Vol. 38
2017, Vol. 38


