胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的消化道间叶源性肿瘤,可发生于胃肠道的任何地方,常见于胃,其次是小肠,直肠只占5% [1-2]。直肠来源的GIST恶性程度较高,特别是直肠下段肿瘤,其位置越低,保肛的难度亦越高,一旦发现,均应行早期手术切除。随着腹腔镜技术的发展,腹腔镜胃肠手术已在全国广泛开展,但有关腹腔镜治疗直肠间质瘤的文献较少,可能和直肠间质瘤发病率较低有关[3-4],特别是腹腔镜下局部切除术者更少见报道。本研究回顾性分析2013年5月—2016年12月在我科接受腹腔镜下直肠间质瘤手术患者的临床资料,探讨腹腔镜手术治疗直肠间质瘤的可行性及安全性。
1 资料和方法 1.1 研究对象回顾性分析2013年5月-2016年12月在我科接受腹腔镜下直肠间质瘤切除患者的围手术期及术后随访临床资料。本组患者共16例,其中男性10例、女性6例,平均年龄(56.0±12.6) 岁;主要表现为腹胀、肛门下坠感、便血,其中1例曾行腹腔镜胆囊切除术,1例曾行阑尾切除术,1例曾行子宫切除术。病例纳入标准:(1) 一般情况良好,无明显心肺功能障碍,肿瘤位于直肠,无远处转移;(2) 术前常规行肠镜、超声内镜、腹部CT和盆腔MRI或CT检查,用于评估肿瘤大小、侵犯情况、淋巴结情况、距肛缘距离及有无远处转移等;(3) 肿瘤大小均≤5 cm或经靶向治疗后缩小至5 cm以下;(4) 行局部切除手术者肿瘤均位于直肠侧壁,占据肠腔范围小于肠腔1/3圈。
1.2 手术方法肿瘤下缘距肛缘大于5 cm者行腹腔镜下直肠低位前切除术(Dixon术),肿瘤下缘距肛缘小于5 cm且大于3 cm者行腹腔镜下局部切除术,肿瘤下缘距肛缘小于3 cm且与周边组织界限不清者则行腹腔镜下腹会阴联合切除术(Miles术)。麻醉成功后,患者取平卧分腿位,臀下垫枕(1例Miles术患者取改良截石位)。于脐孔上缘作一长12 mm皮肤切口,穿刺置入12 mm套管后,插入腹腔镜探查腹腔,直视下于双侧肚脐水平下方脐旁3 cm处及反麦氏点穿刺置入直径5 mm套管各1只,麦氏点穿刺置入直径12 mm套管1只作为主操作孔,按腹腔镜直肠癌根治术原则行Dixon术或Miles术,所有患者常规保留左结肠及乙状结肠血管,离断支配肿瘤所在区域的直肠上血管。直肠分离按全直肠系膜切除术(total mesorectal excision, TME)原则进行。局部切除者:沿腹膜反折进入Denonvilliers筋膜间隙,锐性分离直肠前壁和两侧直肠侧韧带,暴露直肠肿块,不挤压肿瘤,沿肿块边缘1 cm完整切除肿块,将肿块套入标本袋,标本袋放入直肠缺损处并用卵圆钳经肛取出(图 1)。用3-0可吸收线全层缝合缺损肠壁后,用大量“洗必泰液”(醋酸氯己定冲洗剂0.25 g/500 mL)冲洗盆腔,并行注气试验明确吻合/口无气体溢出后,放置引流管于吻合口下方,观察无出血、无肠管损伤等情况后,关闭气腹,完成手术。切除标本常规送病理。
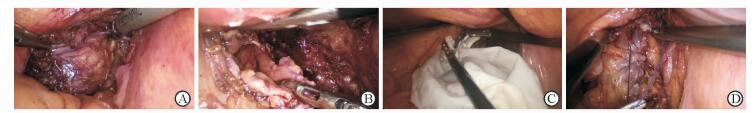
|
图 1 术中操作 A:间质瘤位于直肠右侧壁;B:标本切除后直肠缺损;C:卵圆钳经肛从直肠破损处取出肿瘤;D:创面完整缝合 |
1.3 术后处理
术后常规给予抗炎、抑酸、补液等对症支持治疗。观察有无出血、梗阻、吻合口漏等情况。
1.4 随访采用门诊复查和电话随访,随访8~40个月。根据最新NIH危险度分级[5],对低危患者每6个月进行1次腹部、盆腔CT或MRI检查,胸部CT检查每年1次;对中、高危患者,每3个月进行1次腹部、盆腔CT或MRI检查,3年后每6个月进行1次CT或MRI检查,胸部CT检查每年1次。末端回肠造口者术后3个月进行复查,若无复发及转移则行末端回肠造口还纳术。
2 结果 2.1 一般情况16例直肠间质瘤患者均在腹腔镜下成功切除肿瘤,未输血。平均肿瘤大小(3.5±1.0) cm,平均手术时间(103.0±23.8) min,平均住院时间(7.0±1.2) d,平均术中出血(14.0±4.1) mL。术后第2天均下床活动,术后2~3 d给予流质饮食。无中转开腹,无出血、梗阻、吻合口漏等并发症。术后病理证实间质瘤诊断,切缘阴性。根据最新NIH危险度分级,低危患者12例,高危患者4例。
2.2 手术方式12例肿瘤下缘距肛缘大于5 cm者行腹腔镜下直肠低位前切除术(Dixon术)。3例肿瘤下缘距肛缘小于5 cm且大于3 cm者行局部切除术,其中1例肿瘤大小为2 cm;另2例患者初次就诊时肿瘤大小均大于5 cm,术前细针穿刺病理证实为间质瘤,口服甲磺酸伊马替尼治疗半年后,肿瘤明显缩小(小于5 cm),见图 2。1例肿瘤下缘距肛缘小于3 cm且与周围组织界限不清,术前细针穿刺病理证实为间质瘤,给予甲磺酸伊马替尼治疗后,肿瘤大小无明显变化,遂行腹腔镜下腹会阴联合切除术(Miles术)。

|
图 2 1例局部切除者给予口服甲磺酸伊马替尼治疗半年后肿瘤缩小 A:初次就诊时直肠右侧壁间质瘤盆腔CT图像,肿瘤大小为6.8 cm,距肛缘3.0 cm,与前列腺界限不清;B:口服甲磺酸伊马替尼半年后盆腔CT图像,肿瘤缩小为2.0 cm;C:术后3个月复查CT影像 |
2.3 随访情况
随访8~40个月,无一例复发。根据NIH危险度分级,有4例为高危患者,术后给予甲磺酸伊马替尼治疗。1例患者因服药半年后乏力明显,自行停药,该患者于术后15个月转移至肝脏,患者未行进一步治疗,并于术后19个月死亡;1例患者术后21个月转移至肝脏,评估为无法切除,换用舒尼替尼治疗后效果不佳,术后28个月死于肝转移;其余2例高危患者术后给予甲磺酸伊马替尼治疗3年,均未复发。3例行局部切除者均未复发,肛门功能良好,目前仍在随访中。
3 讨论GIST来源于胃肠道的间叶组织,对放疗或化疗不敏感。直肠间质瘤的治疗仍以外科手术切除治疗为主[6],而且肿块需完整切除[7-8]。根据GIST规范化外科治疗专家共识,直肠间质瘤可以考虑在有经验的中心行腹腔镜下切除,术中遵循“非接触、少挤压”原则,术中必须使用标本袋[9]。对于肿瘤巨大(大于10 cm)、术中易出血、肿瘤距离肛缘较近者,可以考虑术前使用甲磺酸伊马替尼治疗[9],术前治疗时间目前认为以6个月为宜,并在术前1周停药,可以减小肿瘤体积,缩小手术范围,降低手术风险,增加保肛率[10-12]。本组16例患者均在腹腔镜下成功切除肿瘤,无一例中转开腹,术后无出血、梗阻、吻合口漏等并发症发生;其中1例因术中发现肠管水肿,考虑术前口服甲磺酸伊马替尼所致,行保护性造口术。2例低位直肠患者,术前口服甲磺酸伊马替尼治疗后肿瘤缩小,效果明显。
直肠间质瘤的切除有几种方法,包括局部切除、直肠前切除和腹会阴联合切除等,手术原则是完全切除,保持包膜的完整性,避免破裂[13-14]。手术方式的选择主要根据肿瘤的大小和发生部位,切除范围需综合考虑患者年龄、肿瘤恶性风险程度、所在部位、大小,保证两切缘无肿瘤细胞残留。是否使用腹腔镜手术需要考虑以下几个因素:(1) 患者心肺功能良好;肿瘤直径小于5 cm;低位直肠除前壁外均可考虑(若肿瘤位于直肠前壁,空间狭小,操作困难,肿瘤破裂的概率大大增高);若为女性子宫切除者,即使肿瘤位于直肠前壁也可考虑行腹腔镜下切除。(2) 未侵犯周围脏器。(3) 外科医生的经验和专业知识。无论使用哪种手术方式,应避免发生肿瘤破裂,因破裂后可能引起种植转移而影响无病生存期和总生存期。相比开腹手术,腹腔镜下切除具有手术创伤小、患者疼痛减轻,从而加快术后康复、缩短住院时间等优点;且骨盆空间狭小,开腹视野受限,腹腔镜在有限的空间里提供了比较好的放大视野,从而避免损伤,降低并发症发生率。结合本中心的经验,对于肿瘤直径小于5 cm者,推荐行腹腔镜下切除术,其中肿瘤下缘距肛缘大于5 cm者推荐行腹腔镜下经腹低位前切除术(Dixon术),肿瘤下缘距肛缘小于5 cm且大于3 cm者可以行腹腔镜下局部切除术,对于距肛缘小于3 cm且术前行甲磺酸伊马替尼治疗后肿瘤未见缩小、与周边组织界限不清等情况的患者则行腹腔镜下腹会阴联合切除术(Miles术)。
直肠间质瘤对于直肠腔和周围脏器的影响以推移改变为主,淋巴结发生转移的概率较低,主要转移途径为血行转移,低位直肠远处转移率更低,除非有明确的淋巴结转移迹象,通常不需要进行淋巴结清扫[15]。伍小军等[16]报道直肠间质瘤局部完全切除与广泛切除淋巴结清扫两种术式的生存率无明显差异。因此术中不需常规高位结扎离断肠系膜下动脉及行全直肠系膜切除术,但仍推荐按TME原则进行游离,因为在正确的解剖间隙内游离会减少出血和副损伤的可能,且能保护神经,降低术后排尿及性功能障碍发生率。本组16例行腹腔镜下直肠间质瘤切除患者术后无一例出现尿潴留等情况。
综上所述,对于直径小于5 cm的直肠间质瘤,腹腔镜手术治疗具有创伤小、恢复快、住院时间短等优点。但本研究样本量较小,腹腔镜治疗直肠间质瘤的具体手术适应证仍有待于多中心、前瞻性的大样本随机对照研究来确定。
| [1] | TRAN T, DAVILA J A, EL-SERAG H B. The epidemiology of malignant gastrointestinal stromal tumors:an analysis of 1, 458 cases from 1992 to 2000[J]. Am J Gastroenterol, 2005, 100: 162–168. DOI: 10.1111/ajg.2005.100.issue-1 |
| [2] | MIETTINEN M, FURLONG M, SARLOMO-RIKALA M, BURKE A, SOBIN L H, LASOTA J. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus:a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases[J]. Am J Surg Pathol, 2001, 25: 1121–1133. DOI: 10.1097/00000478-200109000-00002 |
| [3] | NOZAWA H, KANAZAWA T, TANAKA T, TAKAHASHI M, ISHIHARA S, SUNAMI E, et al. Laparoscopic resection of a gastrointestinal stromal tumor of the lower rectum in a patient with coronary artery disease following long-term neoadjuvant imatinib treatment and anticoagulation therapy[J]. World J Surg Oncol, 2014, 12: 211. DOI: 10.1186/1477-7819-12-211 |
| [4] | AKIYOSHI T, UENO M, FUKUNAGA Y, NAGAYAMA S, FUJIMOTO Y, KONISHI T, et al. Laparoscopic local excision and rectoanal anastomosis for rectal gastrointestinal stromal tumor:modified laparoscopic intersphincteric resection technique[J]. Dis Colon Rectum, 2014, 57: 900–904. DOI: 10.1097/DCR.0000000000000146 |
| [5] | JOENSUU H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39: 1411–1419. DOI: 10.1016/j.humpath.2008.06.025 |
| [6] | BISCHOF D A, KIM Y, BLAZER D G 3, BEHMAN R, KARANICOLAS P J, LAW C H, et al. Surgical management of advanced gastrointestinal stromal tumors:an international multi-institutional analysis of 158 patients[J]. J Am Coll Surg, 2014, 219: 439–449. DOI: 10.1016/j.jamcollsurg.2014.02.037 |
| [7] | 贺慧颖, 方伟岗, 钟镐镐, 李燕, 郑杰, 杜娟, 等. 165例胃肠道间质瘤中c-kit和PDGFRA基因突变的检测和临床诊断意义[J]. 中华病理学杂志, 2006, 35: 262–266. DOI: 10.3760/j.issn:0529-5807.2006.05.003 |
| [8] | FLETCHER C D, BERMAN J J, CORLESS C, GORSTEIN F, LASOTA J, LONGLEY B J, et al. Diagnosis of gastrointestinal stromal tumors:a consensus approach[J]. Hum Pathol, 2002, 33: 459–465. DOI: 10.1053/hupa.2002.123545 |
| [9] | 中华医学会外科学分会胃肠外科学组. 胃肠间质瘤规范化外科治疗专家共识[J]. 中国实用外科杂志, 2015, 35: 593–598. |
| [10] | CORLESS C L, FLETCHER J A, HEINRICH M C. Biology of gastrointestinal stromal tumors[J]. J Clin Oncol, 2004, 22: 3813–3825. DOI: 10.1200/JCO.2004.05.140 |
| [11] | BOSMAN F T, CARNEIRO F, HRUBAN R H, THEISE N D. WHO classification of tumours of the digestive system[M]. 4 ed. Lyon: IARC Press, 2010: 74-76. |
| [12] | SUZUKI S, SASAJIMA K, MIYAMOTO M, WATANABE H, YOKOYAMA T, MARUYAMA H, et al. Pathologic complete response confirmed by surgical resection for liver metastases of gastrointestinal stromal tumor after treatment with imatinib mesylate[J]. World J Gastroenterol, 2008, 14: 3763–3767. DOI: 10.3748/wjg.14.3763 |
| [13] | VON MEHREN M, RANDALL R L, BENJAMIN R S, BOLES S, BUI M M, CONRAD E U 3, et al. Soft tissue sarcoma, version 2.2016, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2016, 14: 758–786. DOI: 10.6004/jnccn.2016.0078 |
| [14] | ESMO/European Sarcoma Network Working Group. Gastrointestinal stromal tumours:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2014, 25(Suppl 3): iii21–iii26. DOI: 10.1093/annonc/mdu255 |
| [15] | AGAIMY A, VASSOS N, MÄRKL B, MEIDENBAUER N, KÖHLER J, SPATZ J, et al. Anorectal gastrointestinal stromal tumors:a retrospective multicenter analysis of 15 cases emphasizing their high local recurrence rate and the need for standardized therapeutic approach[J]. Int J Colorectal Dis, 2013, 28: 1057–1064. DOI: 10.1007/s00384-013-1655-3 |
| [16] | 伍小军, 万德森, 卢震海, 方淯靖, 彭志恒, 陈功, 等. 32例直肠间质瘤临床分析[J]. 广东医学, 2010, 31: 1324–1327. DOI: 10.3969/j.issn.1001-9448.2010.10.049 |
 2017, Vol. 38
2017, Vol. 38


