原发性肝癌(主要指肝细胞癌,hepatocellular carcinoma,HCC)是全球发病率和死亡率最高的恶性肿瘤之一。肝癌的发生、发展与慢性炎症密不可分,约80%~90%的肝癌患者有乙型肝炎或丙型肝炎感染史[1]。中国是肝癌大国,全世界一半以上的肝癌患者在中国[2]。手术切除、肝移植和局部消融治疗是目前主要的肝癌根治性治疗方式,然而绝大多数肝癌患者首诊时已是晚期,失去了根治性治疗的机会。经导管肝动脉插管化疗栓塞(transcatheter arterial chemoembolization,TACE)、局部放射治疗是针对中、晚期肝癌的常规局部治疗手段,而肝癌全身治疗方法包括全身化疗、靶向药物治疗、免疫治疗等,这些治疗措施有助于改善中、晚期肝癌患者的生存质量,一定程度上延长了患者的生存时间,但这些非根治性治疗手段仍亟待进一步发展。EACH研究虽证实肝癌的全身化疗方案(FOLFOX4) 对一部分晚期肝癌患者有效[3],但由于尚未达到主要的研究终点,因此仍未受到全世界同行的普遍认可;索拉菲尼(sorafenib)、瑞格非尼(regorafenib)是目前仅有的针对晚期肝癌有效的分子靶向药物,然而实际疗效仍远不能令人满意,其中位生存时间提高不足3个月[4-6]。
近年来,肿瘤免疫治疗呈现出突飞猛进的发展势态,肝癌作为一种治疗最为复杂的实体性肿瘤,在免疫治疗方面也取得了一些进展[7],但仍面临着重重难题,比如肝脏独有的免疫反应、理想抗原靶标的缺乏等。因此,要将生物免疫治疗真正应用到肝癌的临床实践中,显得任重而道远。
1 肝脏的免疫调控特点在生理情况下,肠道中的代谢产物与细菌能通过门脉系统进入肝脏,作为抗原刺激肝脏免疫系统,维持全身炎性稳态、保护组织完整性以及避免过度的自身免疫反应。肝脏通过下列机制进行免疫调控:(1) 下调协同刺激分子受体,如B7-1、B7-2等[8];(2) 上调肝抗原递呈细胞如肝窦内皮细胞(liver sinusoidal endothelial cell,LSEC)、Kupffer细胞上的程序性死亡因子1(programmed cell death 1,PD-1) 受体等[9];(3) 分泌细胞因子白介素10(interleukin 10, IL-10) 及转化生长因子β(transforming growth factor β,TGF-β)等[10-11]。与此类似,慢性肝炎病毒感染、自身免疫性肝炎、酒精性肝炎、非酒精性脂肪性肝炎等因素也常引起肝慢性炎症,上调肝抗原递呈细胞上免疫检查点抑制剂的表达[12],从而下调T细胞活性[13],甚至促进肿瘤的生长[14]。此外,癌周微环境中的肿瘤相关成纤维细胞能够释放免疫抑制分子,例如前列腺素E2、吲哚胺2, 3-双加氧酶等,抑制自然杀伤(natural killer,NK)细胞发挥其功能[15]。更有证据显示,肝移植和肝癌局部治疗的复发风险与浸润淋巴细胞的表型存在相关性:Th1细胞及其细胞因子IL-1α、IL-1β、IL-2、干扰素γ(interferon γ,IFN-γ)在肿瘤组织中高表达者往往预后较好;而Th2细胞及IL-4、IL-5、IL-10的上调可能预示着疾病的进一步发展[16]。也有研究证明PD1+CD8+细胞毒性T细胞和T-reg细胞的表达是肝癌总生存率和术后复发率的一个独立预测因素[17]。
2 肝癌免疫治疗方案目前针对肝癌的免疫治疗方案可大致分为3类(图 1):间接免疫性治疗、过继性免疫治疗和间接非免疫性治疗。
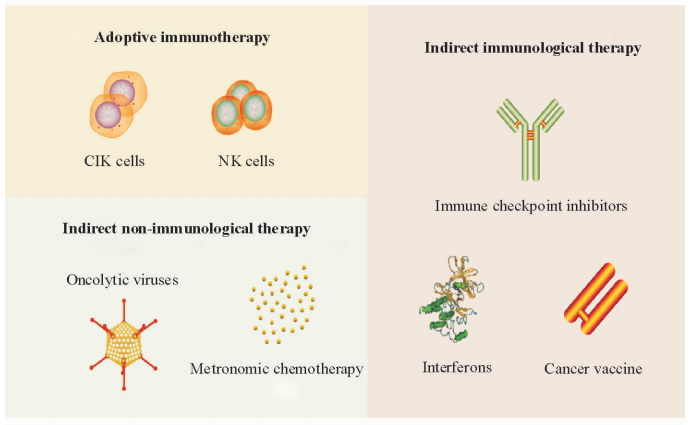
|
图 1 3种主要的肝癌免疫治疗方案 Fig 1 Three main strategies of immunotherapy for hepatocellular carcinoma CIK: Cytokine-induced killer; NK: Natural killer |
2.1 间接免疫性治疗
间接免疫性治疗又称为主动免疫治疗,是指通过激发自身内在免疫反应来对抗疾病(如肿瘤等)的一种疗法。目前肝癌相关的间接免疫性治疗主要为特异性主动免疫治疗,包括免疫检查点抑制剂、IFN以及肿瘤疫苗等。
2.1.1 免疫检查点抑制剂Tremelimumab是目前唯一应用于肝癌治疗的抗CTLA-4单抗,它能够干扰T细胞的激活与增殖。在Sangro等[18]的研究中,17例肝癌患者完成了tremelimumab治疗,其中部分缓解率(partial response rate, PRR)为17.6%,疾病控制率(disease control rate, DCR)达到76.4%,肿瘤进展时间(time to progression, TTP)为6.48个月。近期Duffy等[19]的研究采用tremelimumab联合射频消融术治疗进展期肝癌患者,中位TTP为7.4个月,中位生存时间为12.3个月。理论上,这两种疗法合用能够将局部肿瘤破坏并同时激活全身免疫系统。若肿瘤消融效果显著、肿瘤的快速生长趋势得到抑制,那么就能为后续免疫治疗赢得时间,获得更好的治疗效果。此外,局部肿瘤消融后凋亡坏死的肿瘤组织释放肿瘤相关抗原(tumor associated antigen, TAA),反向加速肿瘤趋向T细胞激活,协同加强免疫反应。肿瘤消融还与促炎性细胞因子的诱导释放以及抗原递呈细胞的激活有关,从而进一步协同参与免疫反应。
纳武单抗(nivolumab)是针对PD-1的单克隆抗体抑制剂,现应用于晚期非小细胞肺癌、黑素瘤的治疗。研究显示,约25%的肝癌患者体内PD-1与程序性死亡因子配体1(PD-L1) 高表达且IFN-γ诱导的信号转导通路被激活,对于这部分患者来说,采用纳武单抗治疗可能取得不错的效果[20]。El-Khoueiry等[21]将纳武单抗应用于治疗晚期肝癌,在Ⅰ期剂量爬坡试验(0.1~10 mg/kg)中48例患者都未达到最大耐受剂量(maximum tolerated dose, MTD),客观缓解率(objective response rate, ORR)达到15%(95% CI:6%~28%);在Ⅱ期扩展试验(3 mg/kg)中,214例肝癌患者的ORR达到20% (95% CI:15%~26%),中位反应持续时间(duration of response, DOR)为9.9个月,DCR达到64%,并且Ⅱ期扩展试验阶段6个月总生存率为83% (95% CI:78%~88%),9个月总生存率达到74%(95% CI:67%~79%)。该试验证明纳武单抗能提高晚期肝癌患者的总生存率且安全性尚可。
目前的临床试验正在探索将免疫检查点抑制剂与TACE联用治疗中期肝癌患者,或联合被动免疫疗法作为辅助疗法在肝癌切除手术后应用防止复发[22]。
2.1.2 IFN重组人类IFN是第1个应用于临床试验的肝癌免疫药物,这归功于其在治疗慢性病毒性肝炎中的广泛应用,及其具有抗血管生成与免疫刺激的特质。研究证实IFN-α、IFN-β、IFN-γ均能促进肝癌细胞的凋亡[23-25]。一项Ⅱ期临床试验比较了TACE与TACE联用IFN-α的疗效差异,结果显示两组中位无病生存期分别为20.3个月和23.6个月,中位总生存时间分别为26个月和29个月;另一项Ⅱ期临床试验评价了经动脉5-氟尿嘧啶(5-fluorouracil,5-FU)给药与聚乙二醇干扰素α-2b针对晚期肝癌合并门脉侵犯患者的疗效,报道的平均总生存时间为29.9个月[26]。一项动物实验证实索拉非尼合用IFN-α在裸鼠体内能够协同抑制Huh-7细胞株移植瘤生长,并显著促进肿瘤细胞坏死[27]。以上研究均显示出IFN单独或联合应用在肝癌治疗中的潜在临床价值。值得注意的是,虽然目前IFN在体外和小鼠体内取得了一定疗效,然而应用于临床疗效却欠佳。日后还需进一步评估IFN与索拉非尼等其他药物联用治疗肝癌患者的安全性和疗效。
2.1.3 肿瘤疫苗肿瘤疫苗旨在诱导机体产生肿瘤特异性免疫应答,通过效应T细胞缩小肿瘤体积、预防肿瘤复发。肿瘤疫苗可大致分为致敏树突状细胞(dendritic cell,DC)和多肽疫苗等。DC在先天免疫以及适应性免疫中都起到了关键作用,在肝癌患者外周血以及淋巴结中可观察到DC数量增加[28];并且若在肝癌手术切除后原病灶处发现DC浸润,往往预示着较好的预后[29]。Iwashita等[30]在一项Ⅰ期临床试验中发现,通过提取肝癌细胞裂解液中的自体细胞来致敏DC,可产生较好的抗肿瘤免疫反应。Mizukoshi等[31]在一项Ⅱ期临床试验中发现,与只接受TACE治疗的晚期肝癌患者相比,接受TACE联合体外致敏DC回输的晚期肝癌患者的肿瘤特异性免疫反应得到了增强,但两组患者的复发率没有显著差异。多肽疫苗主要有针对甲胎蛋白和针对磷脂酰肌醇蛋白聚糖3(glypican 3, GPC3) 两种。一项Ⅰ期临床试验发现,通过甲胎蛋白分化产生的疫苗能够促进患者体内的T细胞增殖[32]。Nobuoka等[33]在一项临床Ⅰ期试验中应用GPC3多肽疫苗治疗33例晚期肝癌患者,首次治疗2个月后的DCR达到了60.6%。在后续的Ⅱ期试验中,他们在手术或射频消融术后肝癌患者中使用了GPC3多肽疫苗,结果发现术后接种多肽疫苗的患者1年及2年复发率低于只接受了手术治疗的对照组(28.6% vs 54.3%,P=0.346;39.4% vs 54.5%, P=0.983)[34]。另一种潜在的治疗方案是将肿瘤疫苗与抗血管生成酪氨酸激酶抑制剂合用,比如联合索拉非尼[35]。
由此可见,肿瘤疫苗作为手术切除后的辅助治疗初步显现出一定的作用。然而作为最早应用于肿瘤免疫治疗的治疗方案,肿瘤疫苗虽然在近几十年的相关研究中取得了一定的进步,但目前仍缺乏Ⅲ期临床试验来证明其疗效。
2.2 过继性免疫治疗过继性免疫治疗是指通过协助患者自身免疫细胞识别肿瘤细胞上的特异性抗原,在体外培养、扩增至一定数量后再回输体内,达到直接杀伤肿瘤细胞的目的。常用的细胞有T细胞、细胞因子诱导的杀伤(cytokine-induced killer, CIK)细胞与NK细胞。
2.2.1 嵌合抗原受体T细胞免疫疗法(chemeric antigen receptor T-cell immunotherapy, CAR-T)CAR-T能够针对性杀灭表达特定抗原的肿瘤细胞,因其在治疗血液系统恶性肿瘤中所取得的疗效显著,已成为目前最热门的免疫疗法之一。已有不少基础研究和临床试验将CAR-T应用于治疗肝癌,且取得了一定进展。
Liu等[36]将体外诱导的甲胎蛋白抗原表位肽特异性T细胞注入HepG2小鼠模型体内,迅速且显著地抑制了肿瘤的生长,取得了显著的疗效。GPC3往往在肝癌中高表达,针对GPC3的CAR-T能够在体内准确消灭GPC3阳性的肝癌细胞[37]。GPC3羧基端能够诱导产生抗体依赖的细胞介导的细胞毒性作用从而杀灭肿瘤,Ishiguro等[38]利用这一点制备了针对GPC3的单抗,在小鼠体内取得了一定效果。此外,一系列GPC3靶向的CAR-T相关临床试验[39-40]正在进行。目前,验证CAR-T疗效与安全性的临床试验[41]已经开展,CAR-T联合介入治疗应用于晚期肝癌患者的临床Ⅱ期试验[42]也正在招募患者。
随着研究的推进,许多挑战与难题也渐渐浮现,如临床治疗效果不确切、是否需要联用其他肝癌治疗手段、如何改进现有CAR-T使其适用于肝癌等。若在日后这些挑战难题能够一一被攻克,相信CAR-T一定能在肝癌免疫治疗中取得突破性的进展。
2.2.2 CIK细胞CIK细胞是一类细胞的统称,包括CD3+CD56+、CD3+CD56-和CD3-CD56+的细胞群,它们能够直接杀灭肿瘤细胞。已有临床研究将CIK细胞疗法作为肝癌患者手术切除后的辅助治疗。一项大规模临床回顾性研究对比了206例单纯接受手术治疗的肝癌患者与204例在术后接受CIK细胞回输的肝癌患者的预后情况,发现单纯手术组和术后联合CIK细胞回输组之间患者的预后有显著差异,其5年生存率分别为50.2%和65.9%(P=0.000 7)[43]。与单纯手术相比,术后辅以CIK细胞回输治疗可明显改善患者预后,故CIK细胞有望成为一种新兴的肝癌切除术后常规辅助治疗。
2.2.3 NK细胞NK细胞寄居在网状内皮组织中,在免疫和抗肿瘤反应中起到关键作用。在Zerbini等[44]的研究中,37例肝癌患者在接受射频消融治疗后,体内自身NK细胞表型发生改变,从而导致其功能活化。可以预见,这种刺激所诱导的NK细胞激活将为肝癌患者带来全新的联合治疗策略。此外,单独扩增激活NK细胞同样具有较好的抗肿瘤作用——NK细胞能够下调肿瘤细胞表面的人白细胞分化Ⅰ类抗原,从而增强NK细胞介导的免疫监视作用[44]。
总而言之,现有的研究显示,肝癌的过继性免疫治疗取得了不错的疗效,特别是作为术后辅助治疗在杀伤肿瘤细胞中起到重要作用,这也推动了许多与该疗法有关的Ⅲ期临床试验的进行。
2.3 间接非免疫性治疗 2.3.1 溶瘤病毒溶瘤病毒对肿瘤的作用来源于两方面:通过病毒性复制诱导肿瘤细胞溶解;激活针对肿瘤抗原的细胞介导免疫反应。一项随机剂量探索的Ⅱ期临床试验对30例肝癌患者应用重组牛痘病毒JX-594进行治疗,该疗法耐受性良好,并且高剂量组的中位生存期明显高于低剂量组(14.1个月vs 6.7个月),初步验证了该疗法有一定效果[45]。目前,一项Ⅲ期临床试验正在开展,旨在比较该病毒疗法合用索拉非尼与单用索拉非尼对未经治疗的晚期肝癌患者的疗效(NCT02562755)[46]。溶瘤病毒临床应用前景光明,但还需Ⅲ期临床试验的结果进一步验证。
2.3.2 节律化疗(metronomic chemotherapy)节律化疗又称持续低剂量化疗,不仅可抑制肿瘤血管生成、直接杀伤肿瘤细胞,还能通过激活免疫、诱导肿瘤进入休眠状态发挥抗肿瘤功能,具有潜在的临床应用价值[47]。在一项Ⅱ期临床试验中,59例未经治疗的晚期肝癌患者及31例索拉非尼耐药患者每2 d服用500 mg卡培他滨(capecitabine),在这两个队列中,中位无进展生存期分别为6个月和14.4个月,患者耐受性也较好,然而关于该试验的免疫学分析还未开展[48]。目前关于节律化疗的研究仍比较有限,其可能涉及肿瘤细胞周期调控、免疫状态改变等一系列复杂的生物学行为的变化,仍有待更深入的基础研究来进一步明确。
3 肝癌免疫治疗的临床应用前景尽管生物免疫治疗被认为是能够彻底治愈恶性肿瘤的希望所在,并在某些实体恶性肿瘤的治疗上发挥了极为显著的疗效,然而,在肝癌的免疫治疗方面,至今仍未见革命性突破效果,肝癌免疫治疗药物的种类及其疗效仍然非常有限,针对肝癌免疫治疗的临床试验数量仍不多。究其原因,主要是由于肝脏所特有的免疫抑制状态和未能找到理想的相关抗原靶点。在推进肝癌免疫治疗的过程中,鉴于免疫系统在肝癌发生、发展中所起的特殊重要作用,应进行相关针对性研究以进一步揭示机体对于肝癌的免疫调控机制,开展更多关于肝癌免疫机制的基础研究,开发新型肝癌特异性抗原靶点,推动肝癌疫苗、特异性免疫疗法的发展,以供下一步的临床转化研究。而在肝癌免疫治疗的临床研究和实践探索中,有以下几个方面值得探讨:(1) 秉持精准医学理念。将精准医学融会贯通入免疫疗法中,争取为每例肝癌患者定制个体化治疗方案,以求更优的疗效、更快的疗程、更少的不良反应,尤其需重视基因检测在肝癌免疫治疗中的重要作用。(2) 治疗方案的综合应用。将免疫疗法与肝癌的常规治疗方案联合应用,如肝癌切除术后应用免疫治疗以降低复发率,TACE联合分子靶向药物及免疫治疗应用于晚期肝癌患者,这种综合应用应该以多学科诊疗(multidisciplinary team,MDT)的理念来贯彻,绝不是累加的方法越多越好,而是越有针对性越好,取各种治疗方案之长,以取得最佳的治疗效果以及可耐受的不良反应。(3) 重视肿瘤免疫微环境。改变肿瘤免疫逃逸状态,重新恢复炎症-抗炎平衡。
毫无疑问,传统的切除手术仍然是目前根治肝癌的最主要治疗方法,尤其是对于早期肝癌患者而言,术后5年总生存率可达70%以上[49]。因此,如何早期发现、早期诊断、早期根治性治疗仍然是提高肝癌人群总体疗效的重中之重,这就需要我们做到以下两点:一是要研发出更有效的肝癌诊断标志物,二是仍要重视肝癌高危人群的定期筛查和随访。肝癌的免疫治疗仍然处于试验阶段,虽然前景可期,但切不可盲目乐观。
生物免疫治疗是一个时下热门的治疗模式。然而,传统的并不意味终究要被淘汰,热门的也并不意味是永恒或准确无误的。肝癌的免疫治疗,究竟是会大放异彩,还仅仅是昙花一现,仍需要我们进行更多的基础和临床研究去进一步评判,需要以科学谨慎的态度拭目以待。笔者认为,肝癌免疫治疗要想取代肝癌根治性切除手术的主流地位,至少在短期内无法实现;不过可以预测的是,免疫治疗作为一种具有极大潜力的姑息性治疗方式,有希望成为治疗晚期肝癌的一种有效手段,从而弥补目前分子靶向药物在肝癌治疗领域的有限疗效;或者,作为肝癌根治性治疗以外的一种辅助治疗措施,在肝癌根治性手术后的抗复发转移方面发挥一定的作用。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66: 7–30. DOI: 10.3322/caac.21332 |
| [2] | YANG T, LU J H, WU M C. Hepatocellular carcinoma in China[J/OL]. Student BMJ, 2010, 18:c1026. doi:10.11361sbmj.c1026. |
| [3] | QIN S, BAI Y, LIM H Y, THONGPRASERT S, CHAO Y, FAN J, et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia[J]. J Clin Oncol, 2013, 31: 3501–3508. DOI: 10.1200/JCO.2012.44.5643 |
| [4] | LLOVET J M, RICCI S, MAZZAFERRO V, HILGARD P, GANE E, BLANC J F, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359: 378–390. DOI: 10.1056/NEJMoa0708857 |
| [5] | CHENG A L, KANG Y K, CHEN Z, TSAO C J, QIN S, KIM J S, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10: 25–34. DOI: 10.1016/S1470-2045(08)70285-7 |
| [6] | BRUIX J, QIN S, MERLE P, GRANITO A, HUANG Y H, BODOKY G, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE):a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2017, 389: 56–66. DOI: 10.1016/S0140-6736(16)32453-9 |
| [7] | SPRINZL M F, GALLE P R. Current progress in immunotherapy of hepatocellular carcinoma[J]. J Hepatol, 2017, 66: 482–484. DOI: 10.1016/j.jhep.2016.12.009 |
| [8] | KASSEL R, CRUISE M W, IEZZONI J C, TAYLOR N A, PRUETT T L, HAHN Y S. Chronically inflamed livers up-regulate expression of inhibitory B7 family members[J]. Hepatology, 2009, 50: 1625–1637. DOI: 10.1002/hep.23173 |
| [9] | OKAZAKI T, MAEDA A, NISHIMURA H, KUROSAKI T, HONJO T. PD-1 immunoreceptor inhibits B cell receptor-mediated signaling by recruiting src homology 2-domain-containing tyrosine phosphatase 2 to phosphotyrosine[J]. Proc Natl Acad Sci USA, 2001, 98: 13866–13871. DOI: 10.1073/pnas.231486598 |
| [10] | KNOLLE P, SCHLAAK J, UHRIG A, KEMPF P, MEYER ZUM BVSCHENFELDE K H, GERKEN G. Human Kupffer cells secrete IL-10 in response to lipopolysaccharide (LPS) challenge[J]. J Hepatol, 1995, 22: 226–229. DOI: 10.1016/0168-8278(95)80433-1 |
| [11] | BISSELL D M, WANG S S, JARNAGIN W R, ROLL F J. Cell-specific expression of transforming growth factor-beta in rat liver. Evidence for autocrine regulation of hepatocyte proliferation[J]. J Clin Invest, 1995, 96: 447–455. DOI: 10.1172/JCI118055 |
| [12] | MIAMEN A G, DONG H, ROBERTS L R. Immunotherapeutic approaches to hepatocellular carcinoma treatment[J]. Liver Cancer, 2012, 1(3/4): 226–237. |
| [13] | MOORMAN J P, WANG J M, ZHANG Y, JI X J, MA C J, WU X Y, et al. Tim-3 pathway controls regulatory and effector T cell balance during hepatitis C virus infection[J]. J Immunol, 2012, 189: 755–766. DOI: 10.4049/jimmunol.1200162 |
| [14] | BERTINO G, DEMMA S, ARDIRI A, PROITI M, MANGIA A, GRUTTADAURIA S, et al. The immune system in hepatocellular carcinoma and potential new immunotherapeutic strategies[J/OL]. Biomed Res Int, 2015, 2015:731469. doi:10.1155/2015/731469. |
| [15] | LI T, YANG Y, HUA X, WANG G, LIU W, JIA C, et al. Hepatocellular carcinoma-associated fibroblasts trigger NK cell dysfunction via PGE2 and IDO[J]. Cancer Lett, 2012, 318: 154–161. DOI: 10.1016/j.canlet.2011.12.020 |
| [16] | PRIETO J, MELERO I, SANGRO B. Immunological landscape and immunotherapy of hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2015, 12: 681–700. DOI: 10.1038/nrgastro.2015.173 |
| [17] | MARRA F, TACKE F. Roles for chemokines in liver disease[J]. Gastroenterology, 2014, 147: 577–594. DOI: 10.1053/j.gastro.2014.06.043 |
| [18] | SANGRO B, GOMEZ-MARTIN C, DE LA MATA M, IÑARRAIRAEGUI M, GARRALDA E, BARRERA P, et al. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C[J]. J Hepatol, 2013, 59: 81–88. DOI: 10.1016/j.jhep.2013.02.022 |
| [19] | DUFFY A G, ULAHANNAN S V, MAKOROVA-RUSHER O, RAHMA O, WEDEMEYER H, PRATT D, et al. Tremelimumab in combination with ablation in patients with advanced hepatocellular carcinoma[J]. J Hepatol, 2017, 66: 545–551. DOI: 10.1016/j.jhep.2016.10.029 |
| [20] | SIA D, JIAO Y, MARTINEZ-QUETGLAS I, KUCHUK O, VILLACORTA-MARTIN C, CASTRO DE MOURA M, et al. Identification of an immune-specific class of hepatocellular carcinoma, based on molecular features[J/OL]. Gastroenterology, 2017, pii:S0016-5085(17)35741-4. doi:10.1053/j.gastro.2017.06.007. |
| [21] | EL-KHOUEIRY A B, SANGRO B, YAU T, CROCENZI T S, KUDO M, HSU C, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040):an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389: 2492–2502. DOI: 10.1016/S0140-6736(17)31046-2 |
| [22] | WÖRNS M A, GALLE P R. Immune oncology in hepatocellular carcinoma-hype and hope[J]. Lancet, 2017, 389: 2448–2449. DOI: 10.1016/S0140-6736(17)31044-9 |
| [23] | HERZER K, HOFMANN T G, TEUFEL A, SCHIMANSKI C C, MOEHLER M, KANZLER S, et al. IFN-α-induced apoptosis in hepatocellular carcinoma involves promyelocytic leukemia protein and TRAIL independently of p53[J]. Cancer Res, 2009, 69: 855–862. DOI: 10.1158/0008-5472.CAN-08-2831 |
| [24] | LI P, DU Q, CAO Z, GUO Z, EVANKOVICH J, YAN W, et al. Interferon-γ induces autophagy with growth inhibition and cell death in human hepatocellular carcinoma (HCC) cells through interferon-regulatory factor-1(IRF-1)[J]. Cancer Lett, 2012, 314: 213–222. DOI: 10.1016/j.canlet.2011.09.031 |
| [25] | OBORA A, SHIRATORI Y, OKUNO M, ADACHI S, TAKANO Y, MATSUSHIMA-NISHIWAKI R, et al. Synergistic induction of apoptosis by acyclic retinoid and interferon-β in human hepatocellular carcinoma cells[J]. Hepatology, 2002, 36: 1115–1124. DOI: 10.1053/jhep.2002.36369 |
| [26] | KASAI K, USHIO A, KASAI Y, SAWARA K, MIYAMOTO Y, OIKAWA K, et al. Therapeutic efficacy of combination therapy with intra-arterial 5-fluorouracil and systemic pegylated interferon α-2b for advanced hepatocellular carcinoma with portal venous invasion[J]. Cancer, 2012, 118: 3302–3310. DOI: 10.1002/cncr.26648 |
| [27] | WANG L, JIA D, DUAN F, SUN Z, LIU X, ZHOU L, et al. Combined anti-tumor effects of IFN-α and sorafenib on hepatocellular carcinoma in vitro and in vivo[J]. Biochem Biophys Res Commun, 2012, 422: 687–692. DOI: 10.1016/j.bbrc.2012.05.056 |
| [28] | ORMANDY L A, FARBER A, CANTZ T, PETRYKOWSKA S, WEDEMEYER H, HORNING M, et al. Direct ex vivo analysis of dendritic cells in patients with hepatocellular carcinoma[J]. World J Gastroenterol, 2006, 12: 3275–3282. DOI: 10.3748/wjg.v12.i20.3275 |
| [29] | CAI X Y, GAO Q, QIU S J, YE S L, WU Z Q, FAN J, et al. Dendritic cell infiltration and prognosis of human hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2006, 132: 293–301. DOI: 10.1007/s00432-006-0075-y |
| [30] | IWASHITA Y, TAHARA K, GOTO S, SASAKI A, KAI S, SEIKE M, et al. A phase Ⅰ study of autologous dendritic cell-based immunotherapy for patients with unresectable primary liver cancer[J]. Cancer Immunol Immunother, 2003, 52: 155–161. |
| [31] | MIZUKOSHI E, NAKAMOTO Y, ARAI K, YAMASHITA T, SAKAI A, SAKAI Y, et al. Comparative analysis of various tumor-associated antigen-specific T-cell responses in patients with hepatocellular carcinoma[J]. Hepatology, 2011, 53: 1206–1216. DOI: 10.1002/hep.24149 |
| [32] | BUTTERFIELD L H, RIBAS A, MENG W S, DISSETTE V B, AMARNANI S, VU H T, et al. T-cell responses to HLA-A*0201 immunodominant peptides derived from α-fetoprotein in patients with hepatocellular cancer[J]. Clin Cancer Res, 2003, 9: 5902–5908. |
| [33] | NOBUOKA D, YOSHIKAWA T, SAWADA Y, FUJIWARA T, NAKATSURA T. Peptide vaccines for hepatocellular carcinoma[J]. Hum Vaccin Immunother, 2013, 9: 210–212. DOI: 10.4161/hv.22473 |
| [34] | SAWADA Y, YOSHIKAWA T, OFUJI K, YOSHIMURA M, TSUCHIYA N, TAKAHASHI M, et al. Phase Ⅱ study of the GPC3-derived peptide vaccine as an adjuvant therapy for hepatocellular carcinoma patients[J/OL]. Oncoimmunology, 2016, 5:e1129483. doi:10.1080/2162402X.2015. |
| [35] | KWILAS A R, DONAHUE R N, TSANG K Y, HODGE J W. Immune consequences of tyrosine kinase inhibitors that synergize with cancer immunotherapy[J/OL]. Cancer Cell Microenviron, 2015, 2:e677. doi:10.14800/ccm.677. |
| [36] | LIU H, XU Y, XIANG J, LONG L, GREEN S, YANG Z, et al. Targeting alpha-fetoprotein (AFP)-MHC complex with CAR T-cell therapy for liver cancer[J]. Clin Cancer Res, 2017, 23: 478–488. DOI: 10.1158/1078-0432.CCR-16-1203 |
| [37] | GAO H, LI K, TU H, PAN X, JIANG H, SHI B, et al. Development of T cells redirected to glypican-3 for the treatment of hepatocellular carcinoma[J]. Clin Cancer Res, 2014, 20: 6418–6428. DOI: 10.1158/1078-0432.CCR-14-1170 |
| [38] | ISHIGURO T, SUGIMOTO M, KINOSHITA Y, MIYAZAKI Y, NAKANO K, TSUNODA H, et al. Anti-glypican 3 antibody as a potential antitumor agent for human liver cancer[J]. Cancer Res, 2008, 68: 9832–9838. DOI: 10.1158/0008-5472.CAN-08-1973 |
| [39] | NCT02729493:a study of GPC3 redirected autologous T cells for advanced HCC (GPC3-CART)[EB/OL].[2017-07-15]. https://clinicaltrials.gov/ct2/show/NCT02729493. |
| [40] | NCT02723942:CAR-T cell immunotherapy for HCC targeting GPC3[EB/OL].[2017-07-15].https://www.clinicaltrials.gov/ct2/show/NCT02723942. |
| [41] | NCT02729493:study evaluating the efficacy and safety with CAR-T for liver sancer (EECLC)[EB/OL].[2017-07-15]. https://www.clinicaltrials.gov/ct2/show/NCT02729493. |
| [42] | NCT02959151:a study of chimeric antigen receptor T cells combined with interventional therapy in advanced liver malignancy[EB/OL].[2017-07-15]. https://www.clinicaltrials.gov/ct2/show/NCT02959151. |
| [43] | PAN K, LI Y Q, WANG W, XU L, ZHANG Y J, ZHENG H X, et al. The efficacy of cytokine-induced killer cell infusion as an adjuvant therapy for postoperative hepatocellular carcinoma patients[J]. Ann Surg Oncol, 2013, 20: 4305–4311. DOI: 10.1245/s10434-013-3144-x |
| [44] | ZERBINI A, PILLI M, LACCABUE D, PELOSI G, MOLINARI A, NEGRI E, et al. Radiofrequency thermal ablation for hepatocellular carcinoma stimulates autologous NK-cell response[J]. Gastroenterology, 2010, 138: 1931–1942. DOI: 10.1053/j.gastro.2009.12.051 |
| [45] | HEO J, REID T, RUO L, BREITBACH C J, ROSE S, BLOOMSTON M, et al. Randomized dose-finding clinical trial of oncolytic immunotherapeutic vaccinia JX-594 in liver cancer[J]. Nat Med, 2013, 19: 329–336. DOI: 10.1038/nm.3089 |
| [46] | NCT02562755:hepatocellular carcinoma study comparing vaccinia virus based immunotherapy plus sorafenib vs sorafenib alone (PHOCUS)[EB/OL].[2017-07-15]. https://clinicaltrials.gov/ct2/show/NCT02562755. |
| [47] | PASQUIER E, KAVALLARIS M, ANDRÉ N. Metronomic chemotherapy:new rationale for new directions[J]. Nat Rev Clin Oncol, 2010, 7: 455–465. DOI: 10.1038/nrclinonc.2010.82 |
| [48] | BRANDI G, DE ROSA F, AGOSTINI V, DI G S, ANDREONE P, BOLONDI L, et al. Metronomic capecitabine in advanced hepatocellular carcinoma patients:a phase Ⅱ study[J]. Oncologist, 2013, 18: 1256–1257. DOI: 10.1634/theoncologist.2013-0093 |
| [49] | HASEGAWA K, KOKUDO N, MAKUUCHI M, IZUMI N, ICHIDA T, KUDO M, et al. Comparison of resection and ablation for hepatocellular carcinoma:a cohort study based on a Japanese nationwide survey[J]. J Hepatol, 2013, 58: 724–729. DOI: 10.1016/j.jhep.2012.11.009 |
 2017, Vol. 38
2017, Vol. 38


