2. 上海中医药大学附属普陀医院中心实验室, 上海 200062
2. Central Laboratory, Putuo Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200062, China
化疗是恶性肿瘤的常用治疗方法,其抑瘤效果较好,但对人体伤害较大,尤其会造成肝肾损伤和免疫抑制[1]。中药具有多靶点抗肿瘤活性和较少的不良反应,近年来60%的抗癌新药直接或间接来源于天然药物[2]。灵芝为多孔菌科真菌干燥子实体,在《神农本草经》中被列为有效无毒的“上药”,有关其药用价值和有效成分的研究颇多[3]。近年研究表明,灵芝抗肿瘤的主要成分为三萜类化合物和灵芝多糖,其中三萜类化合物主要通过抑制肿瘤细胞增殖和促进肿瘤细胞凋亡直接杀伤肿瘤,多糖主要通过调节免疫功能、保护免疫器官、调节肿瘤微环境发挥间接抗肿瘤作用[4-7]。芝类提取物(Ganoderma lucidum extract,GLE)为赤芝[Ganoderma lucidum (Leyss. Ex Fr.) Karst]和紫芝[Ganoderma sinense Zhao, Xu et Zhang]提取物,主要含有12种三萜酸和3种灵芝多糖,已用于临床辅助治疗肿瘤20余年,通过临床疗效观察和分析发现,GLE具有抑制肿瘤生长、提高患者生存率、延长生存时间和改善生存质量的作用[8]。本研究通过观察癌性腹水大鼠腹水变化,脾、胸腺脏器指数,胸腺和骨髓细胞周期,外周血T淋巴细胞亚群和NK细胞比例,以及血清中细胞免疫因子的变化,探讨GLE对癌性腹水大鼠免疫功能的影响;并将GLE与顺铂比较,通过观察大鼠肾脏指数、肾功能,体现其无肾毒性优势。
1 材料和方法 1.1 主要仪器与试剂高精度电子天平,购自德国Sartorious StedimBiotech公司;台式高速冷冻离心机、台式低速离心机,购自德国Eppendorf公司;生物倒置显微镜,购自日本Olympus公司;ChipMate PMC-082型芯片小型离心机,购自日本Tomy公司;GenePix 4000B型芯片扫描仪,购自美国Axon Instruments公司;GALAXYS CO2培养箱,购自英国RSBiotech公司。T细胞亚群试剂盒、NK细胞试剂盒,购自美国eBioscience公司;细胞周期试剂盒、血清血溶素,购自上海优宁维生物科技有限公司;血清细胞因子蛋白芯片QAR-INF-1试剂盒,购自美国Raybiotech公司。GLE由上海民生中医大药业有限公司提供,批号:Q/ABF0004S;注射用生理盐水(0.9%氯化钠溶液)由辰欣药业股份有限公司提供,批号:16093152725;注射用顺铂(冻干型)由齐鲁制药有限公司提供,批号:0070332DC。
1.2 细胞株与实验动物Walker-256大鼠腹水癌细胞株(冻存2支,每支1 mL),购于上海子实生物科技有限公司;清洁级Wistar大鼠,雄性,体质量(100±5) g,共64只,购自上海市公共卫生中心[实验动物生产许可证号:SCXK(沪) 2005-0001],饲养于上海中医药大学附属普陀医院SPF级动物实验室[实验动物使用许可证号:SYXK(沪) 2005-0008]。
1.3 动物造模、分组及给药2支冻存Walker-256细胞株复苏后,用2 mL PBS重悬,每只大鼠给予0.5 mL,接种4只Wistar大鼠作为种鼠,10 d后颈椎脱臼法处死种鼠,用碘伏消毒腹部,抽取种鼠腹水60 mL,按1 mL/100 g接种于大鼠腹腔内(对照组除外)[9-10]。
60只Wistar大鼠称质量,随机分为6组,即对照组、模型组、低剂量GLE组、中剂量GLE组、高剂量GLE组和顺铂组,每组10只。造模后第2天,各组大鼠给予相应药物。低、中、高剂量GLE组大鼠给药方法:人与大鼠的药物换算系数为6.71,以人的体质量为60 kg计算,故100 g大鼠1 d所需总生药量(每日用药)=(15 g/60 kg)×0.1 kg×6.71=0.168 g;以人临床治疗量(15 g)为实验中剂量,按1:2:4的比例设立低剂量、中剂量和高剂量[0.84、1.68、3.36 g/(kg·d)]。药粉用生理盐水稀释,每天灌胃2次,每次2 mL,连续14 d。对照组和模型组大鼠均以生理盐水每天灌胃2次,每次2 mL,连续14 d。顺铂组以0.004 g/(kg·d)顺铂溶于0.2 mL生理盐水中,腹腔注射,于接种后第2天和第9天各1次。
1.4 测定各组大鼠腹水质量大鼠用10%水合氯醛0.3 mL/100 g麻醉后,沿腹中线剪开3.0 cm,将规格为2.5 cm×5.0 cm的已称量滤纸迅速塞入腹腔,3 min后待滤纸充分吸收腹水,取出称量,以滤纸2次称量之差记为腹水质量[11]。
1.5 脏器指数和肾功能检测用10%水合氯醛0.3 mL/100 g麻醉大鼠,摘取胸腺、脾脏、肾脏,用滤纸吸干残血后称量,记录各组胸腺、脾脏和肾脏质量,并计算胸腺指数、脾指数和肾指数。脏器指数计算公式:脏器指数(%) =脏器质量/体质量×100%。肾功能指标(血肌酐、尿素氮)由上海普陀区中心医院检验科检测。
1.6 胸腺和骨髓细胞周期检测取大鼠胸腺研磨后,用2 mL RPMI 1640培养液(美国Gibco公司)冲入试管制成细胞悬液,560×g离心5 min后,2 mL PBS洗涤2次,并经300目尼龙网过滤;缓慢混悬加入2 mL 4 ℃预冷的75%冰乙醇固定细胞,细胞固定后-20 ℃保存。30 min后560×g离心10 min去除乙醇,加2 mL PBS洗涤2次,560×g离心5 min弃上清。加0.5 mL PI/RNase制成细胞悬液,避光染色15 min后,流式细胞仪检测细胞周期。剃取大鼠股骨,用剪刀剪开股骨两端,用1 mL注射器吸取RPMI 1640培养液,将骨髓细胞沿股骨管腔冲入试管,检测细胞周期(方法同上)。
1.7 外周血T淋巴细胞亚群检测大鼠腹腔动脉采血1 mL,放入肝素抗凝管中轻轻摇匀后取50 μL,分别加入CD3-FITC 1 μL、CD4-Percp 1.25 μL、CD8-PE 1.25 μL,涡旋混匀后避光染色20 min,加入血清溶血素500 μL,混匀避光反应15 min。560×g离心5 min后弃去上清液,加入PBS 1.5 mL混匀,560×g离心5 min弃去上清液,如此反复2次。流式细胞仪检测并使用相关软件处理分析数据。
1.8 外周血NK细胞检测大鼠腹腔动脉采血1 mL放入肝素抗凝管中摇匀,取全血50 μL,分别加入CD3-FITC 1 μL、CD161-Percp 1.25 μL,涡旋混匀后避光染色20 min,加入血清溶血素500 μL,混匀避光反应15 min。560×g离心5 min后弃去上清液,加入PBS 1.5 mL混匀,560×g离心5 min弃去上清液,反复2次。560×g在沉淀中加入0.4 mL 1%多聚甲醛混匀待测。流式细胞仪检测并使用相关软件处理分析数据。
1.9 血清细胞因子蛋白芯片的检测取动脉血室温静置3 h后,1 960×g离心10 min,收集血清,将同组血清混合于同一离心管内取上层血清,5 600×g离心10 min,重复离心2次后将上清移至新离心管中。按照Raybiotech公司配套提供的杂交标准流程和试剂盒行芯片检测,依次进行血清稀释、芯片封闭、芯片杂交和芯片扫描,对扫描获取的芯片图像使用GenePix Pro 6.0软件读取原始数据,包括荧光信号、背景等。在数据分析时,一般使用去除背景的荧光信号FI(F532 Median-B532 Median)进行分析,荧光信号的强弱反映了该种因子表达量的高低。QAR-INF-1芯片共检测10种细胞因子,芯片上的每种抗体设置3次技术重复。进行数据分析时计算3次重复的均值,以此作为每种因子的信号值,然后以Positive Control进行样本间信号值的归一化,最后使用归一化后数据进行定量。
1.10 统计学处理应用SPSS 22. 0软件对数据进行处理。计量资料用x±s表示,样本均数比较采用Student’s t检验或单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 各组大鼠一般情况及GLE对腹水的影响对照组大鼠精神状态正常,摄食情况正常,皮毛等未见明显异常变化;模型组大鼠精神较差,摄食情况不佳,皮毛无光泽,活动能力下降。各药物组大鼠的活动、饮食及精神状况与模型组相比均较好,表现为活动、饮食、精神状况良好,整个用药过程中未见小鼠异常活动。与模型组相比,高、中、低剂量GLE组和顺铂组大鼠腹水质量均降低(P<0.05);而各剂量GLE组与顺铂组相比差异无统计学意义。见图 1。
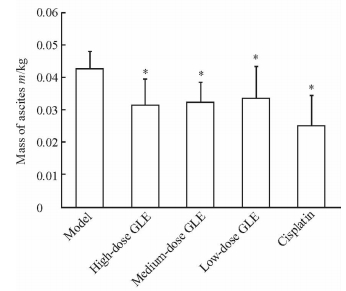
|
图 1 GLE对Walker-256腹水大鼠腹水质量的影响 Fig 1 Effect of GLE on mass of ascites in Walker-256 ascites rats The rats in low-dose, medium-dose and high-dose GLE groups were treated with 0.84, 1.68 and 3.36 g/(kg·d) GLE, respectively. The rats in the cisplatin group were intraperitoneally injected with 0.004 g/(kg·d) cisplatin in normal saline once a week. The rats in model group were treated with normal saline. GLE: Ganoderma lucidum extract. *P < 0.05 vs model group. n=10, x±s |
2.2 GLE对Walker-256腹水大鼠胸腺指数、脾指数、肾脏指数和肾功能的影响
与对照组相比,模型组和顺铂组大鼠胸腺指数均下降(P<0.05)。经GLE干预后,高、中剂量GLE组大鼠胸腺指数上升,与模型组相比差异有统计学意义(P<0.05)。顺铂组大鼠脾指数较对照组下降(P<0.05),其余各组间差异均无统计学意义。与对照组相比,模型组和顺铂组大鼠肾脏指数、血清肌酐和尿素氮均下降(P<0.05);高、中剂量GLE组较模型组肾脏指数提高,血肌酐和尿素氮值降低,差异有统计学意义(P<0.05)。见表 1。
|
|
表 1 GLE对Walker-256腹水大鼠胸腺指数、脾脏指数、肾脏指数和肾功能的影响 Tab 1 Effect of GLE on thymus, spleen and kidney indexes and renal function in Walker-256 ascites rats |
2.3 GLE对Walker-256腹水大鼠骨髓、胸腺细胞周期的影响
与对照组相比,模型组大鼠胸腺和骨髓细胞G0/G1期比例升高(P<0.05)。与模型组相比,低剂量GLE组胸腺细胞G0/G1期比例降低,高、中、低剂量GLE组S期和G2/M期比例均升高(P<0.05)。与模型组相比,高剂量GLE组骨髓细胞G0/G1期比例降低,高、中剂量组S期比例升高,高、低剂量组G2/M期比例升高(P<0.05)。相较对照组,顺铂组胸腺细胞和骨髓细胞G0/G1期比例均升高,S期比例均降低(P<0.05),表明顺铂组大鼠产生胸腺和骨髓抑制。见表 2。
|
|
表 2 GLE对Walker-256腹水大鼠胸腺和骨髓细胞周期的影响 Tab 2 Effect of GLE on cell cycles of thymus and bone marrow cells in Walker-256 ascites rats |
2.4 GLE对Walker-256腹水大鼠外周血T细胞亚群的影响
与对照组相比,模型组Walker-256腹水大鼠外周血CD4+细胞比例降低、CD8+细胞比例升高、CD4+/CD8+比值降低(P<0.05);经GLE干预后,与模型组相比,高剂量GLE组CD4+细胞比例升高、CD8+细胞比例降低,高、中剂量GLE组CD4+/ CD8+比值上升,差异均有统计学意义(P<0.05)。见表 3。
|
|
表 3 GLE对Walker-256腹水大鼠T细胞亚群影响 Tab 3 Effect of GLE on T cell subsets in Walker-256 ascites rats |
2.5 GLE对Walker-256腹水大鼠外周血NK细胞的影响
模型组和顺铂组大鼠的外周血NK细胞比例分别为0.085 2±0.010 4、0.024 3±0.003 0,较对照组的0.105 9±0.005 7均减少(P<0.05)。经GLE干预后,大鼠外周血NK细胞比例增加,高、中、低剂量GLE组的外周血NK细胞比例分别为0.139 5±0.006 9、0.105 3±0.010 9和0.117 8±0.028 0,与模型组相比差异均有统计学意义(P<0.05)。
2.6 GLE对Walker-256腹水大鼠血清细胞因子含量的影响与对照组和模型组相比,中剂量GLE组大鼠血清中干扰素γ(IFN-γ)、白介素(IL)-1α、IL-1β、IL-2和IL-10的含量均升高(P<0.05);与模型组相比,中剂量GLE组IL-4和肿瘤坏死因子α(TNF-α)的含量升高(P<0.05)。见表 4。
|
|
表 4 GLE干预后大鼠血清细胞因子含量变化 Tab 4 Changes of serum cytokine levels in rats after GLE treatment |
3 讨论
中医认为,“正气存内,邪不可干”,肿瘤的发生主要是由于机体正气不足,而中医的扶正抗癌通常是指对免疫系统的激发和保护[12]。研究表明灵芝具有良好的免疫调节作用和抗肿瘤活性,从而达到扶正抗癌的效果[3-7]。GLE为赤芝和紫芝提取物,具有抑制肿瘤生长、提高患者生存率、延长生存时间和改善生存质量的作用[8]。本实验结果表明,GLE可减有效减少Walker-256癌性腹水大鼠腹水量。在此基础上,研究进一步探究了其对Walker-256腹水大鼠免疫功能的影响及作用机制。
胸腺和脾是机体内的重要免疫器官。胸腺对机体免疫功能的建立及其免疫能力丧失后免疫调控功能的恢复具有重要作用,其产生T淋巴细胞并分泌胸腺素,发挥细胞免疫功能,成熟的胸腺细胞还可以随血液到达机体的外周器官协助B淋巴细胞;而脾是体内最大的淋巴器官,具有丰富的淋巴细胞和巨噬细胞,其中B淋巴细胞比例较大,与体液免疫关系密切[13-14]。胸腺和脾的质量降低一般因免疫抑制所致,因此它们可在一定程度上反映机体免疫细胞的数量和能力[13-15]。本研究结果表明,与对照组相比,模型组和顺铂组大鼠胸腺和肾脏指数均下降;经GLE干预后,大鼠胸腺和肾脏指数上升,表明Walker-256腹水大鼠出现胸腺和肾损伤,GLE可以改善胸腺和肾损伤。
胸腺和骨髓细胞往往会被阻滞在G0/G1期(DNA合成前期),导致S期(DNA合成期)和G2/M期(DNA合成后期和有丝分裂期)细胞比例减少,从而产生免疫抑制[12]。GLE可减少由癌性腹水导致的G0/G1期阻滞,其可诱导胸腺和骨髓细胞向G2/M和S期转化,表明GLE可以逆转胸腺和骨髓抑制。
肿瘤免疫主要是由细胞免疫来实现的,机体的细胞免疫功能一般由T淋巴细胞控制,外周血T细胞亚群又分CD4+辅助/诱导性T细胞和CD8+抑制性/细胞毒T细胞。肿瘤特异性的CD4+细胞可协助B细胞分泌抗体和调节其他T细胞的免疫应答,对肿瘤具有直接杀伤作用;CD8+细胞常表现出细胞毒活性,其比例愈高,免疫抑制愈强,患者的抵抗力愈弱。CD4+/CD8+比值平衡打乱将导致机体免疫反应紊乱[11, 16-18]。本研究中,模型组Walker-256腹水大鼠CD4+细胞比例较对照组降低,CD8+细胞比例升高,CD4+/ CD8+比值降低;GLE干预可增加大鼠外周血T淋巴细胞亚群活性和促使其正常分布,使外周血CD4+细胞比例升高、CD8+细胞比例降低、CD4+/CD8+比值上升,从而使Walker-256腹水大鼠免疫功能有不同程度的恢复。
NK细胞是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,也可分泌细胞因子调节其他免疫细胞的功能,是机体天然免疫的主要承担者[19]。本研究中,模型组和顺铂组大鼠的NK细胞比例与对照组相比均减少;而GLE干预后NK细胞比例增加,表明GLE可有效增加外周血NK细胞比例,从而增加肿瘤细胞的自然杀伤作用。
大量研究表明,灵芝多糖和灵芝提取物可明显促进巨噬细胞、NK细胞、T淋巴细胞活性,并诱导、促进免疫细胞生成IL-1α、IL-1β、IL-6、IL-4、IL-10、IL-12、TNF-α和IFN-γ,从而提高机体的免疫力,发挥抗肿瘤作用[20-25]。TNF-α是迄今为止发现的抗肿瘤作用最强的细胞因子,它能特异性直接杀伤肿瘤细胞,而对正常细胞无不良影响,抑制肿瘤细胞的增殖并促使其溶解,还可以激活机体的抗肿瘤免疫反应。本研究发现,与模型组相比,GLE可提高大鼠血清TNF-α的表达,从而增强抗肿瘤作用。IL-1是一种重要的炎症调节因子,IL-1α和IL-1β是IL-1家族两个重要的促效剂。分泌型IL-1β能激活炎症反应,促进肿瘤迁移;而膜型IL-1α可能具有促进抗肿瘤免疫反应的作用,这种作用体现为IL-1的“双面性”。让肿瘤部位选择性地表达膜型IL-1α及全身性抑制IL-1β既能增强抗肿瘤的免疫性又能抑制肿瘤迁移,从而更有效地控制肿瘤的生长和转移[26]。本研究结果表明,Walker-256腹水大鼠血清IL-1α和IL-1β含量均增高,GLE可能通过调节IL-1的表达影响免疫效应。IL-2能促进活化T细胞、NK细胞等免疫效应细胞的增殖、分化和细胞因子产生,增强杀伤活性,并可产生IFN-γ,因此,IL-2含量的高低在某种程度上反映了细胞免疫能力的强弱,也反映了机体抑制肿瘤细胞生长的能力[14, 27-28];IL-4能增强细胞的免疫原性,有效激活特异性细胞毒T细胞对肿瘤细胞的杀伤作用,还有抑制肿瘤细胞转移的作用[29]。本研究中GLE可有效刺激Walker-256腹水大鼠血清IL-2的表达,血清IL-4的表达也升高。IL-10最初被认为是具有免疫抑制作用的抗炎分子,通过直接和间接抑制T细胞的活化作用促进肿瘤的生长。近年来研究发现,IL-10还具有免疫活化作用,可以通过对T细胞和NK细胞的免疫活化作用或通过T细胞中IL-10信号通路的阻断作用提高抗肿瘤免疫功能,促进肿瘤特异性免疫监视并减少致病性炎症反应的发生,从而发挥双向免疫调节作用[30]。本研究发现,GLE促进Walker-256腹水大鼠血清IL-10的表达。上述研究提示GLE可能通过激发血清中免疫细胞因子的表达,发挥改善免疫和抑制腹水的作用。
综上,GLE可改善Walker-256腹水大鼠免疫功能,且与顺铂相比无免疫功能损害和肾脏损害,其深层次的抗肿瘤机制有待进一步研究。
| [1] | 赵若琳, 陈美娟, 赵凤鸣, 许冬青, 张旭, 周坤福. 斑蝥酸钠联合化疗药对肝癌的协同增效及其机制研究[J]. 中药材, 2014, 37: 1938–1946. |
| [2] | KHAZIR J, RILEY D L, PILCHER L A, DE-MAAYER P, MIR B A. Anticancer agents from diverse natural sources[J]. Nat Prod Commun, 2014, 9: 1655–1669. |
| [3] | 林志彬. 灵芝的现代研究[M]. 4版. 北京: 北京大学出版社, 2015: 3-5. |
| [4] | 亓子豪, 杨恭. 灵芝抗肿瘤作用机制的研究概述[J]. 中国药学杂志, 2012, 47: 1781–1784. |
| [5] | 王喜个. 灵芝多糖与灵芝三萜的抗肿瘤作用研究概况[J]. 医学信息, 2011, 24: 4969–4970. DOI: 10.3969/j.issn.1006-1959.2011.09.886 |
| [6] | 李晓冰, 赵宏艳, 郭栋. 灵芝多糖药理学研究进展[J]. 中成药, 2012, 34: 332–335. DOI: 10.3969/j.issn.1001-1528.2012.02.038 |
| [7] | 林志彬. 灵芝抗肿瘤作用的免疫学机制及其临床应用[J]. 中国药理学与毒理学杂志, 2015, 29: 865–882. DOI: 10.3867/j.issn.1000-3002.2015.06.001 |
| [8] | 赵若琳, 郭盈盈, 阮益亨, 孙娜娜, 孙增坤, 何裕民, 等. 中医为主治疗胰腺癌的疗效评价[J]. 中华中医药杂志, 2017, 32: 1313–1316. |
| [9] | 郭岩松, 柳海艳, 钟赣生, 许皖, 张建美, 刘珍清, 等. 甘遂半夏汤加减甘遂及不同品种甘草对腹水模型大鼠心肝肾功能的影响[J]. 环球中医药, 2016, 9: 527–533. DOI: 10.3969/j.issn.1674-1749.2016.05.003 |
| [10] | 李文婷, 周红光, 刘颖, 李沐涵, 李黎, 吴勉华. 消癌解毒方对移植性肝癌大鼠免疫功能影响研究[J]. 中华中医药学刊, 2015, 33: 1880–1883. |
| [11] | DOMENICALI M, CARACENI P, GIANNONE F, BALDASSARRE M, LUNCCHETTI G, QUARTA C, et al. A novel model of CCl4 induced cirrhosis with ascites in the mouse[J]. J Hepatol, 2009, 51: 991–999. DOI: 10.1016/j.jhep.2009.09.008 |
| [12] | 王勇, 司丽芳, 李相能, 李占生. 银杏叶提取物增强大鼠脾脏和胸腺的免疫功能[J]. 细胞与分子免疫学杂志, 2015, 31: 792–799. |
| [13] | 杨玲, 曹舫, 田云, 杨浩, 张琳. 四君子汤加减结合细胞因子诱导杀伤细胞对消化道恶性肿瘤患者免疫机制的影响[J]. 中国肿瘤临床与康复, 2016, 23: 1183–1185. |
| [14] | KOCH U, RADTKE F. Mechanisms of T cell development and transformations[J]. Annu Rev Cell Dev Biol, 2011, 27: 539–562. DOI: 10.1146/annurev-cellbio-092910-154008 |
| [15] | 白雪, 关宝生, 孙艳男, 张丽颖, 纪汉庭, 张涛. 八月札水提物对H22肝癌荷瘤鼠免疫功能的影响[J]. 中国老年学杂志, 2015, 35: 1946–1948. DOI: 10.3969/j.issn.1005-9202.2015.07.096 |
| [16] | 严健, 原永明, 张舒, 彭贤聪. CD3+、CD4+、CD8+ T淋巴细胞亚群在肿瘤患者外周血中检测的临床意义[J]. 检验医学, 2013, 28: 901–903. DOI: 10.3969/j.issn.1673-4130.2013.07.081 |
| [17] | ZANETTI M, CASTIGLIONI P, INGULLI E. Principles of memory CD8 T-cells generation in relation to protective immunity[J]. Adv Exp Med Biol, 2010, 684: 108–125. DOI: 10.1007/978-1-4419-6451-9 |
| [18] | MU J, JEYANATHAN M, SHALER C R, HORVATH C, DAMJANOVIC D, ZGANIACZ A, et al. Respiratory mucosal immunization with adenovirus gene transfer vector induces helper CD4 T cell-independent protective immunity[J]. Gene Med, 2010, 12: 693–704. DOI: 10.1002/jgm.1487 |
| [19] | 吴忠福, 唐锁勤, 赵安棣, 徐以兵. 自然杀伤细胞在肿瘤免疫治疗中的作用[J]. 中国生物化学与分子生物学报, 2011, 27: 1088–1093. |
| [20] | WANG P Y, ZHU X L, LIN Z B. Antitumor and immunomodulatory effects of polysaccharides from broken-spore of Ganoderma lucidum[J]. Front Pharmacol, 2012, 3: 135. |
| [21] | YUE G G, CHAN B C, HAN X Q, CHENG L, WONG E C, LEUNG P C, et al. Immunomodulatory activities of Ganoderma sinense polysaccharides in human immune cells[J]. Nutr Cancer, 2013, 65: 765–774. DOI: 10.1080/01635581.2013.788725 |
| [22] | TSAI C C, YANG F L, HUANG Z Y, CHEN C S, YANG Y L, HUA K F, et al. Oligosaccharide and peptidoglycan of Ganoderma lucidum activate the immune response in human mononuclear cells[J]. J Agric Food Chem, 2012, 60: 2830–2837. DOI: 10.1021/jf3000339 |
| [23] | HUANG S Q, LI J W, WANG Z, PAN H X, CHEN J X, NING Z X. Optimization of alkaline extraction of polysaccharides from Ganoderma lucidum and their effect on immune function in mice[J]. Molecules, 2010, 15: 3694–3708. DOI: 10.3390/molecules15053694 |
| [24] | ZHAO H, LUO Y, LU C, LIN N, XIAO C, GUAN S, et al. Enteric mucosal immune response might trigger the immunomodulation activity of Ganoderma lucidum polysaccharide in mice[J]. Planta Med, 2010, 76: 223–227. DOI: 10.1055/s-0029-1186055 |
| [25] | 李钦艳, 陈逸湘, 钟莹莹. 灵芝主要活性成分及其功能的研究进展[J]. 食药用菌, 2015, 23: 86–91. |
| [26] | 林丹丹, 刘海燕. 白细胞介素-1与肿瘤[J]. 免疫学杂志, 2010, 26: 1009–1106. |
| [27] | 魏静, 李金凤, 温成平, 范永升, 丁兴红. 桑黄多糖对肝癌H22荷瘤小鼠的治疗作用[J]. 中草药, 2016, 39: 2871–2873. DOI: 10.7501/j.issn.0253-2670.2016.16.016 |
| [28] | 陈莉, 吴丽娟, 胡宗海, 彭燕, 李继红, 栗群英. 消化系统肿瘤患者外周血T淋巴细胞亚群及NK细胞分析与临床意义[J]. 国际检验医学杂志, 2011, 32: 2306–2307. DOI: 10.3969/j.issn.1673-4130.2011.20.004 |
| [29] | GOCHEVA V, WANG H W, GADEA B B, SHREE T, HUNTER K E, GARFALL A L, et al. IL-4 induces cathepsin protease activity in tumor-associated macrophages to promote cancer growth and invasion[J]. Genes Dev, 2010, 24: 242–255. |
| [30] | 王佳丽, 刘丽华. IL-10对肿瘤免疫双向调节的研究进展[J]. 中国肿瘤生物治疗杂志, 2016, 23: 130–134. DOI: 10.3872/j.issn.1007-385X.2016.01.022 |
 2017, Vol. 38
2017, Vol. 38


