肺癌目前仍然是世界上发病率和死亡率最高的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有支气管肺癌病理类型的80%以上,其恶性程度高,疾病进展快,5年生存率仅约11%[1]。NSCLC侵袭转移及多药耐药是其临床治疗的两大难点,也是影响患者预后、导致死亡的主要原因。因此,阐明NSCLC转移的分子机制对其治疗和预后具有重要意义。
Yes相关蛋白1(Yes-associated protein 1,YAP1) 是Hippo信号通路下游关键转录因子[2-3]。Hippo/YAP1通路是近年新发现的一条细胞信号传导通路,可通过调节组织细胞增殖和凋亡平衡调控机体器官的大小。该通路调控异常可导致多种疾病的发生[2, 4],包括多种恶性肿瘤,如肝癌[5]、胆囊癌[6]、乳腺癌[7]、肺癌[8]、胰腺癌[9]和食管癌[10]等。目前认为YAP1基因可能是致癌基因,在许多肿瘤中高表达[6, 9-11]。例如,Li等[6]发现胆囊癌组织中YAP1及其靶蛋白AXL高表达,且该表达水平与不良预后相关。他们利用慢病毒载体介导的小干扰RNA沉默YAP1基因表达,通过减少细胞周期相关蛋白细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)、细胞分裂周期蛋白25A (CDC25A)和细胞周期蛋白A (cyclin A)的表达,致胆囊癌细胞停滞于S期,降低肿瘤细胞增殖;进一步的机制研究发现,AXL/MAPK信号途径参与了YAP1相关的肿瘤进展。本研究通过慢病毒介导的RNA干扰靶向抑制人NSCLC细胞株A549中YAP1基因的表达,研究YAP1是否作为癌基因调控NSCLC细胞的增殖及细胞周期,并探讨YAP1基因对A549细胞迁移、侵袭能力的影响。
1 材料和方法 1.1 材料慢病毒靶向YAP1干扰载体(si-YAP1)、慢病毒包裹的无关RNA载体(si-NC)均由中国人民解放军胸心外科研究所构建。人NSCLC细胞株A549购自中国科学院上海细胞库。小牛血清购自杭州四季青生物工程材料有限公司,DMEM培养液为美国Gibco公司产品,Transwell培养小室购自美国Millipore公司,YAP1抗体(货号:4912) 购自美国CST公司,RNase A、碘化丙啶(propidium iodide,PI)及GAPDH抗体(货号:SAB2701826) 购自美国Sigma公司,qPCR引物由TaKaRa公司合成及测序。
1.2 细胞培养及细胞感染A549细胞所用培养液为含10%小牛血清、100 μg/mL链霉素和100 IU/mL青霉素的DMEM培养液,置于37 ℃、5% CO2培养箱中培养,取对数生长期A549细胞进行细胞实验。A549细胞接种于24孔培养板培养,至密度约80%时,根据随机数字表,取3孔细胞计数,按感染复数(MOI)为150加入慢病毒载体si-YAP1(设为实验组);再取3孔细胞计数后,按MOI为150加入无关病毒载体si-NC(设为阴性对照组);另取3孔细胞计数后,加入PBS(设为空白对照组)。根据预实验确定的感染条件,利用滴度为1×109 TU/mL病毒原液60 μL与polybrene 3 μL感染数目为1.5×105的A549细胞。由于病毒质粒中含有编码的绿色荧光蛋白(GFP)基因,利用荧光显微镜可根据荧光强度估算细胞感染效率。以293T细胞作为参照。待293T细胞和各组A549细胞感染48 h后,随机选择5个视野计数,荧光显微镜下观察病毒感染情况,计算绿色荧光细胞占全部细胞的比例,即为感染效率。
1.3 qPCR检测YAP1 mRNA的表达本研究所用YAP1引物及β-actin引物序列根据文献[12]设计,由TaKaRa公司合成。引物序列:YAP1正向引物5′-CAG CAA CTG CAG ATG GAG AA-3′,反向引物5′-ACA TCC CGG GAG AAG ACA CT-3′;β-actin正向引物5′-CGT CTT CCC CTC CAT CGT-3′,反向引物5′-GAA GGT GTG GTG CCA GAT TT-3′。利用TRIzol试剂提取各组A549细胞的总RNA,经反转录反应得到cDNA后再采用TaqMan法进行qPCR反应并定量。qPCR反应条件为:94 ℃ 30 s、57 ℃ 40 s、72 ℃ 40 s,共32个循环;最后72 ℃延伸15 min。
1.4 蛋白质印迹法分析YAP1蛋白的表达A549细胞经慢病毒感染72 h后,收集细胞,用RIPA细胞裂解液提取细胞总蛋白,测定蛋白浓度。蛋白样品加样(50 μg/孔)、电泳、转膜、封闭,4 ℃冰箱过夜标记一抗YAP1(1:1 000比例稀释)和GAPDH(1:2 000比例稀释)。用TBST洗膜3次(10 min/次),37 ℃孵育1 h标记相应二抗,再用TBST洗膜3次(10 min/次)。曝光、显影及定影,扫描X线胶片,进行半定量分析。
1.5 CCK-8法检测细胞增殖能力慢病毒感染各组A549细胞72 h后,用0.25%胰酶消化细胞,再用含10%小牛血清的DMEM培养液稀释成密度为2×104/mL的细胞悬液,按100 μL/孔接种于96孔培养板,每个样本设3个复孔。细胞接种后水平放置于37 ℃、5% CO2及饱和湿度条件下培养。于细胞接种后24、48、72、96、120 h各取出一块96孔板,每孔加入10 μL CCK-8溶液,加完试剂后轻轻敲击培养板以帮助混匀。37 ℃培养箱中继续培养2 h,待形成的Formazan的量显色足够时,在酶标仪上测定450 nm处的光密度(D)值,绘制细胞生长曲线。实验重复3次。
1.6 流式细胞术检测细胞周期待各组A549细胞处于对数生长期后,收集细胞,铺板,每组3复孔,每孔100 μL(细胞数约为每孔2 000)。各组细胞经慢病毒处理48 h后,待细胞贴壁,收集细胞,加入70%冷乙醇,使细胞固定,过夜后用PBS清洗1次,再加入RNase A在37 ℃水浴中消化30 min,PI避光染色30 min,上流式细胞仪进行细胞周期分布检测,并计算凋亡期细胞所占比例。
1.7 Transwell实验体外检测细胞侵袭能力体外侵袭实验采用美国Millipore公司的聚碳酸酯膜(8 μm孔径)侵袭小室,以无血清DMEM培养液稀释Matrigel胶,使之浓度达4.0 μg/μL,并铺到Transwell上室,放在37 ℃孵育箱中,经30 min后Matrigel胶聚合成凝胶,进而成为基底膜。接着,在Transwell下室加入含5 g/mL纤维粘连蛋白(FN)的DMEM培养液,上室加入si-YAP1组或si-NC组细胞500 μL (细胞密度约106/mL),每组设3个复孔;在37 ℃孵育箱培养1 d后,丢弃上室培养液,取出上室,用湿棉签轻轻拭去未穿过膜的细胞,经0.1%结晶紫染色、PBS洗涤、风干后,用Clearmont双侧封片,放入80 ℃烤箱中烤干,利用荧光倒置显微镜观察拍照(100倍视野下)。计数方法为:在每张膜中央和周围部分各随机取3个视野,计数每个视野内穿膜的细胞数。实验重复3次。细胞数越多,表示细胞侵袭能力越强。
1.8 统计学处理所有数据应用SPSS 19.0软件进行统计分析。结果均以x±s表示,两组间比较采用t检验。检验水准(α)为0.05。
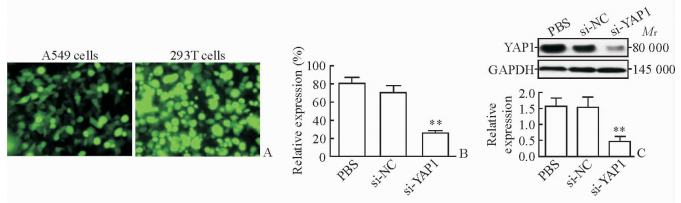
2 结果 2.1 慢病毒干扰A549细胞中YAP1表达的验证本研究中293T细胞和A549细胞的感染效率分别为(92.0±6.2)%和(81.0±3.6)%(图 1A)。分别收集感染48 h的si-YAP1组及si-NC组细胞,进行qPCR(图 1B)和蛋白质印迹法(图 1C)检测,结果显示干扰YAP1后YAP1 mRNA及蛋白的表达均低于si-NC组,差异有统计学意义(P < 0.01)。
|
图 1 慢病毒干扰A549细胞YAP1表达的验证结果 Fig 1 Lentivirus-mediated siRNA stably decreased YAP1 expression in A549 cells A: Infection efficiency in A549 cells was estimated by fluorescent micrograph (original magnification: ×200); B: qPCR was used to assay YAP1 mRNA expression in A549 cell lines; C: Infection efficiency in A549 cells was estimated by Western blotting analysis. YAP1: Yes-associated protein 1. **P < 0.01 vs si-NC group. n=3, x±s |
2.2 靶向RNA干扰YAP1后A549细胞的增殖情况
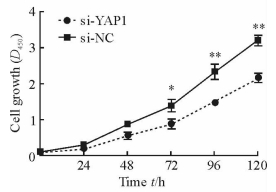
为了检测YAP1对A549细胞增殖的影响,我们采用CCK-8试剂盒比较干扰YAP1的表达后A549细胞的增殖情况。从24 h后si-NC组细胞增殖开始快于si-YAP1组, 72 h后两组差异有统计学意义(P < 0.05,P < 0.01;图 2),说明下调YAP1的表达能够抑制A549细胞的增殖。
|
图 2 靶向沉默YAP1对A549细胞增殖的影响 Fig 2 Effect of YAP1 silencing on A549 cell proliferation YAP1: Yes-associated protein 1. *P < 0.05, **P < 0.01 vs si-YAP1 group. n=3, x±s |
2.3 沉默YAP1对A549细胞周期及凋亡的影响
为了解沉默YAP1对A549细胞周期的影响,本研究将si-YAP1组及si-NC组的细胞周期进行比较。结果如表 1所示,沉默YAP1后,A549细胞周期停滞于G0/G1的细胞较si-NC组增加(P=0.001),而S期((P=0.041) 及G2/M期((P=0.009) 的细胞与si-NC组相比均减少;沉默YAP1后A549细胞凋亡较si-NC组也增加(P < 0.001)。
|
|
表 1 靶向沉默YAP1对细胞周期的影响 Tab 1 Effect of YAP1 silencing on A549 cell cycle progression |
2.4 沉默YAP1对A549细胞侵袭及迁移能力的影响
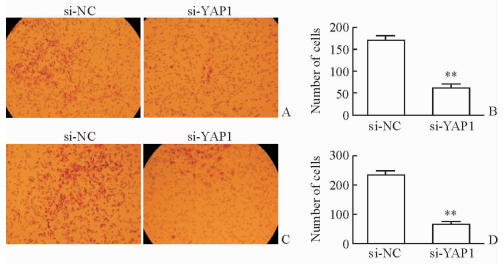
Transwell实验结果(图 3)示,si-NC组每个100倍视野穿过不含Matrigel滤膜的平均细胞数为228±13,高于si-YAP1组(78±14,P < 0.01)。同样,si-NC组每个100倍视野穿过含Matrgel滤膜的平均细胞数为178±11,高于si-YAP1组(68±12,P < 0.01)。说明YAP1基因沉默后A549细胞的迁移和侵袭能力受到抑制。
|
图 3 靶向沉默YAP1对A549细胞侵袭(A,B)及迁移(C,D)能力的影响 Fig 3 Effect of YAP1 silencing on invasion (A, B) and migration (C, D) of A549 cells YAP1: Yes-associated protein 1. Original magnification: ×100 (A, C). **P < 0.01 vs si-NC group. n=3, x±s |
3 讨论
Hippo/YAP1是近年来发现的可通过调节细胞增殖和凋亡平衡,调控器官体积的信号分子转导通路。近年研究表明,Hippo/YAP1信号通路转导异常与多种疾病的发生、发展密切相关[2, 10]。Sudol等[13]于1995年首先报道了YAP1蛋白,人类YAP1基因位于11q13染色体,YAP1蛋白的相对分子质量约65 000,作为Hippo信号通路下游重要的转录因子,其在正常机体细胞内发挥信号转导和基因转录调节的作用。
本实验构建靶向YAP1基因的慢病毒干扰载体,感染肺癌细胞株A549和工具细胞293T,72 h后荧光显微镜显示沉默效率大于80%,说明构建的慢病毒干扰载体si-YAP1可有效沉默YAP1表达,可用于下一步实验。qPCR及蛋白质印迹法结果都证明A549细胞感染YAP1慢病毒干扰载体后,YAP1的mRNA和蛋白表达均下调,而无关病毒载体对YAP1的mRNA和蛋白表达没有明显影响,说明靶向YAP1的小干扰RNA可高效沉默A549细胞YAP1基因及蛋白的表达。
细胞过度增殖、细胞周期失控是肿瘤发生的重要生物学基础。Tschaharganeh等[14]的研究发现在人肝癌细胞和鼠肝细胞中Notch信号通路配体Jagged-1(Jag-1) 表达增加,激活Notch信号通路,进而调控肝癌细胞增殖、迁移及侵袭。进一步研究发现,这一过程需YAP1与其转录伴侣TEAD4结合,Mst1/2而不是β-catenin的存在保证了TEAD4的结合。本实验结果显示,与阴性对照相比,YAP1基因沉默后,A549细胞增殖能力降低。细胞增殖是通过细胞周期的运行来实现的,若细胞的正常周期阻滞功能失调,则导致细胞增殖失控,最终形成肿瘤。流式细胞实验结果发现,YAP1基因沉默后A549细胞周期的分布发生变化,S期的细胞比例减少,G0/G1期细胞比例增加,凋亡细胞增加。以上结果提示,YAP1基因促进细胞增殖可能和细胞周期改变有关,具体机制是否与细胞周期蛋白的激活调控有关尚需进一步研究。
肿瘤的侵袭和转移是一系列多因素、多信号通路相互作用的结果。研究表明,过表达YAP1基因能促进癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT)[15],EMT与恶性肿瘤细胞侵袭转移能力及临床预后密切相关[16]。例如,Shao等[15]发现,在肺癌中YAP1与KRAS共同作用活化转化因子FOS,从而可能通过激活EMT相关的信号通路促进小鼠肺癌复发、侵袭及转移。
本研究表明慢病毒载体介导的小干扰RNA可有效抑制人NSCLC细胞株A549中YAP1 mRNA和蛋白的表达,从而抑制细胞增殖、侵袭。进一步研究YAP1在肿瘤侵袭、转移中的调节机制将有助于发现新的抗肿瘤靶点。
| [1] | JEMAL A, SIEGEL R, XU J, WARD E. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60: 277–300. DOI: 10.3322/caac.20073 |
| [2] | KODAKA M, HATA Y. The mammalian Hippo pathway:regulation and function of YAP1 and TAZ[J]. Cell Mol Life Sci, 2015, 72: 285–306. DOI: 10.1007/s00018-014-1742-9 |
| [3] | YEUNG B, YU J, YANG X. Roles of the Hippo pathway in lung development and tumorigenesis[J]. Int J Cancer, 2016, 138: 533–539. DOI: 10.1002/ijc.29457 |
| [4] | ZANCONATO F, CORDENONSI M, PICCOLO S. YAP/TAZ at the roots of cancer[J]. Cancer Cell, 2016, 29: 783–803. DOI: 10.1016/j.ccell.2016.05.005 |
| [5] | XU M Z, YAO T J, LEE N P, NG I O, CHAN Y T, ZENDER L, et al. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma[J]. Cancer, 2009, 115: 4576–4585. DOI: 10.1002/cncr.v115:19 |
| [6] | LI M, LU J, ZHANG F, LI H, ZHANG B, WU X, et al. Yes-associated protein 1(YAP1) promotes human gallbladder tumor growth via activation of the AXL/MAPK pathway[J]. Cancer Lett, 2014, 355: 201–209. DOI: 10.1016/j.canlet.2014.08.036 |
| [7] | YU S J, HU J Y, KUANG X Y, LUO J M, HOU Y F, DI G H, et al. MicroRNA-200a promotes anoikis resistance and metastasis by targeting YAP1 in human breast cancer[J]. Clin Cancer Res, 2013, 19: 1389–1399. DOI: 10.1158/1078-0432.CCR-12-1959 |
| [8] | NISHIKAWA E, OSADA H, OKAZAKI Y, ARIMA C, TOMIDA S, TATEMATSU Y, et al. miR-375 is activated by ASH1 and inhibits YAP1 in a lineage-dependent manner in lung cancer[J]. Cancer Res, 2011, 71: 6165–6173. DOI: 10.1158/0008-5472.CAN-11-1020 |
| [9] | KAPOOR A, YAO W, YING H, HUA S, LIEWEN A, WANG Q, et al. Yap1 activation enables bypass of oncogenic Kras addiction in pancreatic cancer[J]. Cell, 2014, 158: 185–197. DOI: 10.1016/j.cell.2014.06.003 |
| [10] | SONG S, AJANI J A, HONJO S, MARU D M, CHEN Q, SCOTT A W, et al. Hippo coactivator YAP1 upregulates SOX9 and endows esophageal cancer cells with stem-like properties[J]. Cancer Res, 2014, 74: 4170–4182. DOI: 10.1158/0008-5472.CAN-13-3569 |
| [11] | MURAMATSU T, IMOTO I, MATSUI T, KOZAKI K, HARUKI S, SUDOL M, et al. YAP is a candidate oncogene for esophageal squamous cell carcinoma[J]. Carcinogenesis, 2011, 32: 389–398. DOI: 10.1093/carcin/bgq254 |
| [12] | 胡光辉, 徐亮, 赖鹏, 郭锥锋, 刘欢, 刘敏, 等. RNA干扰YAP基因对人膀胱癌T24细胞株增殖和迁移能力的影响[J]. 中国癌症杂志, 2014, 24: 406–411. DOI: 10.3969/j.issn.1007-3969.2014.06.002 |
| [13] | SUDOL M, BORK P, EINBONG A, KASTURY K, DRUCK T, NEGRINI M, et al. Characterization of the mammalian YAP (Yes-associated protein) gene and its role in defining a novel protein module, the WW domain[J]. J Biol Chem, 1995, 270: 14733–14741. DOI: 10.1074/jbc.270.24.14733 |
| [14] | TSCHAHARGANEH D F, CHEN X, LATZKO P, MALZ M, GAIDA M M, FELIX K, et al. Yes-associated protein up-regulates Jagged-1 and activates the Notch pathway in human hepatocellular carcinoma[J]. Gastroenterology, 2013, 144: 1530–1542. DOI: 10.1053/j.gastro.2013.02.009 |
| [15] | SHAO D D, XUE W, KRALL E B, BHUTKAR A, PICCIONI F, WANG X, et al. KRAS and YAP1 converge to regulate EMT and tumor survival[J]. Cell, 2014, 158: 171–184. DOI: 10.1016/j.cell.2014.06.004 |
| [16] | YAMADA S, FUCHS B C, FUJII T, SHIMOYAMA Y, SUGIMOTO H, NOMOTO S, et al. Epithelial-to-mesenchymal transition predicts prognosis of pancreatic cancer[J]. Surgery, 2013, 154: 946–954. DOI: 10.1016/j.surg.2013.05.004 |
 2017, Vol. 38
2017, Vol. 38


