2. 复旦大学药学院药剂学教研室, 上海 201203
2. Department of Pharmaceutics, School of Pharmacy, Fudan University, Shanghai 201203, Chinas
生物大分子经口服给药是近年来药剂学领域最具挑战的研究方向之一。胃肠道的生理环境十分复杂,经口服进入胃肠道的生物大分子物质(如蛋白质、多肽等)会被胃酸、各种酶类(如胰蛋白酶)降解;另外,由于生物大分子相对分子质量和直径较大,难以透过小肠上皮进入体循环。因此,生物大分子口服给药的生物利用度极低,难以达到有效治疗浓度[1-2]。近年来,众多学者对此展开研究,发现采用纳米载体可有效保护生物大分子,减少其在胃肠道内的降解,并能够通过M细胞途径经淋巴吸收[3-4]。尽管有关研究较多,但纳米粒经口服的体内命运与作用机制尚不清楚。因此,我们以聚乙二醇(polyethylene glycol,PEG)化的聚己内酯(polycaprolactone,PCL)纳米粒为模型考察其经口服给药的体内过程。
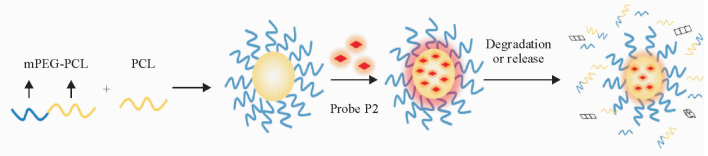
为在体内识别纳米粒并对其进行定量分析,我们采用一种新型的水淬灭荧光探针标记纳米粒,使用小动物活体成像系统进行体外信号捕捉与分析[5-9]。所使用的探针具有氮杂氟硼二吡咯(aza-boron-dipyrromethene,aza-BODIPY)母核结构,是一类近红外荧光探针,具有量子产率高、摩尔吸收系数强、化学稳定性好、灵敏度高、易于检测等优点。前期工作发现,部分该类探针具有芳香平面结构,在水环境中因为疏水作用会发生π-π堆叠,团聚形成激基缔合物和激基复合物,使荧光发生淬灭,即所谓的聚集导致的淬灭(aggregation-caused quenching,ACQ)效应[5]。其中最常用的P2探针最大激发、发射波长分别为708、732 nm,发射波长属于近红外区域,在该波长范围内动物自体荧光干扰较少,因此适用于小动物活体成像研究。在生物发光领域,ACQ效应通常被认为是不利的,但我们恰好利用P2探针的这一特性实现对纳米粒的体内识别,有效地与游离探针信号进行区分。当P2探针分散于纳米粒骨架中时保持激发状态,发出荧光信号(On),一旦纳米粒在介质中被破坏,P2探针即被释放进入水环境中快速聚集,因ACQ效应发生荧光淬灭(Off)[5-7],见图 1。然而,保留在纳米粒骨架中的P2探针依然可发射荧光信号,游离探针的干扰信号被大大减弱,因此观察到的荧光信号即代表纳米粒的信号。通过P2探针信号的“On-Off”状态切换可以实时监测纳米粒在体内外的完整性。
|
图 1 水淬灭探针信号代表纳米粒原理示意图 Fig 1 Scheme of rationale of water-quenching dyes as probes to monitor structural alterations of nanoparticles mPEG: Methoxy polyethylene glycol; PCL: Polycaprolactone |
本文旨在制备包载P2探针的PCL纳米粒和单甲氧基聚乙二醇-聚己内酯(methoxy polyethylene glycol-polycaprolactone,mPEG-PCL)纳米粒,并对其体外特性与稳定性进行评价,为进一步的体内外评价奠定基础。
1 材料和方法 1.1 仪器与材料SCIENTZ-ⅡD探头超声仪(宁波新芝生物科技股份有限公司);AH100D高压均质机(加拿大ATS公司);SHZ-C型水浴恒温振荡器(上海浦东物理光学仪器厂);Cary Eclipse荧光分光光度计(美国Agilent公司);FiveEasy实验室pH计(瑞士METTLER TOLEDO公司);Zetasizer Nano激光粒度和表面电位分析仪(英国Malvern公司);IKA Werke RT10恒温磁力搅拌器(德国IKA公司);透射电子显微镜(日本电子株式会社)。
P2探针(本实验室合成);PCL(相对分子质量45 000)、聚乙烯醇(polyvinyl alcohol,PVA;相对分子质量为13 000~23 000,醇解度87.0%~89.0%,美国Sigma公司);mPEG5k-PCL、mPEG2k-PCL(四川大学生物治疗国家重点实验室钱志勇教授提供);禁食状态模拟小肠液(fasted-state simulated intestinal fluid,FaSSIF)、饮食状态模拟小肠液(fed-state simulated intestinal fluid,FeSSIF)、禁食状态模拟胃液(fasted-state simulated gastric fluid,FaSSGF)预混合粉末(英国Biorelevant公司);其他试剂均为分析纯。
1.2 mPEG-PCL纳米粒的制备与表征采用乳化-溶剂挥发法[10-12]进行制备。200 mg PCL溶于5 mL二氯甲烷中,加入1 mL质量浓度为100 μg/mL的P2探针二氯甲烷储备液,制成有机相;200 mg PVA溶于20 mL去离子水中制成水相。将有机相加入水相中在探头超声的作用下形成初乳,初乳室温下磁力搅拌除去有机溶剂,即得PCL纳米粒。
将80 mg mPEG-PCL加入上述初始有机相中,按相同的步骤操作,即得mPEG-PCL纳米粒,选择具有不同mPEG链长(mPEG5k、mPEG2k)的mPEG-PCL嵌段共聚物可制备不同包被程度的纳米粒。
纳米粒以去离子水稀释20倍后,于25 ℃测定粒径、粒径分布和表面电位,粒径以强度径表示。用荧光分光光度计测定荧光强度,激发、发射波长分别为708、732 nm。纳米粒形态采用透射电子显微镜观察,样品滴于铜网上,以1%醋酸铀负染,自然干燥后观察。
1.3 不同pH值缓冲溶液的配制参照2015版《中华人民共和国药典》通则项下试剂试液标准品配制方法,经适当调整配制实验所需不同pH缓冲溶液,具体配制方法如下:
pH 4.5的醋酸-醋酸钠缓冲液(ABS):取醋酸钠18 g,加冰醋酸9.8 mL,再加水稀释至1 000 mL,即得。
pH 6.8的磷酸盐缓冲液(PBS):取0.2 mol/L磷酸二氢钾溶液250 mL,加0.2 mol/L氢氧化钠溶液118 mL,用水稀释至1 000 mL,摇匀,即得。
pH 7.4的PBS:取磷酸二氢钾1.36 g,加0.1 mol/L氢氧化钠溶液79 mL,用水稀释至200 mL,即得。
pH 1.2的盐酸(HCl)缓冲液:精密量取9 mL浓盐酸,用纯水稀释至1 000 mL,即得。
1.4 模拟生理介质的配制参照《美国药典》(USP-37) 所载方法,经适当调整配制模拟胃液(SGF):取2.0 g氯化钠和3.2 g胃蛋白酶(每毫克800~2 500个活度单位),加入7.0 mL盐酸和水使溶解至1 000 mL,即得。
采用FaSSIF、FeSSIF、FaSSGF预混合粉末,按照文献[13]方法,经适当调整配制成介质(组分及浓度详见表 1)。
|
|
表 1 FaSSGF、FaSSIF和FeSSIF的组成 Tab 1 Compositions of FaSSGF, FaSSIF and FeSSIF |
FaSSGF的配制:精密称取处方量NaCl溶于900 mL超纯水中,加入适量HCl调节pH至1.6,用水定容至1 000 mL。称取0.06 g FaSSGF预混合粉末先溶于500 mL上述溶液中,用剩余溶液定容至1 000 mL,混匀即得。
FaSSIF的配制:分别称取处方量的NaH2PO4·H2O、NaOH和NaCl,溶于900 mL纯水中,用1 mol/L的NaOH或1 mol/L HCl调节溶液pH至6.5,用纯水定容至1 000 mL。称取2.24 g FaSSIF预混合粉末加入500 mL上述液体,室温下搅拌使完全溶解后,用剩余溶液定容至1 000 mL,混匀即得。
FeSSIF的配制:分别称取处方量的NaOH、冰醋酸和NaCl,溶于900 mL纯水中,用1 mol/L的NaOH或1 mol/L HCl调节溶液pH至5.0,然后用纯水定容至1 000 mL。称取11.2 g FeSSIF预混合粉末加入500 mL上述液体中,室温下搅拌使完全溶解后,用剩余溶液定容至1 000 mL,混匀即得。
1.5 在不同介质中聚合物粒子稳定性的评价取1 mL包载P2探针的PCL纳米粒,分别加入不同pH值缓冲溶液或模拟生理介质10 mL,涡旋混匀后于(37.0±0.5)℃水浴中孵育,分别于0、2、4、8、12、24、36、48 h取样,用荧光分光光度计测定最大激发波长(708 nm)和发射波长(732 nm)条件下的荧光强度。以0 h时荧光强度为100%,计算各时间点的相对荧光强度。
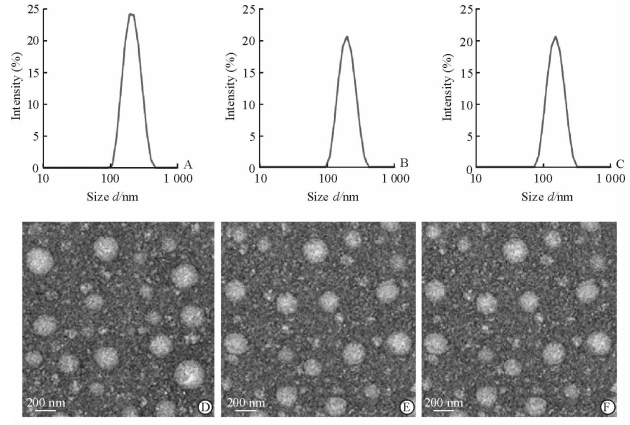
2 结果 2.1 纳米粒的制备与表征采用乳化-溶剂挥发法成功制得PCL纳米粒、mPEG5k-PCL纳米粒和mPEG2k-PCL纳米粒。各组纳米粒的粒径、多分散指数(polydispersity index,PDI)和zeta电位测定结果见表 2,粒径分布见图 2A~2C。3种纳米粒粒径均在200 nm左右,粒径分布较窄,且带负电荷。各组荧光强度较为相近。利用透射电子显微镜观察所得纳米粒的大小及形态,可见3种纳米粒均呈规则的圆球形,粒子间无粘连,粒径均一(图 2D~2F)。
|
|
表 2 PCL和mPEG-PCL纳米粒的理化特征 Tab 2 Physicochemical properties of PCL and mPEG-PCL nanoparticles |
|
图 2 3种纳米粒粒径分布(A~C)和透射电镜观察结果(D~F) Fig 2 Particle size distributions (A-C) and TEM photographs (D-F) of various nanoparticles A, D: PCL; B, E: mPEG5k-PCL; C, F: mPEG2k-PCL. PCL: Polycaprolactone; mPEG: Methoxy polyethylene glycol; TEM: Transmission electron microscope |
2.2 聚合物粒子稳定性
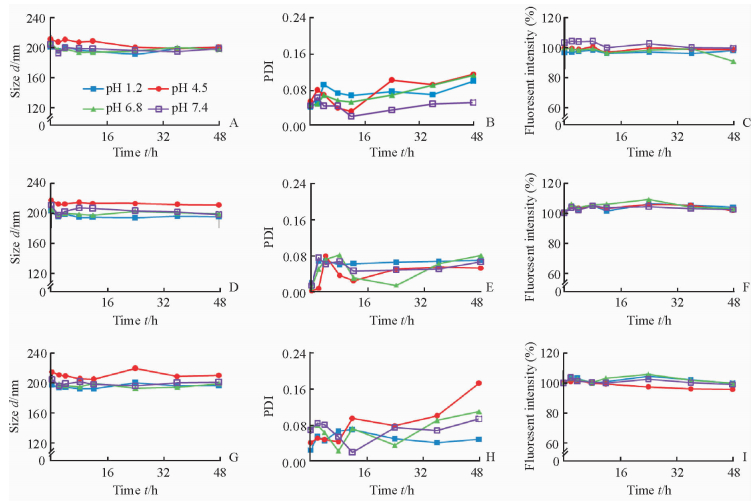
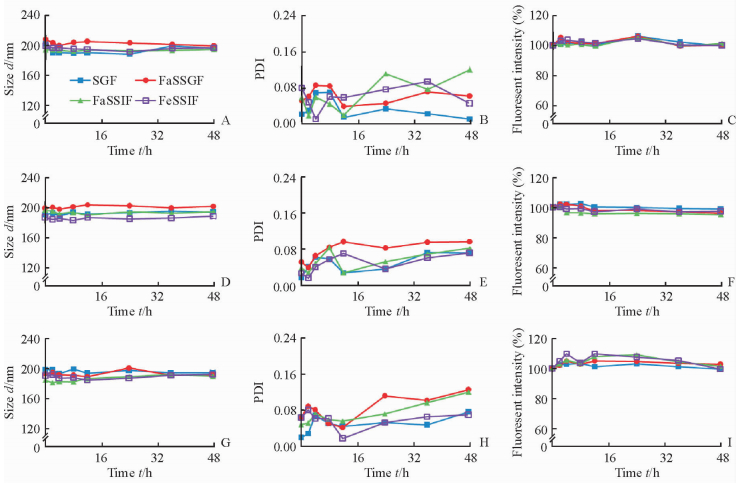
3种纳米粒在不同pH值缓冲介质中的稳定性结果见图 3,在不同模拟生理介质中的稳定性见图 4。结果显示3种纳米粒在不同pH值缓冲介质和不同模拟生理介质中均具有良好的稳定性,组间差异较小,粒径和PDI波动较小,且荧光强度未见明显减弱。结果表明在缓冲介质和模拟生理介质中粒子结构能保持完整,探针分子泄漏量极少,水也不会渗透入纳米粒骨架中导致荧光淬灭,水中的离子和表面活性等物质不会对粒子的结构和荧光强度产生影响。对比3种纳米粒可见,PCL、mPEG5k-PCL和mPEG2k-PCL纳米粒在各种介质中都比较稳定,但是mPEG修饰的纳米粒稳定性略优于非mPEG修饰的纳米粒,mPEG链长对粒子稳定性并没有明显影响。
|
图 3 PCL(A~C)、mPEG5k-PCL(D~F)和mPEG2k-PCL(G~I)纳米粒在不同pH值缓冲溶液中的稳定性 Fig 3 Stability of PCL (A-C), mPEG5k-PCL (D-F) and mPEG2k-PCL (G-I) nanoparticles in buffers of different pH values PCL: Polycaprolactone; mPEG: Methoxy polyethylene glycol; PDI: Polydispersity index |
|
图 4 PCL(A~C)、mPEG5k-PCL(D~F)和mPEG2k-PCL(G~I)纳米粒在不同模拟生理介质中的稳定性 Fig 4 Stability of PCL (A-C), mPEG5k-PCL (D-F) and mPEG2k-PCL (G-I) nanoparticles in different simulated gastric or intestinal fluids PCL: Polycaprolactone; mPEG: Methoxy polyethylene glycol; PDI: Polydispersity index; SGF: Simulated gastric fluid; FaSSGF: Fasted-state simulated gastric fluid; FaSSIF: Fasted-state simulated intestinal fluid; FeSSIF: Fed-state simulated intestinal fluid |
3 讨论
水淬灭P2探针是一种具有强亲脂性的aza-BODIPY探针,在水中探针分子由于ACQ效应发生聚集导致荧光淬灭,所以在制备探针标记纳米粒的过程中需充分考虑探针分子的性质。纳米粒的制备方法有许多种,其中乳化-溶剂挥发法制备过程简单,制得粒子粒径均一,稳定性好,适用于脂溶性强的物质,所以本研究最终选择此法制备探针标记纳米粒。
PCL是一种生物相容性好、生物可降解的高分子材料,已被广泛地应用于药剂学领域[14-15]。PCL疏水性较强,可以有效地包载脂溶性强的P2探针。虽然PCL在体内可降解,但其降解时间过长,所以加入mPEG嵌段增加材料的亲水性,改善PCL的疏水性和降解性。更重要的是mPEG化修饰有可能改变纳米粒在体内的命运。
经测定本研究所制纳米粒的zeta电位低于有关文献[12]报道。PCL分子中由于可能有部分游离羧基使其呈现一定的电负性。本研究在制备PCL纳米粒时采用PVA为稳定剂,最终制得的PCL表面可能覆盖有PVA,掩盖了PCL纳米粒的表面电性。另一方面,采用mPEG-PCL进行包被时,表面覆盖的mPEG层也可掩蔽PCL纳米粒的表面电性。所以,测定得到的表面电位值较小,近中性。透射电子显微镜、扫描电子显微镜和原子力显微镜都可在不破坏纳米粒的前提下对纳米粒形态进行观察,观察结果可作为粒径测定结果的佐证。本研究选用透射电子显微镜观察纳米粒形态,并用醋酸铀对纳米粒进行染色,结果显示纳米粒为规则的圆球形,粒子间无粘连,粒径均一。这从另一方面证明采用乳化-溶剂挥发法成功制备了实验所需纳米粒。
P2探针包载在聚合物载体中时能发出荧光,当载体在介质中被破坏使P2探针释放进入水相时,探针就会快速聚集导致荧光淬灭,所以只有载体保持稳定完整才能持续检测到稳定的荧光信号。本研究制备的3种纳米粒在不同的介质中粒径和PDI波动较小,表明纳米粒结构保持完整,此外,样品的荧光值无明显下降,表明纳米粒在不同介质中十分稳定,P2探针没有被释放出来。PCL降解速度十分缓慢,可以保持致密的结构[15],所以PCL纳米粒在各种介质中十分稳定。mPEG修饰的纳米粒稳定性优于非mPEG修饰者,其原因可能如下:mPEG是一种水溶性较高的亲水聚合物,可在纳米粒的表面形成一层水化层,有空间位阻的作用,可以有效阻止纳米粒的聚集以及其他物质的吸附,从而增加了纳米粒的稳定性。
在不同pH的缓冲介质和模拟生理体液中,本研究所有纳米粒均表现出良好的稳定性,粒径、PDI、荧光强度均未发生明显变化,说明利用P2探针ACQ效应这种性质,可将水淬灭P2探针作为指示剂以快速、方便地进行纳米粒稳定性研究,也表明可以用水淬灭P2探针对纳米粒的完整性进行标记。
| [1] | MOROZ E, MATOORI S, LEROUX J C. Oral delivery of macromolecular drugs:where we are after almost 100 years of attempts[J]. Adv Drug Deliv Rev, 2016, 101: 108–121. DOI: 10.1016/j.addr.2016.01.010 |
| [2] | VARAMINI P, TOTH I. Recent advances in oral delivery of peptide hormones[J]. Expert Opin Drug Deliv, 2016, 13: 507–522. DOI: 10.1517/17425247.2016.1142526 |
| [3] | LUO Y Y, XIONG X Y, TIAN Y, LI Z L, GONG Y C, LI Y P. A review of biodegradable polymeric systems for oral insulin delivery[J]. Drug Deliv, 2016, 23: 1882–1891. |
| [4] | XIE Y, JIANG S, XIA F, HU X, HE H, YIN Z, et al. Glucan microparticles thickened with thermosensitive gels as potential carriers for oral delivery of insulin[J]. J Mater Chem B, 2016, 4: 4040–4048. DOI: 10.1039/C6TB00237D |
| [5] | HU X, JIAN Z, YU Z, XIE Y, HE H, QI J, et al. Environment-responsive aza-BODIPY dyes quenching in water as potential probes to visualize the in vivo fate of lipid-based nanocarriers[J]. Nanomedicine, 2015, 11: 1939–1948. DOI: 10.1016/j.nano.2015.06.013 |
| [6] | HU X, FAN W, YU Z, LU Y, QI J, ZHANG J, et al. Evidence does not support absorption of intact solid lipid nanoparticles via oral delivery[J]. Nanoscale, 2016, 8: 7024–7035. DOI: 10.1039/C5NR07474F |
| [7] | XIE Y, HU X, HE H, XIA F, MA Y, QI J, et al. Tracking translocation of glucan microparticles targeting M cells:implications for oral drug delivery[J]. J Mater Chem B, 2016, 4: 2864–2873. DOI: 10.1039/C5TB02706C |
| [8] | HE H, JIAN Z, XIE Y, LU Y, QI J, AHMAD E, et al. Bioimaging of intravenous polymeric micelles based on discrimination of integral particles using an environment-responsive probe[J]. Mol Pharm, 2016, 13: 4013–4019. DOI: 10.1021/acs.molpharmaceut.6b00705 |
| [9] | AHMAD E, FENG Y, QI J, FAN W, MA Y, HE H, et al. Evidence of nose-to-brain delivery of nanoemulsions:cargoes but not vehicles[J]. Nanoscale, 2017, 9: 1174–1183. DOI: 10.1039/C6NR07581A |
| [10] | GOU M, ZHENG L, PENG X, MEN K, ZHENG X, ZENG S, et al. Poly(ε-caprolactone)-poly(ethylene glycol)-poly(ε-caprolactone) (PCL-PEG-PCL) nanoparticles for honokiol delivery in vitro[J]. Int J Pharm, 2009, 375: 170–176. DOI: 10.1016/j.ijpharm.2009.04.007 |
| [11] | JIA W, GU Y, GOU M, DAI M, LI X, KAN B, et al. Preparation of biodegradable polycaprolactone/poly (ethylene glycol)/polycaprolactone (PCEC) nanoparticles[J]. Drug Deliv, 2008, 15: 409–416. DOI: 10.1080/10717540802321727 |
| [12] | LI R, LI X, XIE L, DING D, HU Y, QIAN X, et al. Preparation and evaluation of PEG-PCL nanoparticles for local tetradrine delivery[J]. Int J Pharm, 2009, 379: 158–166. DOI: 10.1016/j.ijpharm.2009.06.007 |
| [13] | JANTRATID E, JANSSEN N, REPPAS C, DRESSMAN J B. Dissolution media simulating conditions in the proximal human gastrointestinal tract:an update[J]. Pharm Res, 2008, 25: 1663–1676. DOI: 10.1007/s11095-008-9569-4 |
| [14] | CHOIM J, RUKTANONCHAI U, SOOTTITANTAWAT A, MIN S G. Morphological characterization of encapsulated fish oil with β-cyclodextrin and polycaprolactone[J]. Food Res Int, 2009, 42: 989–997. DOI: 10.1016/j.foodres.2009.04.019 |
| [15] | CHAWLA J S, AMIJI M M. Biodegradable poly(ε-caprolactone) nanoparticles for tumor-targeted delivery of tamoxifen[J]. Int J Pharm, 2002, 249: 127–138. DOI: 10.1016/S0378-5173(02)00483-0 |
 2017, Vol. 38
2017, Vol. 38


