临床常用的吸入麻醉药异氟烷长时间暴露可引起发育期大鼠或小鼠的海马、大脑皮质、杏仁核等区域神经细胞广泛凋亡[1-2],并可损害大鼠成年后学习记忆等认知功能[3]。在中枢神经系统,R-α-甲基组胺[R-(-)-α-methylhistamine,RAMH]可通过激活组胺H3受体调节组胺、γ-氨基丁酸(GABA)等递质释放[4]。有研究表明RAMH可减轻或消除谷氨酸和甲基苯丙胺引起的发育期大鼠认知损害[5-6]。但RAMH是否能减轻异氟烷引起的发育期大鼠神经元凋亡及记忆损害仍不清楚。本研究通过行为学实验和免疫荧光技术等探讨RAMH是否对大鼠海马神经元细胞凋亡及记忆损害有保护作用。
1 材料和方法 1.1 实验对象与分组SD孕鼠购于上海斯莱克实验动物有限责任公司,按照第二军医大学实验动物管理规范饲养和照料。根据研究目的将28只6~7 d SD大鼠随机均分为4组:对照(CON)组腹腔注射5%葡萄糖(0.1 mL/10 g);异氟烷暴露模型(ISO)组腹腔注射5%葡萄糖(0.1 mL/10 g)后,吸入1.6%的异氟烷持续6 h;RAMH组腹腔注射RAMH(10 mg/kg);异氟烷暴露联合RAMH处理(RAMH+ISO)组腹腔注射RAMH(10 mg/kg)30 min后,吸入1.6%的异氟烷持续6 h。整个实验过程使用水浴锅保温。处理28 d后通过水迷宫实验观察大鼠学习记忆能力。然后对CON、ISO和RAMH+ISO组大鼠海马神经元凋亡、p53蛋白的表达进行检测。
1.2 水迷宫实验观察大鼠学习记忆能力使用经典的Morris水迷宫装置(上海吉量公司),将其随机分为4个象限,其中一个象限放置平台。训练时将大鼠根据训练计划分别放置于非平台象限,让大鼠自由寻找平台,以大鼠在平台上保持10 s不再次下水为完成一次测试。如果大鼠60 s内找不到平台则引导上台,并站立10 s。每天12:00~17:00训练2轮,持续训练5 d,第6天撤除平台,将大鼠放置于非目标象限的固定位置,让其自由寻找平台,视频记录其60 s内的整个过程。用分析软件分析大鼠的路线和潜伏期。测试大鼠的空间学习和记忆能力。
1.3 免疫荧光观察大鼠海马神经元凋亡情况冰冻切片室温放置30 min后加10%驴血清,室温孵育90 min。加入小鼠抗神经元特异性核蛋白(NeuN,1:300,美国Millipore公司,ABN78)、兔抗活化型半胱氨酸天冬氨酸蛋白酶3(activated caspase 3,AC3;1:300,美国CST公司,9664),4 ℃孵育过夜;第2天室温放置30 min后,缓冲液冲洗5 min×3次。然后加入荧光二抗Alexa Fluor® 594驴抗兔IgG(1:500,美国Invitrogen公司,A21207) 和Alexa Fluor® 488驴抗小鼠IgG(1:500,美国Invitrogen公司,R37114) 室温避光孵育2 h(以上抗体都用10%驴血清稀释)。缓冲液冲洗5 min×3次后封片。使用奥林巴斯BX51荧光显微镜拍照、计数,用Image-Pro Plus 6.0软件算出各区面积,以获得单位面积的阳性细胞数。
1.4 蛋白质印迹法检测大鼠海马p53蛋白表达大鼠麻醉后灌流生理盐水3 mL后断头取脑,冰上剥离海马组织加入RIPA裂解液(上海碧云天生物技术有限公司),磁珠振荡后12 000×g离心5 min,取上清液。BCA法测定总蛋白浓度(Thermo Scientific Pierce® BCA定量试剂盒)。SDS-PAGE分离蛋白后转移至硝酸纤维素膜上,室温封闭2 h。加入小鼠抗p53(1:500,美国CST公司,9284) 和抗β-actin(1:5 000,美国CST公司,3700),4 ℃孵育过夜。缓冲液洗膜5 min×3次后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,室温放置2 h后洗膜5 min×3次。最后使用DAB显色试剂显影,ImageJ软件分析条带灰度值。
1.5 统计学处理应用SPSS 19.0软件进行数据分析。计量资料以x±s表示,组间比较采用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
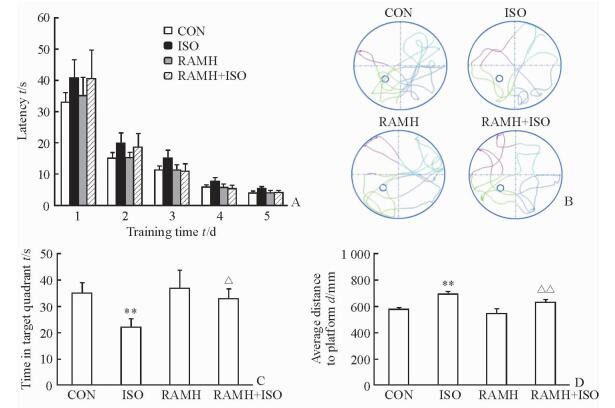
2 结果 2.1 RAMH处理能够改善异氟烷所致的幼年大鼠记忆损害在水迷宫实验中,通过5 d的训练,大鼠到达平台的潜伏期均少于10 s,表明大鼠的训练有效。各组大鼠在5 d的训练中到达平台的潜伏期差异均无统计学意义(图 1A)。在记忆测试中,ISO组大鼠在目标象限的时间短于CON组,距离目标点的平均距离长于CON组(P<0.01);RAMH+ISO组大鼠在目标象限的时间长于ISO组(P<0.05),距离目标点的平均距离短于ISO组(P<0.01),见图 1B~1D。
|
图 1 RAMH处理能够改善异氟烷所致的幼年大鼠记忆损害 Fig 1 RAMH ameliorates isoflurane (ISO) exposure induced memory impairment in developing rats A: Bar histogram showing the latency during the spatial navigation learning; B: Representative tracking for each group from a single training session; C, D: Bar histograms showing the time spent in the target quadrant (C) and the average distance to the target site (D). CON: Control; RAMH: R-(-)-α-methylhistamine. **P < 0.01 vs CON group; △P < 0.05, △△P < 0.01 vs ISO group. n=7, x±s |
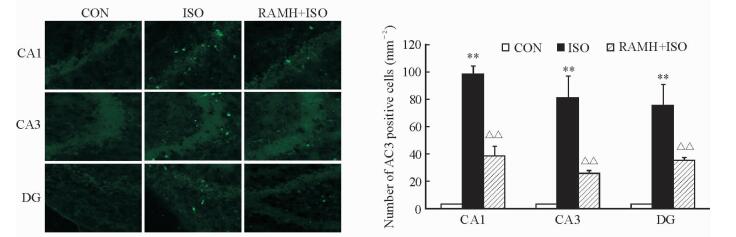
2.2 RAMH处理可改善异氟烷引起的幼年大鼠海马神经元凋亡情况
本实验采用免疫荧光技术检测大鼠海马区AC3观察细胞凋亡情况。由图 2可见,CON组大鼠海马CA1、CA3和DG区几乎没有AC3阳性细胞。ISO组大鼠海马CA1、CA3和DG区见大量AC3阳性细胞,且与CON组差异有统计学意义(P<0.01),表明ISO可使大鼠海马CA1、CA3和DG区发生细胞凋亡。与ISO组相比,RAMH+ISO组大鼠CA1、CA3和DG区AC3阳性细胞均减少(P<0.01)。
|
图 2 RAMH处理改善异氟烷引起的幼年大鼠海马神经元凋亡 Fig 2 RAMH ameliorates isoflurane (ISO) exposure induced neuronal apoptosis in hippocampus of developing rats AC3: Activated caspase 3; CA1/3: Cornu ammonis 1/3; DG: Dentate gyrus; CON: Control; RAMH: R-(-)-α-methylhistamine. Original magnification: ×10. **P < 0.01 vs CON group; △△P < 0.01 vs ISO group. n=5, x±s |
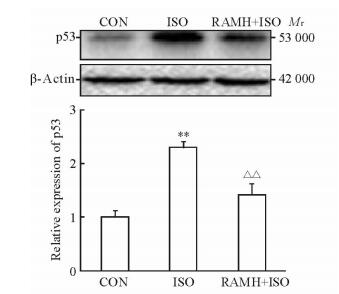
2.3 RAMH及异氟烷处理后幼年大鼠海马p53蛋白的表达
与CON组相比,ISO组大鼠海马中p53蛋白表达增加(P<0.01)。RAMH处理后(RAMH+ISO组)大鼠海马p53蛋白表达较ISO组降低(P<0.01)。见图 3。
|
图 3 蛋白质印迹法检测RAMH对异氟烷暴露大鼠海马p53表达的影响 Fig 3 Effect of RAMH on expression of p53 protein in rats' hippocampus after isoflurane (ISO) exposure by Western blotting CON: Control; RAMH: R-(-)-α-methylhistamine. **P < 0.01 vs CON group, △△P < 0.01 vs ISO group. n=6, x±s |
3 讨论
本研究利用1.6%异氟烷暴露6 h引起的大鼠发育神经毒性模型,观察RAMH对大鼠学习记忆能力的影响,结果显示RAMH可改善异氟烷暴露引起的记忆能力损害,减少异氟烷暴露引起的大鼠海马区神经元凋亡和p53表达增加。表明RAMH可改善异氟烷暴露引起的神经元凋亡及记忆能力损害。
RAMH减轻异氟烷暴露引起的神经元凋亡和记忆损害可能与其调节递质释放和影响凋亡信号通路有关。有研究表明异氟烷可激活未成熟的发育期神经元上GABA受体,使神经元发生去极化[7-8],从而导致神经元内钙异常增加[9],胞内钙浓度异常升高可激活caspase-3等介导的凋亡途径。因此,调节GABA神经系统可能是干预异氟烷发育期神经毒性的途径之一。在中枢神经系统中,组胺H3受体是一种自身调节性受体,发挥稳定神经递质系统平衡的作用,主要表达于突触前,通过作用于电压依赖性钙通道引起的钙内流调节突触前递质释放[4, 10]。这些递质包括组胺以及GABA、乙酰胆碱、多巴胺、去甲肾上腺素等神经递质[4]。我们前期研究发现RAMH可抑制成年大鼠海马CA1区GABA能突触传递,在未成年大鼠RAMH也可能通过类似的作用减弱异氟烷增强GABA能的作用,从而改善神经元凋亡和记忆损害[3]。除了调节递质释放,RAMH也可影响凋亡相关的信号通路。例如,在皮质神经元中,RAMH可激活MAPK及Akt-GSK3β通路,从而抑制促凋亡蛋白caspase-3活性,增加抑制凋亡蛋白bcl-2的表达[6]。
异氟烷(1.6%)暴露6 h是研究全麻药发育神经毒性的最常用模型之一[11]。在本实验中,大鼠异氟烷(1.6%)暴露6 h后,海马以及其他脑区均发生明显凋亡。该结果与以往研究结果基本一致。不仅在动物实验中发现幼年动物全麻药暴露可导致学习记忆能力的损害,在回顾性临床研究中还发现3岁前接受手术的患儿在10岁时发生语言和推理能力缺陷的风险显著高于未手术患儿[12]。因此,本研究中选择出生后7 d的SD大鼠接受麻醉药暴露,5周龄时应用水迷宫实验检测学习记忆能力。该时间点与临床研究的时间点相似。尽管有研究表明RAMH可增强成年大鼠的学习记忆能力[13],但是在本实验中由于给药时间不同,RAMH对正常幼年大鼠的记忆无明显影响,但可减轻异氟烷暴露对幼年大鼠的记忆损害。该结果表明RAMH减轻异氟烷记忆损害的作用不是简单的相互抵消,而是可能与其减轻神经元细胞凋亡或阻断发育神经毒性的发生机制有关。
P53蛋白是一种肿瘤抑制蛋白,但是也表达于正常中枢神经组织中。其激活可使细胞增殖停止,DNA损伤和凋亡[10]。研究表明p53信号通路是介导细胞凋亡的重要通路之一[14]。本实验结果显示,ISO组大鼠海马p53蛋白表达增加,表明异氟烷暴露后发育中神经元可能发生了DNA损伤,从而凋亡。而RAMH处理后p53表达低于ISO组。该结果提示抑制p53的表达可能是RAMH减轻异氟烷暴露引起的发育中神经元细胞凋亡的可能途径之一。本实验中仅初步观察了RAMH对p53表达的影响,但是RAMH如何抑制p53的表达以及对p53下游的信号通路的影响仍需进一步研究。
尽管有研究发现一些药物(如氯化锂、氙气)和方法(如异氟烷预处理、异丙酚预处理)可减轻全麻药对发育中神经元的促凋亡作用[15-16],但这些药物和方法对认知功能的影响仍不清楚,并且存在使用不便、机制不明等不足。本研究从神经元细胞凋亡和记忆行为2个方面考察了RAMH的保护作用,发现RAMH是全麻药发育神经毒性的有效干预方法,但是其具体的作用机制仍需进一步研究。
| [1] | DENG M, HOFACER R D, JIANG C, JOSEPH B, HUGHES E A, JIA B, et al. Brain regional vulnerability to anaesthesia-induced neuroapoptosis shifts with age at exposure and extends into adulthood for some regions[J]. Br J Anaesth, 2014, 113: 443–451. DOI: 10.1093/bja/aet469 |
| [2] | SATOMOTO M, SATOH Y, TERUI K, MIYAO H, TAKISHIMA K, ITO M, et al. Neonatal exposure to sevoflurane induces abnormal social behaviors and deficits in fear conditioning in mice[J]. Anesthesiology, 2009, 110: 628–637. DOI: 10.1097/ALN.0b013e3181974fa2 |
| [3] | LI W W, CHENG L Z, ZOU Z, TIAN M L, ZHANG H, RAYA A D, et al. (R)-α-methylhistamine suppresses inhibitory neurotransmission in hippocampal CA1 pyramidal neurons counteracting propofol-induced amnesia in rats[J]. CNS Neurosci Ther, 2014, 20: 851–859. DOI: 10.1111/cns.2014.20.issue-9 |
| [4] | GEMKOW M J, DAVENPORT A J, HARICH S, ELLENBROEK B A, CESURA A, HALLETT D. The histamine H3 receptor as a therapeutic drug target for CNS disorders[J]. Drug Discov Today, 2009, 14(9/10): 509–515. |
| [5] | RABER J. Histamine receptor-mediated signaling during development and brain function in adulthood[J]. Cell Mol Life Sci, 2007, 64: 735–741. DOI: 10.1007/s00018-007-6442-2 |
| [6] | MARIOTTINI C, SCARTABELLI T, BONGERS G, ARRIGUCCI S, NOSI D, LEURS R, et al. Activation of the histaminergic H3 receptor induces phosphorylation of the Akt/GSK-3β pathway in cultured cortical neurons and protects against neurotoxic insults[J]. J Neurochem, 2009, 110: 1469–1478. DOI: 10.1111/jnc.2009.110.issue-5 |
| [7] | PERROT-SINAL T S, AUGER A P, McCARTHY M M. Excitatory actions of GABA in developing brain are mediated by L-type Ca2+ channels and dependent on age, sex, and brain region[J]. Neuroscience, 2003, 116: 995–1003. DOI: 10.1016/S0306-4522(02)00794-7 |
| [8] | ZHAO Y L, XIANG Q, SHI Q Y, LI S Y, TAN L, WANG J T, et al. GABAergic excitotoxicity injury of the immature hippocampal pyramidal neurons' exposure to isoflurane[J]. Anesth Analg, 2011, 113: 1152–1160. DOI: 10.1213/ANE.0b013e318230b3fd |
| [9] | KINDLER C H, EILERS H, DONOHOE P, OZER S, BICKLER P E. Volatile anesthetics increase intracellular calcium in cerebrocortical and hippocampal neurons[J]. Anesthesiology, 1999, 90: 1137–1145. DOI: 10.1097/00000542-199904000-00029 |
| [10] | LI L H, TU Q Y, DENG X H, XIA J, HOU D R, GUO K, et al. Mutant presenilin 2 promotes apoptosis through the p53/miR-34a axis in neuronal cells[J]. Brain Res, 2017, 1662: 57–64. DOI: 10.1016/j.brainres.2017.01.034 |
| [11] | ZHANG Y, XIE Z. Anesthetics isoflurane and desflurane differently affect mitochondrial function, learning, and memory[J]. Ann Neurol, 2012, 72: 630. DOI: 10.1002/ana.23683 |
| [12] | ING C, DIMAGGIO C, WHITEHOUSE A, HEGARTY M K, BRADY J, VON UNGERN-STERNBERG B S, et al. Long-term differences in language and cognitive function after childhood exposure to anesthesia[J]. Pediatrics, 2012, 130: e476–e485. DOI: 10.1542/peds.2011-3822 |
| [13] | RUBIO S, BEGEGA A, SANTIN L J, ARIAS J L. Improvement of spatial memory by (R)-α-methylhistamine, a histamine H3-receptor agonist, on the Morris water-maze in rat[J]. Behav Brain Res, 2002, 129(1/2): 77–82. |
| [14] | ENOMOTO A, YAMADA J, MORITA A, MIYAGAWA K. Bisdemethoxycurcumin enhances X-ray-induced apoptosis possibly through p53/Bcl-2 pathway[J]. Mutat Res, 2017, 815: 1–5. DOI: 10.1016/j.mrgentox.2016.12.005 |
| [15] | MA D, WILLIAMSON P, JANUSZEWSKI A, NOGARO M C, HOSSAIN M, ONG L P, et al. Xenon mitigates isoflurane-induced neuronal apoptosis in the developing rodent brain[J]. Anesthesiology, 2007, 106: 746–753. DOI: 10.1097/01.anes.0000264762.48920.80 |
| [16] | WEI H, LIANG G, YANG H. Isoflurane preconditioning inhibited isoflurane-induced neurotoxicity[J]. Neurosci Lett, 2007, 425: 59–62. DOI: 10.1016/j.neulet.2007.08.011 |
 2017, Vol. 38
2017, Vol. 38


