紫外线(ultraviolet,UV)是波长范围为100~400 nm的电磁波,根据波长又可分为A波(UVA,315~400 nm)、B波(UVB,280~315 nm)和C波(UVC,100~280 nm)。太阳是紫外线的主要来源,其中UVC全部被大气层中的氧和臭氧所过滤,直接照射在皮肤表面的紫外线主要由UVA和UVB(290~400 nm)组成,其中UVA穿透力更强,对皮肤损伤更大[1]。研究表明,高强度或长时间紫外线照射可引起皮肤组织氧化应激,产生过量的活性氧(reactive oxygen species,ROS),破坏细胞膜的完整性和细胞内的抗氧化系统,从而导致炎症因子浸润、细胞凋亡等病理改变[2]。因此,长时间紫外线暴露可引起皮肤红肿、水肿、色素沉着、表皮萎缩变硬等光老化损伤,甚至导致皮肤肿瘤的发生[3]。
异黄酮(野鸢尾苷元、鸢尾苷)是黄酮类化合物中的一种,其化学分子结构与人体分泌的雌激素相似,可通过与雌激素受体结合发挥类雌激素样效应,故被称为植物雌激素[4]。已有研究发现,异黄酮可通过多个途径减轻紫外线诱导的光损伤,如诱导产生血红素加氧酶1(heme oxygenase 1,HO-1) 发挥抗氧化作用[5],减少光化学产物环丁烷型嘧啶二聚体(cyclobutane pyrimidine dimer,CPD)的形成保护细胞DNA[6],增加过氧化氢酶(catalase,CAT)的活性、抑制环氧化酶2(cyclooxygenase 2,COX-2) 和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达预防皮肤衰老等[7]。
本研究以成年雄性ICR小鼠作为研究对象,旨在探讨异黄酮类制剂预处理对紫外线(UVA和UVB联合)照射对皮肤组织损伤的作用,并从炎症反应和脂质过氧化损伤角度探讨其作用机制。
1 材料和方法 1.1 主要仪器与试剂异黄酮(鸢尾苷元,上海永恒生物科技有限公司,货号FB-46001) 用芝麻油[sesame oil,斯百全化学(上海)有限公司,货号SE130]作为基质稀释后配制成质量分数为2%和3%的制剂。BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,小鼠白介素(IL)-1β、IL-6、肿瘤坏死因子α(TNF-α) ELISA试剂盒和小鼠超氧化物歧化酶(SOD)检测试剂盒均购自上海西唐生物科技有限公司(货号分别为F10770、F10830、F11630和F11502),小鼠丙二醛(MDA)和CAT检测试剂盒均购自南京建成生物技术公司(货号分别为A003-1和A007-1)。SS-03 AB-10型紫外线光疗仪及紫外线辐照度监视计为上海希格玛高技术公司产品。
1.2 实验对象与分组处理实验用小鼠购自上海斯莱克实验动物有限责任公司[动物生产许可证号:SCXK(沪)2012-0002],饲养于第二军医大学实验动物中心[动物使用许可证号:SYXK(沪)2012-0003]。48只9周龄雄性ICR小鼠,25~30 g,于通风良好、卫生清洁的动物房内适应性饲养1周,自由饮食。动物房温度控制在(22±2) ℃,相对湿度为40%~70%,光照度控制在150~300 lx,光照时间12 h(7:00—19:00)。本研究通过第二军医大学科学研究伦理委员会审核,所有操作均遵循国家《实验动物管理条例》及《国家实验动物管理实施细则》。
小鼠喂养1周后随机分成4组(每组12只):对照组、紫外光照(UV)组、2%异黄酮组和3%异黄酮组。第1次脱毛时用乙醚适度麻醉小鼠,除背部鼠毛,暴露出1.0 cm×1.0 cm的无毛皮肤,之后根据鼠毛的生长情况适度修剪。
对照组小鼠裸露皮肤不接受紫外线照射,仅涂布纯基质(芝麻油)。UV组、2%异黄酮组和3%异黄酮组小鼠分别置于特制的大小为3 cm×6 cm的长方形实验盒,裸露皮肤分别涂布纯基质、含2%或3%的异黄酮制剂,各药物均取0.1 mL,涂布厚度为0.1 cm;预处理15 min[8]后先后接受UVA和UVB照射,制作紫外照射损伤的皮肤模型。照射参数:用混合平行紫外灯模拟日光,照射小鼠背部裸露皮肤,UVA剂量为1.55 J/cm2、18 min,UVB剂量为0.95 J/cm2、11 min;先UVA后UVB,照射高度30 cm;小鼠身体其他部位用遮光板遮蔽。每日1次,连续7 d。
1.3 样本获取照射结束后以过量20%尿酯麻醉处死小鼠,分离创面组织行以下操作:(1) 取部分组织剪成适宜大小,置于4%多聚甲醛溶液中固定,进行石蜡包埋、切片、H-E染色,封片,光镜观察并采集图像,对比分析各组皮肤中胶原纤维含量的变化;(2) 另取部分组织,剪碎,按1 g(组织):9 mL(生理盐水)的比例置入匀浆管中,经研磨式电力匀浆器制作10%组织匀浆,使细胞完全破碎,内容物全部游离在液相中,进行生化指标检测。
1.4 生化指标测定 1.4.1 ELISA检测皮肤组织IL-1β、IL-6和TNF-α的含量分别根据相应的ELISA试剂盒说明书操作说明处理皮肤组织样本,IL-1β、IL-6和TNF-α的含量均测定450 nm波长处的光密度(D)值,根据BCA法所测蛋白浓度,计算每单位蛋白质的IL-1β、IL-6和TNF-α含量。
1.4.2 皮肤组织MDA含量测定用改良微量硫代巴比妥酸(thiobarhituric acid,TBA)比色法,按小鼠MDA检测试剂盒说明书测定MDA含量。
1.4.3 皮肤组织SOD和CAT含量的测定分别采用SOD和CAT检测试剂盒说明书处理样本,测定450 nm波长处的D值,绘制标准曲线,计算标本中SOD和CAT含量。
1.5 统计学处理应用SPSS 21.0软件分析数据,计量资料以x±s表示,多组间比较采用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
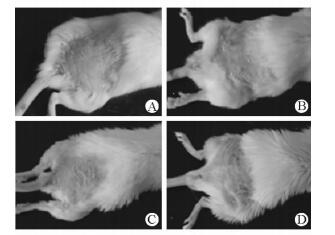
2 结果 2.1 异黄酮对紫外线照射小鼠皮肤形态学的影响与对照组小鼠(图 1A)相比,UV组小鼠接受紫外线暴露3 d即出现背部皮肤光泽度降低,表面粗糙,局部出现红斑;照射至第7天时,皮肤出现破损并结痂,局部色素沉着,质地变硬,有脱屑现象(图 1B)。而局部外用2%异黄酮或3%异黄酮小鼠的背部皮肤在接受7 d紫外线照射后的损伤程度较轻,皮肤色泽均匀,表皮没有破损和结痂,无变硬和脱屑的现象(图 1C、1D)。上述现象提示,异黄酮能有效预防紫外线暴露导致的皮肤外部结构的光损伤反应。
|
图 1 不同处理条件下小鼠皮肤一般形态的观察 Fig 1 General status of skin of mice with different treatments A: Control group; B: UV group; C: 2% isoflavone+UV group; D: 3% isoflavone+UV group. UV: Ultraviolet irradiation |
2.2 异黄酮对紫外线照射小鼠皮肤组织形态学的影响
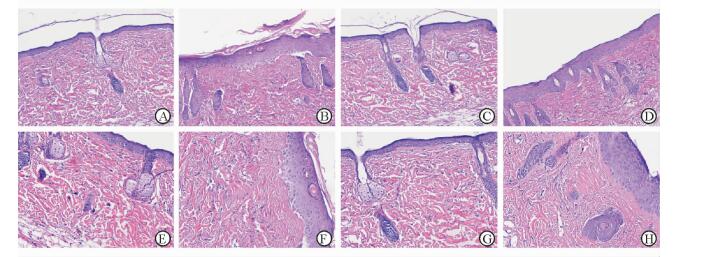
病理切片H-E染色显示,对照组小鼠皮肤组织的表皮层完整光滑,真皮层内结构清晰,胶原纤维排列整齐(图 2A)。UV组经过7 d紫外线照射后,镜下可见表皮结构不完整,局部萎缩变薄,角质增厚,谷粒和圆体增多,棘层肥厚,细胞间水肿,间隙增宽,见有嗜伊红的均质小体;真皮层胶原含量减少,染色变浅,以真皮浅层最为显著,胶原纤维粗细不等且排列紊乱,真皮层疏松,可观察到炎症细胞浸润,提示胶原破坏增多,有日光性皮炎的发生(图 2B)。而给予2%或3%异黄酮预处理再接受紫外线照射的小鼠皮肤能够保持表皮结构完整,角质层无明显增厚,真皮层内胶原纤维排列较为整齐,无明显炎症细胞浸润(图 2C、2D)。提示异黄酮能改善紫外线照射所致皮肤病理学异常,对光损伤具有较好的预防作用。
|
图 2 不同处理条件下小鼠皮肤组织的H-E染色结果 Fig 2 H-E staining of skin tissues of mice with different treatments A, E: Control group; B, F: UV group; C, G: 2% isoflavone+UV group; D, H: 3% isoflavone+UV group. UV: Ultraviolet irradiation. Original magnification: ×20 (A-D), ×40 (E-H) |
2.3 异黄酮对紫外线照射小鼠皮肤组织炎症因子含量的影响
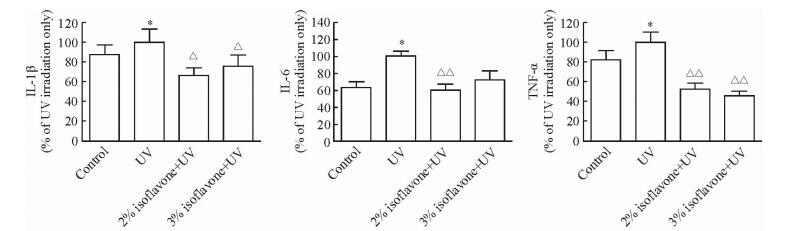
检测各组小鼠皮肤组织炎症因子的含量,结果(图 3)显示,UV组小鼠皮肤组织中IL-1β、IL-6和TNF-α的含量较对照组均增加(P<0.05);给予2%异黄酮预处理后均下降(P<0.05,P<0.01);而给予3%异黄酮预处理后IL-1β和TNF-α的含量下降(P<0.05,P<0.01),但IL-6的含量与UV组相比差异无统计学意义。且2%异黄酮组和3%异黄酮组间IL-1β、IL-6和TNF-α含量的差异无统计学意义。以上结果提示,长期慢性中长波紫外线照射可导致小鼠被照射皮肤组织中炎症因子含量增加,而使用异黄酮预处理皮肤能改善紫外线照射引起的皮肤组织中炎症因子含量的异常。
|
图 3 各组小鼠皮肤组织IL-1β、IL-6和TNF-α的含量 Fig 3 Contents of IL-1β, IL-6 and TNF-α in skin tissues of mice in each group UV: Ultraviolet irradiation; IL: Interleukin; TNF-α: Tumor necrosis factor α. *P < 0.05 vs control group; △P < 0.05, △△P < 0.01 vs UV group. n=12, x±s |
2.4 异黄酮对紫外线照射小鼠皮肤组织MDA、SOD和CAT含量的影响
如图 4所示,与对照组相比,UV组小鼠皮肤组织的MDA含量增加(P<0.05),SOD和CAT含量减少(P<0.05)。与UV组相比,2%异黄酮组小鼠皮肤组织的MDA含量下降(P<0.05),SOD和CAT含量增加(P<0.05, P<0.01);3%异黄酮组MDA含量下降(P<0.05),SOD含量增加(P<0.05),但CAT含量与UV组差异无统计学意义。2%异黄酮和3%异黄酮组间小鼠皮肤组织的MDA、SOD和CAT含量差异均无统计学意义。以上结果提示,异黄酮预处理可减轻紫外线照射引起的脂质过氧化反应,改善紫外线照射所导致的皮肤氧化应激。

|
图 4 各组小鼠皮肤组织MDA、SOD和CAT的含量 Fig 4 Contents of MDA, SOD and CAT in skin of mice in each group UV: Ultraviolet irradiation; MDA: Malondialdehyde; SOD: Superoxide dismutase; CAT: Catalase. *P < 0.05 vs control group; △P < 0.05, △△P < 0.01 vs UV group. n=12, x±s |
3 讨论
本实验采用中长波复合紫外线光源(UVA+UVB)模拟自然条件,连续7 d照射后观察皮肤形态和组织学的改变。结果显示,UVA和UVB联合照射7 d后,小鼠被照射部位皮肤弹性降低、硬度增加,伴局部脱屑和色素沉着、结痂等形态学改变。H-E染色结果示,紫外线照射可引起角质层增厚、表皮破损、弹力纤维断裂、炎症细胞浸润等改变。
异黄酮类化合物对肝、肺和脑组织的抗炎作用和抗氧化作用等已得到确认[9-10],但是异黄酮类药物预处理对紫外线照射引起的皮肤损伤是否具有防治作用尚未见报道。我们的研究表明,紫外线照射前先给予异黄酮制剂涂抹,小鼠皮肤表皮结构保持较为完整,损伤较轻,无明显破损结痂,无明显增厚变硬;H-E染色结果也显示异黄酮预处理可减轻紫外线照射引起的表皮层、真皮层组织的损坏以及炎症细胞浸润等改变。上述结果说明,异黄酮可有效预防紫外线所致光损伤的形态学改变和病理学改变。
皮肤局部炎症反应是紫外线诱导皮肤光损伤的机制之一[11]。参与皮肤炎症反应的炎症因子众多,包括IL-1β、IL-6、IL-10、IL-11、IL-1α和TNF-α等,它们的过度表达与皮肤组织表皮和真皮细胞凋亡、弹性纤维变性密切相关。例如,IL-1β可以通过诱导炎症细胞浸润[12]、激活成纤维细胞中MAPK通路和促进基质金属蛋白酶(表达,从而降解细胞外基质,使皮肤老化、角质层增厚[13]。TNF-α表达增加可导致皮肤角质形成细胞的凋亡,促进皮肤组织内的长链脂肪酸降解,导致皮肤组织发生海绵化[14]等。我们的实验结果显示,UV组小鼠皮肤组织中炎症因子IL-1β、IL-6和TNF-α的含量均高于对照组,即UVA和UVB联合照射可诱导被照射部位皮肤组织炎症因子堆积,从而诱导炎症细胞浸润,这与H-E染色结果一致。
研究认为,氧化应激也是紫外线所致皮肤损伤的重要机制之一。皮肤内含有大量不饱和脂质成分,占皮肤脂质总量的25%以上。紫外线可明显促进皮肤的脂质过氧化反应[15],伴随大量ROS自由基的产生,后者可破坏细胞膜脂的稳定性,导致蛋白质、脂类和DNA的氧化性损伤,加速皮肤衰老,破坏机体的防御屏障[16]。我们的实验结果发现,与对照组相比,UV组小鼠皮肤组织中MDA含量增加,SOD和CAT含量减少,提示紫外线照射导致局部皮肤组织过氧化反应增强、清除自由基能力减弱,从而导致皮肤表皮结构破损,真皮层结构疏松,纤维断裂、角质层增厚等病理改变。
异黄酮类化合物的抗炎作用和抗氧化作用已得到证实。Ma等[17]研究发现,异黄酮类化合物鸢尾黄素可以减少脂多糖(LPS)诱导的小鼠肺组织中TNF-α、IL-1和IL-6等炎症因子的含量,减少肺泡周围炎症细胞的浸润,从而抑制LPS诱导的急性肺损伤。Ganai等[18]则发现,异黄酮类化合物染料木素可以减少D-半乳糖诱导的Wistar大鼠肝脏细胞炎症因子TNF和IL-1的分泌;同时可以抑制诱导型一氧化氮合酶的水平和一氧化氮的生成,增强肝脏细胞的抗氧化防御反应,从而有效预防肝脏的炎症反应和肝毒性损伤。除此以外,染料木素能减轻脑缺血导致的过氧化反应[19],可作为脑缺血损伤的替代治疗方法之一。异黄酮还可提高高强度运动所致氧化应激小鼠模型肝脏中SOD和CAT活性[20],提示提高抗氧化酶活性是异黄酮抗氧化的途径之一。本实验结果显示,异黄酮预处理可降低紫外线照射引起的小鼠皮肤组织中炎症因子含量的增加、减少被照射皮肤组织MDA含量并诱导SOD和CAT的产生。以上结果提示异黄酮制剂预处理可能通过减轻皮肤组织的炎症反应以及过氧化级联反应预防紫外线照射所引起的皮肤光损伤。不同剂量异黄酮对紫外线所致光损伤的保护作用有待后续深入研究和阐明。
综上所述,紫外线照射可导致小鼠皮肤出现皮肤弹性下降、表皮层增厚、红斑色素沉着等病理改变,并伴随皮肤炎症反应和过氧化反应增强。而给予异黄酮制剂预处理可有效减轻炎症因子浸润,减少氧自由基对皮肤组织的过氧化损伤,改善紫外线所导致的皮肤形态学改变。本研究结果提示,异黄酮可有效预防紫外线所致小鼠皮肤损伤,局部给药安全高效,为防紫外线药物的研发提供了实验依据。
| [1] | SOLA Y, LORENTE J. Contribution of UVA irradiance to the erythema and photoaging effects in solar and sunbed exposures[J]. J Photochem Photobiol B, 2015, 143: 5–11. DOI: 10.1016/j.jphotobiol.2014.10.024 |
| [2] | DANG L, WANG Y, XUE Y, HE L, LI Y, XIONG J. Low-dose UVB irradiation prevents MMP2-induced skin hyperplasia by inhibiting inflammation and ROS[J]. Oncol Rep, 2015, 34: 1478–1486. DOI: 10.3892/or.2015.4072 |
| [3] | BALD T, QUAST T, LANDSBERG J, ROGAVA M, GLODDE N, LOPEZ-RAMOS D, et al. Ultraviolet-radiation-induced inflammation promotes angiotropism and metastasis in melanoma[J]. Nature, 2014, 507: 109–113. DOI: 10.1038/nature13111 |
| [4] | VAN DE SCHANS M G, VINCKEN J P, DE WAARD P, HAMERS A R, BOVEE T F, GRUPPEN H. Glyceollins and dehydroglyceollins isolated from soybean act as SERMs and ER subtype-selective phytoestrogens[J]. J Steroid Biochem Mol Biol, 2016, 156: 53–63. DOI: 10.1016/j.jsbmb.2015.11.020 |
| [5] | WIDYARINI S, DOMANSKI D, PAINTER N, REEVE V E. Photoimmune protective effect of the phytoestrogenic isoflavonoid equol is partially due to its antioxidant activities[J]. Photochem Photobiol Sci, 2012, 11: 1186–1192. DOI: 10.1039/c2pp25022e |
| [6] | WIDYARINI S. Protective effect of the isoflavone equol against DNA damage induced by ultraviolet radiation to hairless mouse skin[J]. J Vet Sci, 2006, 7: 217–223. DOI: 10.4142/jvs.2006.7.3.217 |
| [7] | HUANG C C, HSU B Y, WU N L, TSUI W H, LIN T J, SU C C, et al. Anti-photoaging effects of soy isoflavone extract (aglycone and acetylglucoside form) from soybean cake[J]. Int J Mol Sci, 2010, 11: 4782–4795. DOI: 10.3390/ijms11124782 |
| [8] | TUNDIS R, LOIZZO M R, BONESI M, MENICHINI F. Potential role of natural compounds against skin aging[J]. Curr Med Chem, 2015, 22: 1515–1538. DOI: 10.2174/0929867322666150227151809 |
| [9] | KANG O H, KIM S B, MUN S H, SEO Y S, HWANG H C, LEE Y M, et al. Puerarin ameliorates hepatic steatosis by activating the PPARα and AMPK signaling pathways in hepatocytes[J]. Int J Mol Med, 2015, 35: 803–809. DOI: 10.3892/ijmm.2015.2074 |
| [10] | MA X L, ZHANG F, WANG Y X, HE C C, TIAN K, WANG H G, et al. Genistein inhibition of OGD-induced brain neuron death correlates with its modulation of apoptosis, voltage-gated potassium and sodium currents and glutamate signal pathway[J]. Chem Biol Interact, 2016, 254: 73–82. DOI: 10.1016/j.cbi.2016.05.033 |
| [11] | WANG X F, HUANG Y F, WANG L, XU L Q, YU X T, LIU Y H, et al. Photo-protective activity of pogostone against UV-induced skin premature aging in mice[J]. Exp Gerontol, 2016, 77: 76–86. DOI: 10.1016/j.exger.2016.02.017 |
| [12] | NASTI T H, TIMARES L. Inflammasome activation of IL-1 family mediators in response to cutaneous photodamage[J]. Photochem Photobiol, 2012, 88: 1111–1125. DOI: 10.1111/php.2012.88.issue-5 |
| [13] | WANG X, BI Z, CHU W, WAN Y. IL-1 receptor antagonist attenuates MAP kinase/AP-1 activation and MMP1 expression in UVA-irradiated human fibroblasts induced by culture medium from UVB-irradiated human skin keratinocytes[J]. Int J Mol Med, 2005, 16: 1117–1124. |
| [14] | DANSO M O, VAN DRONGELEN V, MULDER A, VAN ESCH J, SCOTT H, VAN SMEDEN J, et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents[J]. J Invest Dermatol, 2014, 134: 1941–1950. DOI: 10.1038/jid.2014.83 |
| [15] | YASUI H, HAKOZAKI T, DATE A, YOSHⅡ T, SAKURAI H. Real-time chemiluminescent imaging and detection of reactive oxygen species generated in the UVB-exposed human skin equivalent model[J]. Biochem Biophys Res Commun, 2006, 347: 83–88. DOI: 10.1016/j.bbrc.2006.06.046 |
| [16] | FISCHER T W, KLESZCZYNSKI K, HARDKOP L H, KRUSE N, ZILLIKENS D. Melatonin enhances antioxidative enzyme gene expression (CAT, GPx, SOD), prevents their UVR-induced depletion, and protects against the formation of DNA damage (8-hydroxy-2'-deoxyguanosine) in ex vivo human skin[J]. J Pineal Res, 2013, 54: 303–312. DOI: 10.1111/jpi.2013.54.issue-3 |
| [17] | MA C H, LIU J P, QU R, MA S P. Tectorigenin inhibits the inflammation of LPS-induced acute lung injury in mice[J]. Chin J Nat Med, 2014, 12: 841–846. |
| [18] | GANAI A A, KHAN A A, MALIK Z A, FAROOQI H. Genistein modulates the expression of NF-κB and MAPK (p-38 and ERK1/2), thereby attenuating D-Galactosamine induced fulminant hepatic failure in Wistar rats[J]. Toxicol Appl Pharmacol, 2015, 283: 139–146. DOI: 10.1016/j.taap.2015.01.012 |
| [19] | ARAS A B, GUVEN M, AKMAN T, ALACAM H, KALKAN Y, SILAN C, et al. Genistein exerts neuroprotective effect on focal cerebral ischemia injury in rats[J]. Inflammation, 2015, 38: 1311–1321. DOI: 10.1007/s10753-014-0102-0 |
| [20] | YOON G A, PARK S. Antioxidant action of soy isoflavones on oxidative stress and antioxidant enzyme activities in exercised rats[J]. Nutr Res Pract, 2014, 8: 618–624. DOI: 10.4162/nrp.2014.8.6.618 |
 2017, Vol. 38
2017, Vol. 38


