2. 西北大学生命科学学院, 西安 710069
2. College of Life Sciences, Northwest University, Xi'an 710069, Shaanxi, China
冠心病(coronary heart disease, CHD)是指因冠状动脉粥样硬化致使管腔狭窄或阻塞,或因冠状动脉功能性改变导致心肌缺血、缺氧而引起的心脏病。中医将CHD归属为“胸痹”“真心痛”“厥心痛”[1]。冠心七味片是治疗CHD的经典验方,由丹参、肉豆蔻、檀香、广枣、山柰、降香、沙棘七味草药组成,具有活血化瘀、强心止痛的功效。药理学研究表明,冠心七味片可通过降血脂、抗炎、改善血管弹性等途径对实验性动脉粥样硬化起到延缓或治疗作用[2-3]。目前对冠心七味片单个化学成分或药效分子的研究较多,但对其全方的研究未见报道,其全方治疗CHD的药效物质基础尚不明确。本研究采用网络药理学方法,借助分子对接等技术构建了冠心七味片有效成分与CHD相关靶点间的有效网络,探讨了冠心七味片的药效分子及其在治疗CHD中的多靶点作用机制,阐明中药及其复方“多成分-多靶点”的分析理念[4-5]。
1 材料和方法 1.1 冠心七味片中候选化合物的收集与筛选采用《中药天然产物大全》和Reaxys数据库(http://www.reaxys.com)收集七味草药所含的化合物,包括丹参(含202个化合物)、肉豆蔻(含64个化合物)、檀香(含70个化合物)、广枣(含43个化合物)、山柰(含33个化合物)、降香(含98个化合物)、沙棘(含233个化合物)。根据“Lipinski类药五原则”对上述化合物进行初次筛选并去重,共收集到713个化合物。考虑冠心七味片所使用的材料和制剂方法,去除不合理分子后剩余574个化合物。
应用Chemoffice 2012软件的ChemBioDraw模块绘制每个化合物的二维结构,再用ChemBio3D模块将其转化为三维结构,并使用MM2力场进行构象优化,分别保存为mol2格式和sdf格式。采用TCMSP药理学分析平台预测每个化合物的药代动力学ADME参数,并基于Discovery Studio 2.5软件包的TOPKAT模块进行毒性预测,得到的打分值依据ADME/T的筛选标准进行二次筛选。从DrugBank数据库(http://www.drugbank.ca)收集治疗CHD疗效显著的药效分子(经国家食品药品监督管理局批准),共计186个,作为阳性药物对照,保存为sdf格式。利用Discovery Studio 2.5软件对符合ADME/T规则的候选化合物和阳性药物分子进行主成分分析,进行3次筛选。
1.2 CHD相关靶点的收集通过查询Therapeutic Targets Database (http://bidd.nus.edu.sg/group/cjttd)和DrugBank数据库,再结合文献调研,共收集到41个CHD相关靶点。在PDB(http://www.rcsb.org/pdb/home.do)网站下载上述靶点的X射线晶体结构,保存为pdb格式,见表 1。分子对接前,应用Discovery Studio 2.5软件包的Clean Protein模块对蛋白质进行去水分子、加氢、加电荷,然后采用CHARMm力场能量最小化的方法进行构型优化。
|
|
表 1 冠心病潜在靶点蛋白 |
1.3 分子打靶
应用MGLTools 1.5.6软件将冠心七味片的化学成分存储为pdbqt格式,使用Autodock_Vina程序进行半柔性分子对接计算。对接过程中,只改变药效分子配体的构象,而保持受体蛋白的刚性不变。首先生成受体结合部位的格点盒子及其参数,再根据拉马克遗传算法优化配体结构,然后发出配体与受体的对接计算指令以产生多个结合构象,最后从中寻找最佳的结合构象并依照半经验自由能函数做出对接结果评价。对接参数设置如下:以距离靶蛋白原配体外侧0.75 nm为界标,其活性位点定义为一个八面体结构,其格点盒子大小设定为40×40×40,中心坐标参照蛋白-配体复合物中原配体分子的坐标设置(若无配体,则参照文献报道的蛋白活性位点残基坐标),其余参数均设为默认值。
1.4 药效分子-靶点网络的构建与分析对接完成后,以原配体为阈值,依据对接计算结果,即当药效分子与相关靶点对接数值不高于阈值时,认为该靶点与冠心七味片中的化学成分具有相互作用。对冠心七味片进行ADME/T活性筛选,得到候选化合物165个,再对上述化合物的41个靶点进行分子模拟对接。为了找到冠心七味片的主要药效分子,参照文献[6-7]的方法,选择与各个靶点对接的结合自由能前10位、前5位的化合物分别构建网络。将发生作用的靶点与药效分子作为网络的节点(node),将两者之间的相互作用作为网络的连接(edge),制成excel表格文件,导入cytoscape 3.2.1软件,构建药效分子-靶点(compound-target,C-T)网络。在应用cytoscape 3.2.1软件构建药效分子-靶点网络时,由于相互作用网络图所含节点的数量及种类不同,所以排名前20位左右的化合物的网络参数(网络度与介数)会略微发生改变。为了全面反映药效分子与靶点之间的网络关系,本研究分别描述了所有药效分子-靶点整体型网络节点的网络特征及主要药效分子-靶点的局部型网络节点的网络特征,之后利用其network_analyzer插件进行药效分子与靶点蛋白的网络互作分析。
1.5 靶点-疾病网络的构建与分析将筛选出的靶点与疾病信息关联,利用cytoscape 3.2.1软件构建靶点-疾病(target-disease,T-D)网络并分析两者的关系。靶点与疾病的关联信息来自PharmGkb数据库(http://www.pharmgkb.org/)、Therapeutic Targets Database数据库以及相关文献。
2 结果 2.1 冠心七味片中的候选化合物对冠心七味片中的574个化合物进行药代动力学及毒性等8项指标的二次筛选,得到165个候选化合物。应用Discovery Studio 2.5软件包的Calculate Molecular Properties模块对其进行主成分分析,分析结果转化为三维空间坐标数值,计算得到一对一空间坐标距离共14 850个(165×90)。本研究将候选化合物与抗CHD药物的空间距离近似度设定为≤1.0,再次筛选后得到142个候选化合物。
2.2 药效分子-靶点网络的分析本研究计算了网络的两个关键拓扑参数-网络度和介数,其中节点的网络度代表药物分子所拥有的靶点数目,介数为通过该节点的最短路径数占通过所有节点路径总数的比值。选取打分前10位的化合物构建整体药效分子-靶点网络。统计结果表明18种药效分子与41种靶点之间的介数和网络度最高,见表 2。其中,丹酚酸B和丹参酮ⅡA为冠心七味片的国家质检推荐标准物[8-9],其他16种药效分子是冠心七味片治疗CHD的潜在药效成分,可能成为冠心七味片新的质量检测物质。上述18种药效分子均能作用于5个以上的CHD靶点,符合传统中药的复方多药效分子、多靶点的特点。网络中胆甾醇苯甲酸酯与9个靶点发生相互作用,具有较高的网络度。对其结合多种蛋白的能力进行比较,可以发现胆甾醇苯甲酸酯与维生素D3受体具有最佳的结合能力。
|
|
表 2 18种药效分子-靶点整体型网络的介数和网络度 |
为了分析与不同靶点蛋白作用力最强的药效分子的特性,取打分前5位的化合物构建局部药效分子-靶点网络。统计结果表明15种药效分子与41种靶点之间的介数和网络度最高,见表 3。其中,冠心七味片的国家质检标准品丹参酮ⅡA、对甲氧基肉桂酸辛酯的网络度分别为5、4;小红参醌乙、齿孔醇、1-氢丹参酮ⅡA、4-亚甲丹参新酮、丹参新醌D、异丹参酮ⅡA、丹参醌新酮Ⅱ、类胡萝卜素等8种药效分子的网络度较低,但其与靶点具有较强相互作用(结合能均<-9.7 kcal/mol,1 kcal=4.186 kJ)。
|
|
表 3 15种药效分子-靶点的局部型网络节点的网络特征 |
利用cytoscape 3.2.1软件的network_analyzer插件进行冠心七味片药效分子与靶点蛋白的网络互作分析,得到冠心七味片化学成分的18个主要作用靶点,见表 4。根据分析,丹参酮类物质(丹参酮ⅡA、1-氢丹参酮ⅡA、4-亚甲丹参新酮、丹参新醌D、异丹参酮ⅡA、丹参醌新酮Ⅱ)主要通过作用于5个靶点(氧化型胆固醇受体β、雌激素受体β、盐皮质激素受体、热休克蛋白90β、维生素D3受体)实现其药效作用。
|
|
表 4 冠心七味片药效分子的主要作用靶点 |
2.3 基于靶点-疾病网络的特征分析
对冠心七味片化学成分的18个主要作用靶点(表 4)行疾病搜索,剔除在数据库(PharmGkb,Therapeutic Targets Database)中暂未搜索到的热休克蛋白90β、环磷酸二酯酶4D、血管紧张素转化酶2、细胞色素P450 2C9、氧化型胆固醇受体β等5个靶点,构建靶点-疾病的相互作用网络图(图 1)。其中,暗红色箭头代表潜在靶点,蓝紫色圆圈代表相关疾病,绿色圆圈代表疾病分类,节点的大小代表其网络度。网络图显示了13个靶点与心血管疾病、肿瘤、炎症、内分泌系统疾病、神经系统疾病、呼吸道疾病等6大类疾病的关联。分析表明,过氧化物酶增殖物激活受体γ、血管紧张素转化酶、肾素、血管内皮生长因子受体2、雌激素受体β、热休克蛋白90α、氧化型胆固醇受体α等7个靶点与心血管系统疾病密切相关,可能是冠心七味片中药效分子治疗CHD的关键靶点。
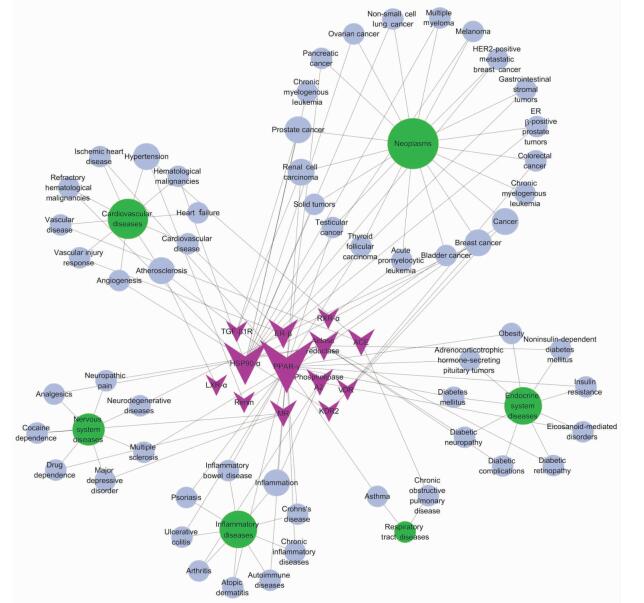
|
图 1 靶点-疾病的相互作用网络图 TGF:转化生长因子;ER:雌激素受体;RXR:视黄酸受体;HSP:热休克蛋白;PPAR:过氧化物酶增殖物激活受体;ACE:血管紧张素转化酶;VDR:维生素D3受体;LXR:氧化型胆固醇受体;MR:盐皮质激素受体;KDR:血管内皮生长因子受体 |
3 讨论
本研究运用网络药理学方法筛选了冠心七味片治疗CHD的18种主要药效分子,通过药效分子-靶点网络的特征分析,得到了18个潜在靶点,通过靶点与疾病的关联性分析,最终发现过氧化物酶增殖物激活受体γ、血管紧张素转化酶、肾素、血管内皮生长因子受体2、雌激素受体β、热休克蛋白90α、氧化型胆固醇受体α是冠心七味片治疗CHD的7个关键靶点。其中,过氧化物酶增殖物激活受体γ主要通过调节脂质代谢、抑制炎症反应发挥作用[10-11];血管紧张素转化酶和肾素主要通过肾素-血管紧张素系统来延缓冠状动脉粥样硬化的发生和发展[12-13];血管内皮生长因子受体2在血管生成和内皮损伤修复中起关键作用,参与冠状动脉粥样硬化的过程[14];雌激素受体β具有抗炎、促血管损伤修复、增加冠脉血流量等多重作用[15];热休克蛋白90α可以明显减少心肌缺血再灌注损伤;氧化型胆固醇受体α可通过促进内皮细胞增殖和血管新生,防止血栓形成,抑制动脉粥样硬化的发生、发展[16]。冠心七味片的药效成分通过上述靶点相互作用,实现其降血脂、抗炎、改善血管弹性等作用。
冠心七味片的18种药效成分协同作用于CHD的7个靶点,缓解或改善了CHD,体现了中药复方治疗疾病“多成分,多靶点,协同作用”的特点。其中,胆甾醇苯甲酸酯、日本楠脂素、丹参酮ⅡA、对甲氧基肉桂酸辛酯、1-氢丹参酮ⅡA、异丹参酮ⅡA、丹参醌新酮Ⅱ等多个药效分子均可作用于维生素D3受体,体现了多成分之间的协同作用。分析药效成分与靶点的结合能可知,胆甾醇苯甲酸酯与维生素D3受体的结合能最大,日本楠脂素和异丹参酮ⅡA次之,可以推测后两者能够协同前者作用于维生素D3受体,发挥更强的免疫调节作用,从而抑制巨噬细胞活性,最终减少动脉粥样硬化的发生[17]。上述机制与中医学中的君、臣、佐、使组方原则较为相似。分析冠心七味片的主要药效成分可知,丹参所含的有效成分最多,而丹参正是冠心七味片方的君药,佐证了上述推测的有效性。
综上,本研究筛选了冠心七味片中的18种主要药效成分及其治疗CHD的7个主要靶点,初步揭示了冠心七味片在治疗CHD中“多成分,多靶点,协同作用”的作用机制。此外,中药复方化学成分及其作用于疾病靶点的复杂性,以及中医药强调辨证论治的特色优势,尚需新的技术和进一步的研究来探明其分子机制。
| [1] | 国家中医药管理局. 中医病症诊断疗效标准[S]. 南京: 南京大学出版社, 1979: 18-19. |
| [2] | 吴一振, 杨洋, 董娟妮, 王世祥, 郑静, 刘勤社, 等. 冠心七味片中丹参素、没食子酸、原儿茶酸和原儿茶醛的测定[J]. 中成药, 2013, 35: 2418–2421. DOI: 10.3969/j.issn.1001-1528.2013.11.024 |
| [3] | 刘志跃, 陈瑶, 常培叶, 李建英, 赵莹. 冠心七味片改善动脉粥样硬化兔血管弹性及其机制的实验研究[J]. 中国病理生理杂志, 2010, 10: 1989. |
| [4] | 王毅, 高秀梅, 张伯礼, 程翼宇. 论建立基于网络生物学的现代中药创制方法学[J]. 中国中药杂志, 2011, 36: 228–231. |
| [5] | 王永华, 杨凌. 基于系统药理学的现代中药研究体系[J]. 世界中医药, 2013, 8: 801–808. |
| [6] | LI B, XU X, WANG X, YU H, LI X, TAO W, et al. A systems biology approach to understanding the mechanisms of action of Chinese herbs for treatment of cardiovascular disease[J]. Int J Mol Sci, 2012, 13: 13501–13520. DOI: 10.3390/ijms131013501 |
| [7] | 刘忠政, 梁洁萍, 聂怡初, 刘宏, 谢称石, 程国华, 等. 复方血栓通胶囊基于血液循环和凝血过程相关靶点的网络药理学研究[J]. 中山大学学报(自然科学版), 2013, 52: 97–100. |
| [8] | 席琳图雅, 莫日根高娃. 高效液相色谱法检测蒙药冠心七味片中丹参酮ⅡA的含量[J]. 时珍国医国药, 2004, 15: 889–890. DOI: 10.3969/j.issn.1008-0805.2004.12.012 |
| [9] | 陈显慧, 常永卓, 白音夫, 王月梅. HPLC法测定蒙药冠心七味胶囊丹酚酸B含量[J]. 中国民族医药杂志, 2007, 13: 53–54. DOI: 10.3969/j.issn.1006-6810.2007.02.034 |
| [10] | TENENBAUM A, FISMAN E Z. Balanced pan-PPAR activator bezafibrate in combination with statin:comprehensive lipids control and diabetes prevention?[J]. Cardiovasc Diabetol, 2012, 11: 140. DOI: 10.1186/1475-2840-11-140 |
| [11] | 耿彦婷, 张军平, 徐士欣, 吕仕超. PPARs与TLR-NF-κB信号通路[J]. 中国病理生理杂志, 2012, 28: 1516–1520. DOI: 10.3969/j.issn.1000-4718.2012.08.034 |
| [12] | 朱玮玮, 华琦. 肾素-血管紧张素-醛固酮系统基因与高血压患者发生心血管事件相关性研究进展[J]. 心血管病学进展, 2015, 4: 394–397. DOI: 10.3969/j.issn.1004-3934.2015.04.009 |
| [13] | MATYAR S, ACARTVRK E, ATTILA G, UNAL I, SOYER L, AKPINAR O. Gene-gene interaction of ACE I/D, endothelial nitric oxide synthase 4a/b and ApoE does not affect coronary artery disease severity[J]. Adv Clin Exp Med, 2014, 23: 215–223. DOI: 10.17219/acem/37065 |
| [14] | HAYASHI H, AL MAMUN A, SAKIMA M, SATO M. Activator of G-protein signaling 8 is involved in VEGF-mediated signal processing in angiogenesis[J]. J Cell Sci, 2016, 129: 1210–1222. DOI: 10.1242/jcs.181883 |
| [15] | 张亚云, 林超, 孙鑫, 钱星, 马志, 姚远, 等. 雌激素介导的HSP27在动脉粥样硬化中作用的研究进展[J]. 中国药理学通报, 2016, 2: 159–162. DOI: 10.3969/j.issn.1001-1978.2016.02.003 |
| [16] | CHEN J, CUI X, ZACHAREK A, ROBERTS C, CHOPP M. eNOS mediates TO90317 treatment-induced angiogenesis and functional outcome after stroke in mice[J]. Stroke, 2009, 40: 2532–2538. DOI: 10.1161/STROKEAHA.108.545095 |
| [17] | MATHIEU C, ADORINI L. The coming of age of 1, 25-dihydroxyvitamin D3 analogs as immunomodulatory agents[J]. Trends Mol Med, 2002, 8: 174–179. DOI: 10.1016/S1471-4914(02)02294-3 |
 2017, Vol. 38
2017, Vol. 38


