胃癌的治疗措施主要包括手术、化疗及靶向治疗。化疗是胃癌综合治疗中的重要治疗措施,但由于胃癌细胞对于化疗药物多存在较为明显的抵抗能力,即多药耐药性(multidrug resistance, MDR),常导致化疗失败[1-2],造成患者肿瘤复发或转移。阐明胃癌细胞耐药抵抗的机制并实现耐药性逆转对于改善胃癌治疗效果有重要意义。但迄今胃癌MDR的机制还不完全明确,对胃癌MDR的逆转也没有实现。研究发现pokemon与肿瘤的侵袭、转移、凋亡有关[3-4],也与肿瘤的耐药形成有关[5]。为了解pokemon在胃癌耐药形成中的作用,本研究检测了胃癌及癌旁组织中pokemon蛋白及耐药相关蛋白P-糖蛋白(P-glycoprotein, P-gp)、多药耐药相关蛋白1(multidrug resistance-associated protein 1, MRP1)、肺耐药蛋白(lung resistance protein, LRP)、生存素(survivin)的表达,对胃癌细胞的体外药敏性进行了检测,分析了pokemon与胃癌耐药性的关系,并进一步应用RNA干扰技术抑制人胃癌耐药细胞株SGC7901/耐阿霉素(adriamycin, ADR)中pokemon表达,检测了转染前后胃癌细胞耐药性的变化,以期为探讨pokemon在胃癌耐药形成中的作用机制提供依据。
1 材料和方法 1.1 临床标本来源入组患者为2013年1月至2014年12月在河北医科大学第四医院外三科确诊并行手术切除的胃癌患者60例。其中男42例、女18例; 年龄36~80岁,平均(57.54±9.73) 岁,患者术前均未接受过放化疗。每例均于术中取胃癌及癌旁组织(距肿瘤边缘大于3 cm,术后证实无肿瘤细胞存在)标本各1块,每块大小约1 cm×0.5 cm×0.5 cm。标本分为2份,一份置于-80 ℃保存用于胃癌细胞体外药敏性检测;另一份置于4%多聚甲醛溶液中固定,制备石蜡标本用于免疫组化检测。本研究经河北医科大学第四医院伦理委员会审核批准,入组患者均签署知情同意文件。
1.2 细胞株及主要试剂人胃癌细胞株SGC7901由本院科研中心保种并传代,胃癌耐药细胞株SGC7901/ADR由第四军医大学消化病研究所樊代明院士惠赠,胃上皮细胞株GES-1购自中国科学院上海细胞研究所。磺酰罗丹明B(sulforhodamine B, SRB)为美国Sigma公司产品。LipofectamineTM 2000转染试剂盒为美国Invitrogen公司产品;实时定量PCR(qPCR)试剂盒为美国Promega公司产品;目的基因的PCR引物、小干扰RNA由生工生物工程(上海)股份有限公司合成。Pokemon、P-gp、MRP1、LRP、survivin及内参GAPDH抗体均为美国Santa Cruz公司产品,免疫组化试剂盒购自北京中杉金桥生物技术有限公司。
1.3 细胞培养细胞SGC7901及SGC7901/ADR复苏后置于含10%胎牛血清及双抗的RPMI 1640培养液中常规培养、传代,待细胞处于对数生长期时进行实验。其中SGC7901/ADR细胞培养时加入0.5 μg/mL的ADR维持其耐药表型,在实验前1周停止添加ADR。
1.4 免疫组化染色检测胃癌及癌旁组织中目的蛋白的表达石蜡标本进行连续4 μm切片,切片在60 ℃恒温箱中烘烤20 min后脱蜡水化,3% H2O2孵育10 min后用蒸馏水冲洗、PBS浸泡后抗原修复。染色步骤严格按免疫组化试剂盒说明书操作。每张切片在高倍(400倍)视野下计数,每片随机取5个镜下视野,每视野计数100个细胞,计数阳性细胞并计算阳性细胞率。Pokemon、P-gp、MRP1、LRP、survivin蛋白的阳性表现为在细胞核或细胞质内出现黄色或棕色颗粒。结果计分标准:细胞内阳性细胞数<10%记为阴性(-),10%~50%记为弱阳性(+),>50%记为强阳性(┼┼)。
1.5 SRB蛋白染色法检测胃细胞株的化疗敏感性各细胞株以5×104/mL密度接种于96孔板,每组设3个复孔。待细胞贴壁后分别加入胃癌常用化疗药物5-氟尿嘧啶(5-fluorouracil, 5-FU)、顺铂(cisplatin, DDP)、奥沙利铂(oxaliplatin, L-OHP),药物浓度为血药峰值浓度[6]。继续培养48 h。培养结束后每孔加入预冷的50%三氯醋酸(TCA) 50 μL,4 ℃放置1 h。倒掉固定液,超纯水清洗5次,干燥后每孔加入100 μL SRB,室温避光10 min。弃去SRB,用1%醋酸液漂洗、干燥,用非缓冲Tris碱液(pH 10.5) 溶解结合的SRB,在酶标仪545 nm处测定光密度(D)值(代表细胞活性), 计算抑制率。
1.6 qPCR检测目的基因mRNA的表达提取细胞总RNA,反转录合成cDNA。按PCR试剂盒操作说明建立PCR反应体系,经过变性、退火、延伸反应,共45个循环,对目的基因的mRNA进行检测。各基因引物序列如下:pokemon,F 5′-CTG CTG CAA GAC CTC GTC-3′,R 5′-CGT CCT CGT CCT TAA AGT GCT-3′;MDR1(P-gp编码基因),F 5′-GTG GGG CAA GTC AGT TCA TT-3′,R 5′-TCT TCA CCT CCA GGC TCA GT-3′;MRP1,F 5′-CAG CCC TTC CTG ACA TA-3′,R 5′-GTG GCC TCA TCC AAC AC-3′;LRP,F 5′-ACC AAC CCT GAC GAC AGA AG-3′,R 5′-CAT GTC TCC CGA TCT CTG GT-3′;survivin,F 5′-GCC AGA TTT GAA TCG CGG GA-3′,R 5′-GCA GTG GAT GAA GCC AGC CT-3′;GAPDH,F 5′-GAC CCC TTC ATT GAC CTC AAC-3′,R 5′-CGC TCC TGG AAG ATG GTG AT-3′。PCR结果经1.5%琼脂糖凝胶电泳检测鉴定,采用2-ΔΔCt法计算mRNA表达量,以所得数据代表目的基因mRNA的相对表达强度。
1.7 Pokemon特异性小干扰RNA(pokemon-siRNA)的合成及转染Pokemon-siRNA序列参考文献[7]设计,序列为5′-GCC AGG AGA AGC ACT TTA A-3′,无关对照siRNA(non-specific control siRNA,NS-siRNA)序列为5′-CCC UUC UCU GUU UGU AAA GAG ACA U-3′。使用LipofectamineTM 2000采用脂质体介导法转染,按照说明书将pokemon-siRNA或NS-siRNA转染SGC7901/ADR细胞株,检测转染效果。
1.8 蛋白质印迹法检测各目的蛋白表达提取各样品总蛋白,Bradford法定量蛋白,取60 μg蛋白上样,行12%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis, PAGE)分离,电转移至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜,用TBST配制的5%脱脂奶粉封闭1 h,分别用加入各目的蛋白的一抗4 ℃孵育过夜。TBST漂洗后加相应辣根过氧化物酶标记的二抗室温孵育1 h,化学发光法显色,测定蛋白条带的积分光密度值,以目的蛋白与内参积分光密度值的比值代表蛋白表达相对强度。
1.9 统计学处理应用SPSS 16.0软件对实验结果进行分析,实验数据以x±s表示。采用χ2检验比较胃癌组织与癌旁组织中各蛋白的表达情况;Spearman相关分析计算胃癌组织中各蛋白之间的关系;不同细胞对化疗药物的药敏性、siRNA转染对pokemon及耐药基因表达的影响采用单因素方差分析(ANOVA),组间两两比较采用SNK检验。检验水准(α)为0.05。
2 结果 2.1 胃癌与癌旁组织中目的蛋白的表达免疫组化染色结果见图 1。胃癌组织中pokemon、P-gp、MRP1、LRP、survivin蛋白的阳性表达率分别为81.67%(49/60)、83.33%(50/60)、73.33%(44/60)、58.33%(35/60)、68.33%(41/60),而癌旁组织中上述蛋白的阳性表达率分别为38.33%(23/60)、35.00%(21/60)、36.67%(22/60)、21.67%(13/60)、45.00%(27/60)。胃癌组织中pokemon、P-gp、MRP1、LRP、survivin蛋白的阳性表达率均高于癌旁组织(P<0.05)。
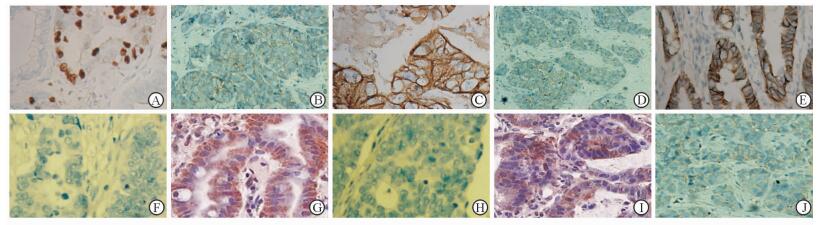
|
图 1 免疫组化染色检测胃癌组织中pokemon、P-gp、MRP1、LRP、survivin蛋白的表达 Fig 1 Protein expressions of pokemon, P-gp, MRP1, LRP and survivin in gastric cancer tissues detected by immunohistochemistry A:Pokemon(┼┼);B:Pokemon(+);C:P-gp(┼┼);D:P-gp(+);E:MRP1(┼┼);F:MRP1(+);G:LRP(┼┼);H:LRP(+);I:Survivin(┼┼);J:Survivin(+).P-gp:P-glycoprotein;MRP1:Multidrug resistance-associated protein1;LRP:Lung resistance protein. Original magnification:×400 |
2.2 胃癌组织中pokemon蛋白表达与P-gp、MRP1、LRP、survivin的关系
经Spearman相关分析发现,pokemon蛋白表达与P-gp和survivin蛋白表达间均具有正相关关系(r=0.385 2, P=0.002;r=0.342 4, P=0.007);pokemon表达与MRP1和LRP蛋白表达间未发现相关关系(r=0.234 6, P=0.071;r=0.205 3, P=0.116)。
2.3 Pokemon、P-gp、MRP1、LRP、survivin蛋白在各胃细胞株中的表达Pokemon、P-gp、MRP1、survivin蛋白在细胞株SGC7901、SGC7901/ADR中的表达均高于GES-1(P<0.05),在SGC7901/ADR中表达最高(P<0.05);而LRP蛋白在这3种细胞株中的表达差异无统计学意义(P>0.05)。见图 2。
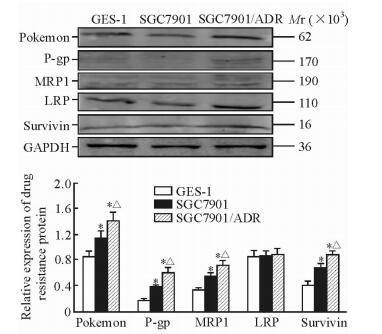
|
图 2 蛋白质印迹法检测pokemon、P-gp、MRP1、LRP、survivin蛋白在各胃细胞株中的表达 Fig 2 Protein expressions of pokemon, P-gp, MRP1, LRP and survivin in gastric cell lines detected by Western blotting P-gp: P-glycoprotein; MRP1: Multidrug resistance-associated protein 1; LRP: Lung resistance protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; ADR: Adriamycin. *P < 0.05 vs GES-1 cells; △P < 0.05 vs SGC7901 cells. n=3, x±s |
2.4 不同细胞株对5-FU、DDP、L-OHP的药敏性
SRB蛋白染色结果显示,在3种细胞株中,5-FU、DDP、L-OHP对GES-1细胞株的抑制作用最强,SGC7901次之,对SGC7901/ADR的抑制作用最弱(P<0.01)。见表 1。
|
|
表 1 化疗药物对SGC7901/ADR、SGC7901、GES-1细胞株的抑制作用 Tab 1 Inhibitory effect of chemotherapeutic drugs on SGC7901/ADR, SGC7901, and GES-1 cell lines |
2.5 Pokemon-siRNA转染SGC7901/ADR细胞对pokemon基因表达的影响
以pokemon-siRNA或NS-siRNA分别转染SGC7901/ADR细胞。结果发现,pokemon-siRNA对pokemon mRNA的抑制呈时间-剂量依赖性。Pokemon mRNA表达随pokemon-siRNA剂量增大、时间延长而减弱。见图 3。实验中发现pokemon-siRNA以40 nmol/L的浓度转染SGC7901/ADR细胞株48 h对pokemon mRNA表达有明显的抑制作用,故以40 nmol/L及48 h进行后续实验。
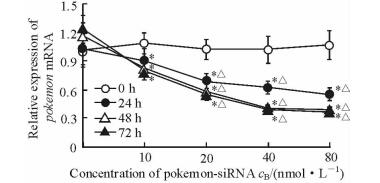
|
图 3 Pokemon-siRNA转染对SGC7901/ADR细胞中pokemon mRNA表达的影响 Fig 3 Effect of pokemon-siRNA transfection on pokemon mRNA expression in SGC7901/ADR cells ADR: Adriamycin. *P < 0.05 vs 24 h, ΔP < 0.05 vs 0 nmol/L pokemon-siRNA. n=3, x±s |
2.6 抑制胃癌细胞SGC7901/ADR中pokemon表达对药敏性的影响
转染pokemon-siRNA的SGC7901/ADR细胞与转染NS-siRNA的SGC7901/ADR细胞相比,其药敏性明显增强(P<0.01)。见表 2。
|
|
表 2 Pokemon-siRNA转染对胃癌细胞SGC7901/ADR药敏性的影响 Tab 2 Effect of pokemon-siRNA transfection on drug sensitivity of SGC7901/ADR cells |
2.7 抑制SGC7901/ADR细胞株中pokemon表达对耐药相关基因的影响
转染48 h后,转染pokemon-siRNA的SGC7901/ADR细胞与转染NS-siRNA的SGC7901/ADR细胞相比,MDR1、survivin表达减弱(P<0.05),而MRP1、LRP的变化并不明显(P>0.05)。蛋白质印迹分析结果与qPCR相符。见图 4。
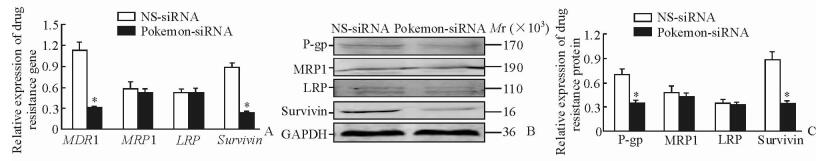
|
图 4 Pokemon-siRNA转染对SGC7901/ADR细胞中P-gp、MRP1、LRP、survivin的mRNA和蛋白表达的影响 Fig 4 Effect of pokemon-siRNA transfection on mRNA and protein expressions of P-gp, MRP1, LRP, and survivin in SGC7901/ADR cells A: Result of real-time quantitative PCR; B, C: Result of Western blotting. NS-siRNA: Non-specific control siRNA. P-gp: P-glycoprotein; MRP1: Multidrug resistance-associated protein 1; LRP: Lung resistance protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. *P < 0.05 vs NS-siRNA group. n=3, x±s |
3 讨论
胃癌具有较强的MDR能力[8-9],与治疗效果及预后密切相关。本研究通过对细胞株的检测发现胃癌细胞对不同机制的化疗药物5-FU、DDP、L-OHP的敏感性低于胃上皮细胞株GES-1,胃癌耐药细胞株SGC7901/ADR对药物的抵抗能力更强。胃癌MDR的机制复杂,多种分子、通路都参与其中[10-12],实现MDR逆转将提高胃癌化疗效果、改善预后。虽然胃癌MDR的研究已开展多年,但尚未取得突破,MDR机制一直是研究的热点。近年来转录因子pokemon在胃癌中的作用受到了关注。Pokemon基因定位于人染色体19p13.3,包括6个外显子,全长196 998 bp。研究表明pokemon具有原癌基因特征,对肿瘤的多种恶性生物学行为有促进作用。Li等[3]研究发现抑制前列腺癌细胞中pokemon表达可以抑制肿瘤的生长并诱导肿瘤细胞凋亡。本课题组前期研究发现,pokemon在胃癌组织中高表达,其表达强度与胃癌的发生和发展、侵袭及转移等生物学行为有关[4],这与Li等[3]的研究结果相符。本研究发现胃癌组织和胃癌细胞株中pokemon表达增强,提示pokemon可能参与了胃癌的进展。还有研究发现,在乳腺癌细胞中P-gp与pokemon存在调控关系,这种调控作用通过影响p53的表达实现[5],这一结果提示pokemon可能参与了肿瘤的耐药形成,但pokemon在胃癌耐药网络中的位置及具体作用还不明确,故本研究在此方面进行了初步研究。结果发现pokemon在胃癌组织表达比癌旁组织增强,在胃癌细胞株中表达也高于胃上皮细胞株;在耐药细胞株中pokemon表达最强,在普通胃癌细胞株中次之,在胃上皮细胞株中表达最低,这一结果与各细胞株的耐药性趋势一致,提示pokemon与胃癌细胞的耐药有关,可能在胃癌MDR形成中发挥了作用。
为探讨pokemon在胃癌MDR中的作用机制,本研究进一步检测了与胃癌MDR关系密切的蛋白质P-gp、MRP1、LRP、survivin的表达情况。P-gp、MRP1通过药泵作用可将药物排出细胞外而产生耐药[13-14];LRP通过胞吐作用可将进入细胞的药物排出[15];survivin则通过增强胃癌细胞的凋亡抵抗能力而导致胃癌细胞对铂类药物产生耐药[16]。本研究结果显示,胃癌组织中pokemon表达与P-gp、survivin存在正相关性,提示pokemon可能通过与P-gp、survivin相互调节而参与胃癌MDR。研究发现在乳腺癌细胞中P-gp可通过p53途径调节pokemon的转录功能[5],本研究也发现pokemon与P-gp存在调控关系,但结果显示在抑制pokemon的表达后P-gp表达明显降低,这与以往报道的pokemon与P-gp的调节关系[5]存在差异。我们分析认为pokemon作为一种转录因子,很可能与P-gp之间存在相互调控,但具体的分子机制还有待深入研究。还有研究发现pokemon可以通过上调survivin的表达而促进乳腺癌的进展[17],本研究在胃癌中也发现pokemon与survivin在胃癌组织中存在正相关,抑制耐药细胞中pokemon的表达后survivin的表达也明显降低,这说明pokemon与survivin之间的调控关系在胃癌细胞和乳腺癌细胞中类似,但具体分子调控机制还应进一步探讨。
为证实pokemon在胃癌MDR中发挥的作用,本研究应用RNA干扰技术抑制胃癌耐药细胞株SGC7901/ADR中pokemon的表达,结果发现,SGC7901/ADR的药物抵抗特性明显得到逆转,同时P-gp、survivin表达减弱,这证明了pokemon与P-gp、survivin之间具有调控作用,共同参与了胃癌MDR。但这些分子之间的直接调控功能还有待更为深入的研究予以证实。
| [1] | YU P, DU Y, YANG L, FAN S, WU J, ZHENG S. Significance of multidrug resistance gene-related proteins in the postoperative chemotherapy of gastric cancer[J]. Int J Clin Exp Pathol, 2014, 7: 7945–7950. |
| [2] | TAN B, LI Y, ZHAO Q, FAN L, LIU Y, WANG D, et al. Inhibition of Vav3 could reverse the drug resistance of gastric cancer cells by downregulating JNK signaling pathway[J]. Cancer Gene Ther, 2014, 21: 526–531. DOI: 10.1038/cgt.2014.59 |
| [3] | LI Y, XU S, WANG X, SHI H, SUN Z, YANG Z. Tumor-specific RNA interference targeting pokemon suppresses tumor growth and induces apoptosis in prostate cancer[J]. Urology, 2013, 81: 467.e1–467.e7. DOI: 10.1016/j.urology.2012.10.011 |
| [4] | 贾楠, 刘月平, 李勇. 胃癌组织Pokemon和p14ARF表达率及其在临床生物学行为中的意义[J]. 河北医科大学学报, 2012, 33: 263–267. DOI: 10.3969/j.issn.1007-3205.2012.03.006 |
| [5] | HE S, LIU F, XIE Z, ZU X, XU W, JIANG Y. P-Glycoprotein/MDR1 regulates pokemon gene transcription through p53 expression in human breast cancer cells[J]. Int J Mol Sci, 2010, 11: 3039–3051. DOI: 10.3390/ijms11093039 |
| [6] | LI Y, TAN B B, ZHAO Q, FAN L Q, LIU Y, HAO Y J, et al. Tumor chemosensitivity is correlated with expression of multidrug resistance associated factors in variously differentiated gastric carcinoma tissues[J]. Hepatogastroenterology, 2013, 60: 213–216. |
| [7] | ZHAO G T, YANG L J, LI X X, CUI H L, GUO R. Expression of the proto-oncogene pokemon in colorectal cancer——inhibitory effects of an siRNA[J]. Asian Pac J Cancer Prev, 2013, 14: 4999–5005. DOI: 10.7314/APJCP.2013.14.9.4999 |
| [8] | YU P, DU Y, YANG L, FAN S, WU J, ZHENG S. Significance of multidrug resistance gene-related proteins in the postoperative chemotherapy of gastric cancer[J]. Int J Clin Exp Pathol, 2014, 7: 7945–7950. |
| [9] | YU P, DU Y, CHENG X, YU Q, HUANG L, DONG R. Expression of multidrug resistance-associated proteins and their relation to postoperative individualized chemotherapy in gastric cancer[J]. World J Surg Oncol, 2014, 12: 307. DOI: 10.1186/1477-7819-12-307 |
| [10] | YU F, LI K, CHEN S, LIU Y, LI Y. Pseudolaric acid B circumvents multidrug resistance phenotype in human gastric cancer SGC7901/ADR cells by downregulating Cox-2 and P-gp expression[J]. Cell Biochem Biophys, 2015, 71: 119–126. DOI: 10.1007/s12013-014-0170-7 |
| [11] | ZHANG H, SUN L, XIAO X, XIE R, LIU C, WANG Y, et al. Krüppel-like factor 8 contributes to hypoxia-induced MDR in gastric cancer cells[J]. Cancer Sci, 2014, 105: 1109–1115. DOI: 10.1111/cas.2014.105.issue-9 |
| [12] | YING L, ZU-AN Z, QING-HUA L, QING-YAN K, LEI L, TAO C, et al. RAD001 can reverse drug resistance of SGC7901/DDP cells[J]. Tumour Biol, 2014, 35: 9171–9177. DOI: 10.1007/s13277-014-1719-1 |
| [13] | SUI H, CAI G X, PAN S F, DENG W L, WANG Y W, CHEN Z S, et al. miR200c attenuates P-gp-mediated MDR and metastasis by targeting JNK2/c-Jun signaling pathway in colorectal cancer[J]. Mol Cancer Ther, 2014, 13: 3137–3151. DOI: 10.1158/1535-7163.MCT-14-0167 |
| [14] | RYBÁROVÁ S, HODOROVÁ I, MIHALIK J, MIROSSAY L. MRP1 and GSTp1 expression in non-small cell lung cancer does not correlate with clinicopathological parameters:a Slovakian population study[J]. Acta Histochem, 2014, 116: 1390–1398. DOI: 10.1016/j.acthis.2014.09.002 |
| [15] | QIU Z Q, ZHAO K. Expression of ERCC1, RRM1 and LRP in non-small cell lung cancers and their influence on chemotherapeutic efficacy of gemcitabine concomitant with nedaplatin[J]. Asian Pac J Cancer Prev, 2014, 15: 7303–7307. DOI: 10.7314/APJCP.2014.15.17.7303 |
| [16] | GAĄSOWSKA-BODNAR A, BODNAR L, DAĄBEK A, CICHOWICZ M, JERZAK M, CIERNIAK S, et al. Survivin expression as a prognostic factor in patients with epithelial ovarian cancer or primary peritoneal cancer treated with neoadjuvant chemotherapy[J]. Int J Gynecol Cancer, 2014, 24: 687–696. DOI: 10.1097/IGC.0000000000000108 |
| [17] | ZU X, MA J, LIU H, LIU F, TAN C, YU L, et al. Pro-oncogene Pokemon promotes breast cancer progression by upregulating survivin expression[J]. Breast Cancer Res, 2011, 13: R26. DOI: 10.1186/bcr2843 |
 2017, Vol. 38
2017, Vol. 38


