急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)是一种广泛累及中枢神经系统(脑和脊髓)白质的急性炎性反应,以非对称多灶性或弥漫性脱髓鞘病灶为主要病理特征。ADEM临床表现多样,呈急性或亚急性起病,是儿童最常见的获得性脑白质病。本研究总结分析了3例昆明医科大学第一附属医院收治的ADEM患儿的临床特点、辅助检查、治疗、预后等资料,以期提高对ADEM的认识,现报告如下。
1 资料和方法 1.1 一般资料2015年10月1日至2016年3月1日昆明医科大学第一附属医院儿科收治ADEM患儿3例,其中1例为女孩(12岁);2例为男孩(分别为10岁和13岁),发病至就诊时间为4~7 d。3例患儿既往体健,起病前无疫苗接种及特殊物品接触史,否认高热惊厥及癫
患儿入院后,观察主要临床特征及体征,并行感染指标、脑脊液各项检查及磁共振成像(MRI)、脑电图等检查。病例3由于病情危重仅完善头颅MRI检查,脑电图为临终前检查。
1.3 治疗及随访3例患儿入院后均给予抗感染及脱水等治疗,明确诊断为ADEM后给予激素、静注人免疫球蛋白(intravenous immunoglobulin,IVIg)、B族维生素、单唾液酸四己糖神经节苷脂或鼠神经生长因子等治疗,并请眼科医师会诊。2例患儿接受康复训练。1例患儿住院期间死亡,2例患儿病情稳定后出院,出院后每2周随访1次。
2 结果 2.1 临床表现与体格检查病例1:女,12岁,因“发热4 d,步态不稳2 d”入院。入院前4 d无明显诱因发热,达38.4 ℃,偶恶心,食欲欠佳,无呕吐及抽搐,无肢体活动障碍及感觉异常,言语正常。入院前2 d步态不稳,呈醉酒步态,偶有双手不自主抖动,言语较平素明显减少,表情淡漠,进食量明显减少,偶有嗜睡,皮肤感觉过敏,大小便正常。入院时生命体征平稳,一般情况差,嗜睡,Glasgow评分10分(语言刺激能睁眼,能服从命令动作,无语言反应),定时、定位、记忆力、计算能力不配合,肌力及共济运动不配合,肌张力略低,感觉功能正常。腹壁反射减弱,膝腱及跟腱反射活跃,左侧Babinski征可疑阳性,余病理反射阴性,脑膜刺激征阴性。
病例2:男,10岁,因“发热、四肢无力伴意识障碍7 d”入院。患儿无明显诱因发热,达39.5 ℃,伴头痛、四肢抖动,随后双下肢无力,快速蔓延至四肢并意识障碍,呼之不应,不言语及尿潴留,当地州医院CT及脑脊液检查未发现异常,予抗感染及IVIg(2 d)等,体温下降至正常,可自主睁眼,四肢仍无力,不言语及尿潴留无改善。入院时体温35.8 ℃,呼吸频率(RR) 20/min,心率(HR) 79/min,血压(BP) 98/68 mmHg (1 mmHg=0.133 kPa),血氧饱和度(SpO2) 95%。一般情况差,痛苦面容。嗜睡,Glasgow评分6分(能自主睁眼,无运动及语言反应),定时、定位、记忆力、计算能力及感觉功能不配合,肌力0级,肌张力降低,共济运动不配合。角膜反射存在,腹壁、提睾、膝腱及跟腱反射未引出。病理反射阴性,颈强直阳性,Brudzinski及Kernig阴性。
病例3:男,13岁,因“发热6 d,意识障碍3 d,加重1 d”入院。入院前6 d无明显诱因发热,40 ℃,伴寒战,偶有头痛,无呕吐及抽搐。3 d前患儿(住校)未回家,家人四处寻找后于次日发现其倒在学校花园,意识不清,不能对答,不能行走。未见抽搐,体表未见开放性伤口,立即送至我院急诊科,予抗感染及脱水等治疗后可简单对答,体温波动于38.5~39.0 ℃,无抽搐。患儿于入院前1 d意识障碍较前加重,嗜睡,言语不清,不能对答,对时间、地点和人物定向不清,精神及饮食欠佳。入院时体温38.7 ℃,RR 35/min,HR 132/min,BP 115/71 mmHg,SpO2 88%。一般情况差,昏迷,Glasgow评分6分(不能自主睁眼,肢体因疼痛屈曲回缩,无语言反应)。双侧瞳孔等大等圆,对光反射灵敏,四肢肌张力增高,肌力、共济运动及感觉功能检查不配合。角膜反射存在,腹壁反射减弱,提睾反射未引出,肱二头肌、肱三头肌、膝腱及跟腱反射亢进。右侧Babinski可疑阳性,余病理反射阴性,颈强直、Brudzinski及Kernig阳性。
3例患儿的主要治疗、感染指标及脑脊液检查结果见表 1。3例患儿经眼科医师会诊后均排除视神经受累。
|
|
表 1 3例ADEM患儿的主要治疗、感染指标及脑脊液检查结果 |
2.2 MRI检查结果
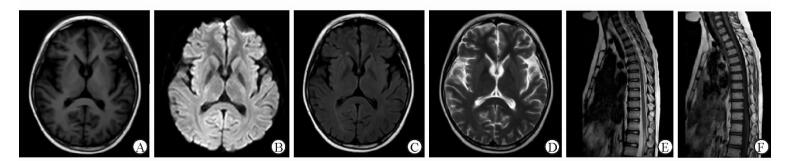
病例1:平扫头颅及脊髓未见异常信号,Flair序列双侧小脑半球及颞叶部分脑沟内线样高信号影;C2~T12水平脊膜节段性增厚强化;圆锥、终丝及马尾可见散在脊膜异常强化。病例2:双侧基底节区(尾状核、豆状核)见对称片状稍长T2、稍长T1信号改变,Flair序列呈稍高信号,弥散加权成像(DWI)未见异常信号,增强扫描未见明显强化;治疗前脊髓C3~C7水平稍肿胀及部分脊髓胸段可见稍长T2、稍长T1信号,脊髓全段增强扫描未见明显强化(图 1);治疗3个月后复查MRI示双侧基底节区及脊髓内异常信号消失(图 2)。病例3:双侧额叶、基底节区、海马、中脑、杏仁核及胼胝体内多发异常信号,伴双侧大脑半球脑膜广泛增厚强化(图 3)。

|
图 1 病例2治疗前磁共振成像(MRI)检查结果 A: T1WI示双侧基底节区呈对称稍长T1信号; B:弥散加权成像(DWI)未见异常信号; C: Flair序列呈升高信号; D: T2WI示双侧基底节区呈对称稍长T2信号; E:增强扫描未见明显强化; F: T2WI示脊髓C3~C7水平稍肿胀及部分脊髓胸段可见稍长T2信号; G: T1WI示脊髓C3~C7水平稍肿胀及部分脊髓胸段可见稍长T1信号; H:脊髓增强扫描未见明显强化 |
|
图 2 病例2治疗3个月后磁共振成像(MRI)检查结果 经过治疗后基底节及脊髓病变完全恢复正常. A: T1WI示双侧基底节区T1信号正常; B:弥散加权成像(DWI)未见异常信号; C: Flair序列未见异常信号; D: T2WI示双侧基底节区T2信号正常; E: T2WI示脊髓T2信号正常; F: T1WI示脊髓T1信号正常 |

|
图 3 病例3头颅磁共振成像(MRI)检查结果 A: Flair强化序列示额叶及基底节区多发异常信号及双侧大脑半球脑膜广泛增厚强化; B: T2WI示海马、中脑、杏仁核内可见多发异常信号; C:弥散加权成像(DWI)示胼胝体内多发异常信号.箭头所指为病变部位 |
2.3 治疗结果及预后
病例1:住院期间患儿步态不稳加重,呈嗜睡与烦躁交替,不能对答,不愿主动进食,精神反应欠佳。予激素、IVIg等治疗后患儿可自行进食,微笑自然,下床行走,方向感稍差,步态稍不稳,肌力及肌张力正常,共济运动正常,感觉功能正常,病理反射未引出,予康复训练并继续服用泼尼松,逐渐减量至起病后5个月停药。患儿语言、运动、感觉及自主神经功能均恢复正常。病例2:住院第6天意识转清,Glasgow评分9分;住院第14天面容自然,Glasgow评分13分,能简单言语,吐字不清,能经口进食,可自行排尿,无尿失禁及尿潴留。双上肢能服从命令运动,定时、定位、记忆力及计算能力基本正常,双上肢肌力3级,右下肢肌力1级,左下肢肌力0级,下肢肌张力低;指鼻试验阴性,其余共济运动不能完成。腹壁及提睾反射正常引出,肱二头肌、肱三头肌、膝腱及跟腱反射未引出,脑膜刺激征阴性。病情相对平稳后予康复训练,于住院第21天能正常交流,声音清晰,定时、定位、记忆力及计算能力正常。双上肢肌力4级,双下肢肌力2-级,下肢肌张力仍低。肱二头肌及肱三头肌反射正常引出,膝腱及跟腱反射未引出。继续予康复训练及口服泼尼松等治疗,激素逐渐减量至3个月后停用。患儿运动功能恢复可,基本情况同病前。病例3:患儿意识障碍逐渐加重,体温难以下降至正常。于住院第2天出现癫
ADEM发病与病毒感染、疫苗接种有关,部分病例无确切病因,典型的ADEM为单相病程,经过积极治疗后多数预后良好;而多相ADEM则需要与多发性硬化、视神经脊髓炎等疾病相区别。ADEM好发于儿童和青少年,成人少见,特异性实验室指标少,临床上容易被误诊或漏诊[1]。AHLE是ADEM最严重的形式,是一种极少见的非常急剧的中枢神经系统炎性疾病,以儿童多见且无性别差异,临床表现凶险。AHLE往往是突然发病,伴随出现难以下降至正常的高热、进行性意识障碍、锥体束损害、癫
ADEM的发病机制目前尚不明确,本研究中病例1发生在消化道感染后,病例2、3无明显诱因。其发病机制主要涉及免疫机制,其中分子模拟机制已得到广泛认可[3-4]。ADEM的诊断主要依赖于临床表现和影像学特点[5-6]。2013年国际儿童多发性硬化研究组提出了新的儿童ADEM诊断标准(必须具备以下所有标准)[7]:(1) 第1次多灶性中枢神经系统事件(很可能为炎症性脱髓鞘所致);(2) 脑病症状(意识障碍或行为改变),且无法用发热进行解释;(3) 起病3个月后无新的临床或MRI病灶出现;(4) 急性期(3个月内)头颅MRI信号异常;(5) 典型头颅MRI表现,包括广泛、边界欠清晰及较大的(>1~2 cm)病灶,主要累及大脑白质,白质区T1低信号病灶极少见及可伴有深部灰质核团(如丘脑或基底核)病灶。典型临床表现一般在起病后3个月内会有变化,呈单相病程且占80%~90%。无论使用激素与否,在起病3个月后新出现的临床表现均被认为是新发事件。该诊断标准取消了2007年标准中的复发性ADEM,仅保留了多相性ADEM,且对其的诊断也进行了修订:(1)2次符合ADEM诊断标准的发作,间隔至少3个月,且后续不再出现发作;(2) 第2次发作的症状、体征及MRI表现既可以与第1次相同,也可完全不同。在第2次ADEM脑病事件发生后再次出现的疾病状态不认为是多相ADEM,很有可能发展为多发性硬化或视神经脊髓炎。从诊断标准来看,ADEM更应该被认为是一种综合征,而不是一种独立的疾病。ADEM病灶弥散与周围正常组织界限不清,但其临床表现相对较轻,呈影像重而临床轻、影像与临床症候分离的特点,尤其是以脊髓损伤为主时。本研究中病例1、2均急性起病,病例1以发热、意识障碍、步态不稳、不言语及感觉异常等为主要表现,Glasgow评分10分,有异常神经系统体征,MRI示病变累及颞叶、小脑半球及多节段脊髓等部位;而病例2以发热、意识障碍、肢体无力、不言语、感觉异常及尿潴留等为主要表现,嗜睡,Glasgow评分6分,MRI示病变累及双侧基底节区及颈、胸段脊髓,可见多发异常信号。病情好转后复查MRI示病灶较前明显好转,均符合ADEM的特点。
目前尚无被广泛采用的AHLE诊断标准,前驱表现、典型症状及体征、影像学检查和实验室检查等对该病的诊断均不具有特异性。作为ADEM的一种严重变异型,AHLE发病更急、进展更快、病死率更高[8]。本研究中病例3无明显诱因起病,以发热、头痛、意识障碍、语言异常、抽搐及精神行为异常为主要表现,病情进展极快;患儿在治疗期间出现中枢性呼吸衰竭、脑疝、尿崩及内环境严重紊乱等危及生命情况,MRI异常明显,符合AHLE特点[2, 9]。
目前尚无关于ADEM药物治疗的大样本多中心随机对照临床试验[1]。ADEM的治疗以大剂量激素冲击为主,但药物种类、剂量和减量方案至今尚未统一。大多数儿童使用甲泼尼龙(10~30 mg·kg-1·d-1,最大剂量为1 g/d)或地塞米松(1 mg·kg-1·d-1)治疗3~5 d,之后调整为口服激素,并逐渐减量维持3~6个月。IVIg也可用于治疗ADEM,其单独或联合糖皮质激素成功治疗ADEM的研究已有报道,但尚无关于IVIg与激素、血浆置换和其他免疫调节剂的对比研究[10]。IVIg的给药剂量基本统一,总剂量1~2 g/kg,分3~5 d给予。儿童尤其是重症患儿对IVIg的耐受性一般较好。研究发现,甲泼尼龙冲击联合IVIg可以提高治疗显效率,缩短疗程,并可能减少激素冲击治疗并发症的发生[11]。本研究中病例1、2均使用激素联合IVIg治疗,效果良好。血浆置换仅在少数病例中报道,特别是糖皮质激素治疗无效的重症患者,一般不作为首选治疗方案[12]。B族维生素等营养神经类药物通过稳定神经细胞膜减少细胞凋亡,促进轴突生长和突触的传递;此外,还可通过增强细胞内核酸和蛋白质的合成,促进卵磷脂合成和神经再生,有助于改善神经传导、恢复神经支配功能及促进脑电活动恢复。恢复期还可以进行功能康复训练,病例1和病例2均从中获益。
AHLE病情进展快,积极治疗手段包括降低颅内压,维持内环境稳定及保持呼吸道通畅,联合应用激素、IVIg及血浆置换等。Khademi等[8]曾报道1例患有AHLE的13岁患儿,经过甲泼尼龙(20 mg·kg-1·d-1)、IVIg、阿昔洛韦(30 mg·kg-1·d-1)及3次血浆置换后病情明显好转,复查MRI较前明显好转,神经系统查体无异常体征。由于此病危重,目前尚无随机对照试验数据。本研究中病例3使用激素联合IVIg治疗,但由于病情进展快,出现多种危及生命情况,治疗效果欠佳,最终死亡。
综上,多数ADEM患儿预后良好,在起病数周至数月内能完全康复,部分患儿有轻微的神经功能受损症状,少数爆发型患儿在疾病早期即死亡。ADEM主要后遗症为肢体瘫痪、轻度认知功能障碍、感觉异常、视力损害、癫
| [1] | ESPOSITO S, DI PIETRO G M, MADINI B, MASTROLIA M V, RIGANTE D. A spectrum of inflammation and demyelination in acute disseminated encephalomyelitis (ADEM) of children[J]. Autoimmun Rev, 2015, 14: 923–929. DOI: 10.1016/j.autrev.2015.06.002 |
| [2] | PINTO P S, TAIPA R, MOREIRA B, CORREIA C, MELO-PIRES M. Acute hemorrhagic leukoencephalitis with severe brainstem and spinal cord involvement:MRI features with neuropathological confirmation[J]. J Magn Reson Imaging, 2011, 33: 957–961. DOI: 10.1002/jmri.v33.4 |
| [3] | SOBEL R A. Anti-viral T-cell immunity+Anti-CNS Autoantibody=A model for human acute disseminated encephalomyelitis or multiple sclerosis relapse?[J]. Am J Pathol, 2007, 170: 436–438. DOI: 10.2353/ajpath.2007.061098 |
| [4] | MARIN S E, CALLEN D J. The magnetic resonance imaging appearance of monophasic acute disseminated encephalomyelitis:an update post application of the 2007 consensus criteria[J]. Neuroimaging Clin N Am, 2013, 23: 245–266. DOI: 10.1016/j.nic.2012.12.005 |
| [5] | KOELMAN D L, CHAHIN S, MAR S S, VENKATESAN A, HOGANSON G M, YESHOKUMAR A K, et al. Acute disseminated encephalomyelitis in 228 patients:a retrospective, multicenter US study[J]. Neurology, 2016, 86: 2085–2093. DOI: 10.1212/WNL.0000000000002723 |
| [6] | GRANEROD J, DAVIES N W, MUKONOWESHURO W, MEHTA A, DAS K, LIM M, et al. Neuroimaging in encephalitis:analysis of imaging findings and interobserver agreement[J]. Clin Radio, 2016, 71: 1050–1058. DOI: 10.1016/j.crad.2016.03.015 |
| [7] | KRUPP L B, TARDIEU M, AMATO M P, BANWELL B, CHITNIS T, DALE R C, et al. International Pediatric Multiple Sclerosis Study Group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders:revisions to the 2007 definitions[J]. Mult Scler, 2013, 19: 1261–1267. DOI: 10.1177/1352458513484547 |
| [8] | KHADEMI G R, AELAMI M H. Acute hemorrhagic leukoencephalitis in children:a case report[J]. Iran J Med Sci, 2016, 41: 245–248. |
| [9] | 任宁, 陈荣杰, 徐小林. 急性出血性白质脑炎的诊断及治疗研究进展[J]. 山东医药, 2015, 55: 95–97. DOI: 10.3969/j.issn.1002-266X.2015.01.041 |
| [10] | BERZERO G, CORTESE A, RAVAGLIA S, MARCHIONI E. Diagnosis and therapy of acute disseminated encephalomyelitis and its variants[J]. Expert Rev Neurother, 2016, 16: 83–101. DOI: 10.1586/14737175.2015.1126510 |
| [11] | BENSON L A, OLSON H, GORMAN M P. Evaluation and treatment of autoimmune neurologic disorders in the pediatric intensive care unit[J]. Semin Pediatr Neurol, 2014, 21: 284–290. DOI: 10.1016/j.spen.2014.12.008 |
| [12] | BEVAN C J, CREE B A. Fulminant demyelinating diseases of the Central Nervous System[J]. Semin Neurol, 2015, 35: 656–666. DOI: 10.1055/s-00000071 |
| [13] | SUPPIEJ A, CAINELLI E, CASARA G, CAPPELLARI A, NOSADINI M, SARTORI S. Long-term neurocognitive outcome and quality of life in pediatric acute disseminated encephalomyelitis[J]. Pediatr Neurol, 2014, 50: 363–367. DOI: 10.1016/j.pediatrneurol.2013.12.006 |
 2017, Vol. 38
2017, Vol. 38


