近年来,肺动脉高压(pulmonary arterial hypertension, PAH)逐渐引起医学界的关注,已然成为备受重视的一大类心血管疾病。PAH是由于多种病因侵犯肺小血管,引发肺血管闭塞重建,导致肺循环阻力进行性增加,右心负荷增加,最终导致右心衰竭而引起一系列临床症状甚至死亡的一类恶性心脏血管疾病。PAH病因复杂,诊断和治疗棘手,相关流行病学研究表明,PAH的发病率逐年升高,且死亡率高,预后极差[1-3],即使使用了PAH靶向药物,PAH的5年病死率仍接近50%[4-5]。金雀异黄酮(genistein)是植物雌激素的一种,相关研究发现它能抑制血管平滑肌细胞增殖、改善血管内皮功能、舒张血管,相较于波生坦(bosentan)、他达拉非(tadalafil)等靶向药物,金雀异黄酮价格低廉、容易获得、不良反应少[6-7]。我们前期研究发现金雀异黄酮能降低野百合碱诱导的大鼠PAH,改善右心功能,提高生存率,且其机制与PI3K/AKT-eNOS信号通路有关[8]。本研究比较了金雀异黄酮、波生坦、他达拉非治疗PAH模型大鼠的疗效,为金雀异黄酮治疗PAH进一步提供实验依据。
1 材料和方法 1.1 主要试剂与药品野百合碱(98%,美国Sigma公司);金雀异黄酮(98%,江苏晶美生物科技有限公司);波生坦由爱可泰隆公司江西代理惠赠;他达拉非由美国礼来公司江西代理惠赠;10%水合氯醛(大连美仑生物技术有限公司);磷酸盐缓冲液(PBS)原粉(北京中杉金桥生物技术有限公司);二甲亚砜(dimethyl sulfoxide,DMSO;北京索莱宝科技有限公司);4%多聚甲醛、N-硝基-L-精氨酸甲酯(NG-nitro-L-arginine methyl ester, L-NAME;武汉谷歌生物有限公司);肝素钠注射液(齐鲁制药厂,生产批号:033020031);乙酰胆碱、去甲肾上腺素、硝普钠(SNP, 北京索莱宝科技有限公司);氯化钠、氯化钾、硫酸镁、氯化钙、磷酸二氢钾、碳酸氢钠、葡萄糖、氢氧化钠、乙二胺四乙酸(EDTA)均为国产分析纯。
1.2 动物出生后3个月的雄性清洁级SD大鼠,体质量250~300 g,购自南昌大学医学院实验动物中心,实验动物使用许可证号:SYXK(赣)2010-0002。
1.3 主要仪器PowerLab多通道生理记录仪(澳大利亚AD Instrument公司);Vivid7 Dimension心脏超声检测仪(美国GE公司);PE50导管(美国健康医疗仪器国际公司);压力换能器(南昌大学第一附属医院高血压研究所);显微手术器械(上海手术器械厂);620M DMT微血管张力测定仪、金属丝[埃德仪器国际贸易(上海)有限公司];解剖显微镜(日本Olympus电子公司);电子精密天平(美国Beckman公司);电子秤(梅特勒-托利多仪器有限公司);4 ℃冰箱、实验室超纯水系统(美国Thermo公司);16号灌胃直针(上海手术器械厂);移液器(德国Eppendorf公司)。
1.4 大鼠PAH模型制作从56只SD大鼠中随机选取8只作为正常对照组,给予一次性腹腔注射生理盐水;其余48只为模型组,参考文献[8-10]后给予一次性腹腔注射野百合碱50 mg/kg,3周后即可建立PAH模型。从PAH模型组中随机选取8只大鼠作为PAH组,连续2周给予生理盐水灌胃;从剩余的PAH模型大鼠中随机选取24只大鼠作为金雀异黄酮组,随机再分为3组(G30、G60、G120组),每组8只,连续2周分别给予30、60、120 mg/(kg·d)金雀异黄酮灌胃;将最后剩余的16只PAH模型大鼠随机分为2组,每组8只,连续2周分别给予波生坦5 mg/(kg·d)或他达拉非0.5 mg/(kg·d)灌胃[11-15]。
1.5 观察指标 1.5.1 大鼠生存曲线的绘制在实验过程中严密观察SD大鼠的生存情况,并在建模成功后药物治疗2周末记录各组大鼠的存活情况,计算生存率,采用GraphPad Prism 5.0软件绘制大鼠的生存曲线。
1.5.2 心脏超声测定大鼠右心相关指标治疗2周后,每组大鼠用10%水合氯醛(剂量为3 mL/kg)腹腔注射予以麻醉,在胸前区备皮后,仰卧位固定于动物手术台上,行心脏多普勒超声检查,测定右房室瓣反流速度以及肺动脉内径。
1.5.3 右心导管法测定大鼠肺动脉压力完成心脏超声检查后,按文献[8, 16-17]报道的方法,经右侧颈外静脉将肝素化的聚乙烯右心导管顺着颈外静脉缓慢推入右心房、右心室、肺动脉干,使用PowerLab生物信息采集与处理系统采集、记录压力波形及平均肺动脉压。
1.5.4 微血管环张力测定法测定肺小动脉血管张力上述实验结束后处死大鼠,取出左侧肺叶,分离一段长约3 mm、直径为100~200 μm的肺小动脉环,并用金属丝固定在预备好盛有生理盐水溶液的37 ℃恒温四腔离体组织浴槽中,经过标准化、肺动脉环收缩性的检验后,待张力平衡,浴槽中换为高钾生理盐水溶液,加入去甲肾上腺素预收缩达到最大收缩张力,再给予系列浓度梯度(10-10~10-4 mmol/L)的乙酰胆碱(ACh),每加入一个浓度待张力稳定之后记录稳定的张力值。用高钾生理盐水溶液反复冲洗数次,待张力恢复至初始值,向四腔离体组织浴槽中加入内皮型一氧化氮合酶(eNOS)抑制剂L-NAME(10-4 mmol/L)作用0.5 h后,先预收缩达到最大收缩张力,再逐渐加入系列浓度梯度(10-10~10-4 mol/L)的SNP,每加入一个浓度的SNP待张力稳定之后记录稳定的张力值。
1.5.5 大鼠右心室肥厚指数的测定取出大鼠心脏,在PBS中冲洗干净,沿着房室间沟剪去左、右心房和大血管根部,再沿室间隔边缘剪下右心室。用滤纸吸干后,用精密天平称取右心室质量(RV)、左心室+室间隔的质量(LV+S),按公式计算右心室肥厚指数:右心室肥厚指数(%)=[RV/(LV+S)]×100%。
1.5.6 大鼠肺小血管病理标本制作取出大鼠右肺组织,用PBS清洗干净后,将右肺上叶浸泡在4%多聚甲醛溶液中固定,用石蜡包埋,冰冻切片机切片后常规脱蜡行H-E染色。各组大鼠选取3张肺组织切片,每张切片随机选取3支直径100~200 μm的肺动脉,应用Image Pro-Plus 6.0软件测量每条肺动脉的血管截面总面积、管腔截面面积、管壁厚度、血管外径,计算肺动脉血管截面总面积和管腔截面面积之差与血管截面总面积的百分比(WA%)和肺动脉血管管壁厚度与外径的百分比(WT%)。
1.6 统计学处理应用SPSS 20.0软件进行统计学处理,组间比较采用单因素方差分析,计量资料用x±s表示;生存分析采用Kaplan-Meier法分析,生存率组间比较用log-rank检验,检验水准(α)为0.05。用非线性回归曲线拟合计算出pD2和Emax(pD2是产生50%最大收缩/舒张效应的药物摩尔浓度的负对数,Emax是最大收缩/舒张幅度)。
2 结果 2.1 大鼠生存情况金雀异黄酮治疗的PAH大鼠与单纯PAH组大鼠相比,精神、活动量、食量均改善,生存率提高,且呈剂量依赖性,治疗剂量越大情况改善越明显,但改善程度不及他达拉非组、波生坦组(图 1)。
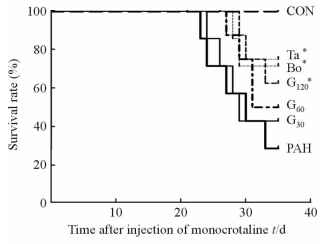
|
图 1 各组大鼠生存率情况 Fig 1 Survival rate of rats in each group CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). *P < 0.05 vs PAH group |
2.2 大鼠右房室瓣反流情况
除G30组与PAH组之间差异无统计学意义外,G60、G120组均可以降低PAH大鼠右房室瓣反流速度(P < 0.05),且G120组降低右房室瓣反流速度的效果比G60组好,但金雀异黄酮各组降低右房室瓣反流速度的效果均次于他达拉非、波生坦组,差异有统计学意义(P < 0.05)。见图 2。
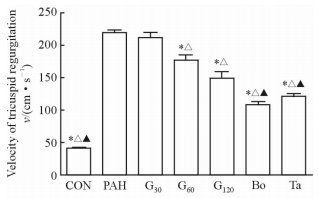
|
图 2 各组大鼠右房室瓣反流速度 Fig 2 Velocity of tricuspid regurgitation of rats in each group CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). *P < 0.05 vs PAH group; △P < 0.05 vs G30 group; ▲P < 0.05 vs G120 group. n=8, x±s |
2.3 大鼠肺动脉内径变化情况
金雀异黄酮仅G120组可以减小PAH大鼠肺动脉内径(P < 0.05),但程度不及波生坦组和他达拉非组((P < 0.05))。见图 3。
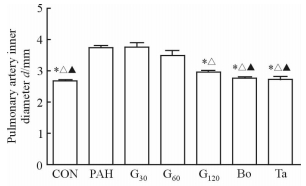
|
图 3 各组大鼠肺动脉内径 Fig 3 Pulmonary artery inner diameter of rats in each group CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). *P < 0.05 vs PAH group; △P < 0.05 vs G30 group; ▲P < 0.05 vs G120 group. n=8, x±s |
2.4 大鼠平均肺动脉压变化情况
金雀异黄酮各剂量组均可降低PAH大鼠平均肺动脉压(P < 0.05),但G30组与G60组之间差异无统计学意义,G120组降低肺动脉平均压的效果较G30组更明显,差异有统计学意义(P < 0.05),但不如波生坦组和他达拉非组效果显著(P < 0.05)。见图 4。

|
图 4 各组大鼠平均肺动脉压 Fig 4 Mean pulmonary artery pressure of rats in each group 1 mmHg=0.133 kPa. CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). *P < 0.05 vs PAH group; △P < 0.05 vs G30 group; ▲P < 0.05 vs G120 group. n=8, x±s |
2.5 大鼠肺血管环舒张功能变化情况
通过计算和比较各组pD2及Emax值得出,各组大鼠之间离体肺血管环SNP诱导的非内皮依赖性舒张功能差异无统计学意义(P > 0.05,图 5A)。同样通过计算和比较各组pD2及Emax值,结果显示各剂量金雀异黄酮均可改善ACh诱导的大鼠肺动脉内皮依赖性舒张功能,差异有统计学意义(P < 0.05),且随着金雀异黄酮剂量增加舒张功能改善越明显;而波生坦及他达拉非组改善PAH大鼠ACh诱导的肺动脉内皮依赖性舒张功能的效果较各剂量金雀异黄酮组更显著,差异有统计学意义(P < 0.05,图 5B)。

|
图 5 各组大鼠肺动脉环的舒张情况 Fig 5 Relaxation of pulmonic ring of rats in each group A: Endothelium-independent relaxation induced by 10-10-10-4 mol/L SNP; B: Endothelium-dependent relaxation induced by 10-10-10-4 mmol/L ACh. CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). SNP: Sodium nitroprusside; ACh: Acetylcholine. *P < 0.05 vs PAH group. n=8, x±s |
2.6 大鼠右心室肥厚指数测定结果
除G30组与PAH组之间差异无统计学意义外,G60、G120组均可以降低PAH大鼠右心室肥厚指数(P < 0.05),但金雀异黄酮各组降低右心室肥厚指数的效果均次于他达拉非组和波生坦组(图 6)。
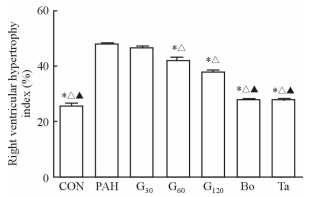
|
图 6 各组大鼠右心室肥厚指数 Fig 6 Right ventricular hypertrophy indexes of rats in each group CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). *P < 0.05 vs PAH group; △P < 0.05 vs G30 group; ▲P < 0.05 vs G120 group. n=8, x±s |
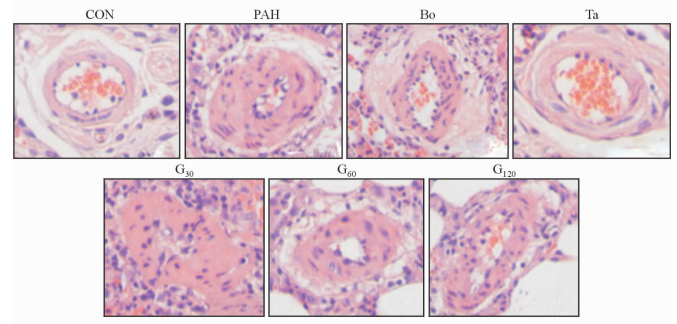
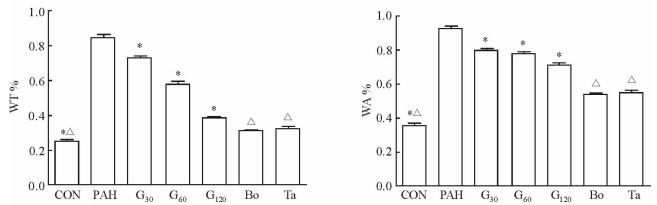
2.7 肺血管病理形态
金雀异黄酮各剂量组均可以改善肺动脉管壁增厚、管腔狭窄、平滑肌增生,抑制肺血管重构,且呈剂量依赖性,但这一作用不及波生坦和他达拉非(图 7、8)。
|
图 7 各组大鼠肺血管病理形态 Fig 7 Pulmonary vascular pathologic morphology of rats in each group CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). H-E staining. Original magnification: ×400 |
|
图 8 各组大鼠WT%和WA% Fig 8 WT% (ratio of vascular wall thickness to vascular external diameter) and WA% (ratio of vascular wall area to total vascular area) of rats in each group CON: Control; PAH: Pulmonary arterial hypertension; G30, G60, G120: Lavage with genistein 30, 60, 120 mg/(kg·d); Bo: Lavage with bosentan 5 mg/(kg·d); Ta: Lavage with tadalafil 0.5 mg/(kg·d). *P < 0.05 vs PAH group; △P < 0.05 vs G30 group. n=8, x±s |
3 讨论
大量研究发现,雌激素对肺血管具有保护作用[16-18],其作用可概括为直接效应和间接效应。直接效应有保护和调节肺血管内皮细胞功能,抑制肺血管平滑肌细胞增殖、迁移,舒张血管平滑肌等;间接效应包括通过调节脂质代谢、改善血流动力学、改善凝血纤溶系统的功能、抗氧化、抗炎症作用来改善血管功能,减弱有害刺激的细胞反应等。虽然众多研究表明雌激素对肺血管具有保护作用,但服用普通雌激素可能会出现各种并发症,如增加子宫内膜癌、乳腺癌等的发病风险[19-20]。
植物雌激素是一类结构和功能与雌激素类似,广泛存在于植物中的杂环多酚类化合物,它常以糖苷的形式存在于植物中,在体内可经过肠道细菌糖苷酶的水解而成为有活性的苷元,然后再与体内的雌激素受体结合,从而发挥类似雌激素样的作用,而且目前暂未发现明显的毒副作用。金雀异黄酮是植物雌激素的一种,又叫做染料木素,它是来源于豆科植物和齿状植物的天然异黄酮类化合物,其分子结构与人体自身雌激素相同,金雀异黄酮能选择性、低亲和性并高效地与雌激素受体结合,发挥其类雌激素样作用。
本实验通过腹腔注射野百合碱建立PAH大鼠模型,与对照组相比,PAH组的存活率、右房室瓣反流速度、肺动脉内径、平均肺动脉压均明显增加(P < 0.05),表明成功建立了PAH的模型。本实验使用浓度为30、60、120 mg/kg的金雀异黄酮给大鼠灌胃,结果显示金雀异黄酮能有效降低野百合碱诱导的PAH大鼠肺动脉压力,改善其肺血管内皮依赖性舒张功能及右心功能,抑制肺血管及心室重构,提高野百合碱诱导的PAH大鼠的生存率,且对生存率的提高、肺血管内皮依赖性舒张功能的改善以及肺血管及心室重构的抑制作用方面存在一定的剂量依赖性,证明金雀异黄酮对治疗PAH有一定的疗效。本实验设立了波生坦及他达拉非治疗组,结果表明所选择的金雀异黄酮剂量对野百合碱诱导的PAH的疗效不及波生坦、他达拉非(P < 0.05),但波生坦、他达拉非等靶向药物价格昂贵,而金雀异黄酮价格低廉、容易获得、不良反应较少,对PAH的治疗仍有重要的意义。
植物雌激素治疗PAH的具体机制尚不明确。2010年Kim等[21]通过对离体实验中金雀异黄酮对肿瘤坏死因子抑制人类平滑肌细胞增殖作用的研究,发现金雀异黄酮与雌激素受体结合后,可通过非基因效应下调丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)的活性,起到抑制平滑肌细胞增殖的作用;而Xu等[22]研究发现植物雌激素可能通过抑制炎症因子减轻内皮细胞的损害,改善内皮功能;Zhang等[23]在离体实验中发现植物雌激素可通过抑制钙通道及激活钾通道发挥舒血管作用;Nakaya等[24]发现植物雌激素可以通过eNOS-NO-cGMP途径舒张血管;结合其他相关研究,证明植物雌激素有抑制血管平滑肌增殖、改善内皮功能、舒张血管作用[25-27]。研究还发现金雀异黄酮可能通过雌激素受体β逆转体内PAH诱导的肺血管重构,并抑制体外肺动脉平滑肌细胞增殖[28]。还有研究表明金雀异黄酮可能通过调节EPO/EPOR系统和NO介导的信号转导而改善低氧PAH[29]。
综上所述,本实验从动物水平证实金雀异黄酮对PAH有一定的疗效,提示植物雌激素对PAH具有潜在的重要治疗价值,其对PAH治疗作用的具体机制有待于进一步研究。本次实验尚有一定的局限性,首先实验采用野百合碱诱导大鼠PAH,相关研究表明其诱导的PAH接近结缔组织相关性PAH,因此,本研究仅能反映金雀异黄酮、波生坦、他达拉非对类似结缔组织相关性PAH的影响,而上述药物对其他类型的PAH是否有类似影响有待进一步研究;其次本实验仅设立30、60、120 mg/(kg·d)的剂量组,尚不可知再增加治疗剂量能否进一步提高其治疗野百合碱诱导的大鼠PAH的疗效,以及随着剂量的增加是否会产生严重不良反应。后期研究尚可增加金雀异黄酮联合波生坦和他达拉非组,评价在现有公认PAH的治疗方案上联合金雀异黄酮是否能进一步改善相关指标,以进一步考察金雀异黄酮的实际应用价值。
| [1] | CHAZOVA I E, ARKHIPOVA O A, VALIEVA Z S, NAKONECHNIKOV S N, MARTYNIUK T V. [Pulmonary hypertension in Russia:the first results of the national register][J]. Ter Arkh, 2014, 86: 56–64. |
| [2] | 董琳, 何建国, 柳志红, 卢献灵, 曾伟杰, 孙云娟, 等. 成人肺动脉高压疾病特征的多中心临床研究[J]. 中华医学杂志, 2012, 92: 1087–1090. DOI: 10.3760/cma.j.issn.0376-2491.2012.16.003 |
| [3] | JING Z C, XU X Q, HAN Z Y, WU Y, DENG K W, WANG H, et al. Registry and survival study in Chinese patients with idiopathic and familial pulmonary arterial hypertension[J]. Chest, 2007, 132: 373–379. DOI: 10.1378/chest.06-2913 |
| [4] | McLAUGHLIN V V, ARCHER S L, BADESCH D B, BARST R J, FARBER H W, LINDNER J R, et al. ACCF/AHA 2009 Expert Consensus Document on pulmonary hypertension:a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association Developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association[J]. J Am Coll Cardiol, 2009, 53: 1573–1619. DOI: 10.1016/j.jacc.2009.01.004 |
| [5] | KAWUTS M, 文莉, 徐希奇. 肺动脉高压的流行病学、危险因素和个性化治疗[J]. 中华心血管病杂志, 2014, 42: 453–454. DOI: 10.3760/cma.j.issn.0253-3758.2014.06.003 |
| [6] | KIM D S, KWON D Y, KIM M S, KIM H K, LEE Y C, PARK S J, et al. The involvement of endoplasmic reticulum stress in flavonoid-induced protection on cardiac cell death caused by ischaemia/reperfusion[J]. J Pharm Pharmacol, 2010, 62: 197–204. DOI: 10.1211/jpp.2010.62.issue-2 |
| [7] | MANN G E, BONACASA B, ISHII T, SIOW R C. Targeting the redox sensitive Nrf2-Keap1 defense pathway in cardiovascular disease:protection afforded by dietary isoflavones[J]. Curr Opin Pharmacol, 2009, 9: 139–145. DOI: 10.1016/j.coph.2008.12.012 |
| [8] | 余松平. 金雀异黄酮通过激活PI3K/Akt-eNOS信号通路改善野百合碱诱导的大鼠肺动脉高压[D]. 江西: 南昌大学, 2014: 52. http://cdmd.cnki.com.cn/Article/CDMD-10403-1014053893.htm |
| [9] | MORIMATSU Y, SAKASHITA N, KOMOHARA Y, OHNISHI K, MASUDA H, DAHAN D, et al. Development and characterization of an animal model of severe pulmonary arterial hypertension[J]. J Vasc Res, 2011, 49: 33–42. |
| [10] | 李彦川, 李欣欣. 几种常用的肺动脉高压动物模型简述[J]. 医学综述, 2012, 18: 121–123. DOI: 10.3969/j.issn.1006-2084.2012.01.043 |
| [11] | SAWAMURA F, KATO M, FUJITA K, NAKAZAWA T, BEARDSWORTH A. Tadalafil, a long-acting inhibitor of PDE5, improves pulmonary hemodynamics and survival rate of monocrotaline-induced pulmonary artery hypertension in rats[J]. J Pharmacol Sci, 2009, 111: 235–243. DOI: 10.1254/jphs.09110FP |
| [12] | PEHLIVAN Y, DOKUYUCU R, DEMIR T, KAPLAN D S, KOC I, ORKMEZ M, et al. Palosuran treatment effective as bosentan in the treatment model of pulmonary arterial hypertension[J]. Inflammation, 2014, 37: 1280–1288. DOI: 10.1007/s10753-014-9855-8 |
| [13] | CLOZEL M, HESS P, REY M, IGLARZ M, BINKERT C, QIU C. Bosentan, sildenafil, and their combination in the monocrotaline model of pulmonary hypertension in rats[J]. Exp Biol Med (Maywood), 2006, 231: 967–973. |
| [14] | 刘海莲, 张玉顺, 王佳兴, 朱妙章. 波生坦对慢性低氧性肺动脉高压大鼠右心室肥厚及缝隙连接蛋白(Cx)43表达的影响[J]. 心脏杂志, 2010, 22: 51–55. |
| [15] | 姜波. 他拉达非对肺动脉高压模型大鼠降钙素基因相关肽、p27及p-ERK1/2表达的影响[J]. 中国药业, 2015, 24: 27–29. |
| [16] | ZIMMER H G, ZIERHUT W, SEESKO R C, VAREKAMP A E. Right heart catheterization in rats with pulmonary hypertension and right ventricular hypertrophy[J]. Basic Res Cardiol, 1988, 83: 48–57. DOI: 10.1007/BF01907104 |
| [17] | 袁平, 吴文汇, 刘岽, 张锐, 荆志成. 改良心导管测定大鼠肺血管阻力的方法[J]. 中华心血管病杂志, 2011, 39: 901–904. DOI: 10.3760/cma.j.issn.0253-3758.2011.10.006 |
| [18] | 张颖, 殷惠军. 植物雌激素的心血管保护作用研究进展[J]. 中华老年心脑血管病杂志, 2012, 14: 991–994. DOI: 10.3969/j.issn.1009-0126.2012.09.029 |
| [19] | MOREIRA A C, SILVA A M, SANTOS M S, SARDÃO V A. Phytoestrogens as alternative hormone replacement therapy in menopause:what is real, what is unknown[J]. J Steroid Biochem Mol Biol, 2014, 143: 61–71. DOI: 10.1016/j.jsbmb.2014.01.016 |
| [20] | JYOTSNA V P. Postmenopausal hormonal therapy:current status[J]. Indian J Endocrinol Metab, 2013, 17(Suppl 1): S45–S49. |
| [21] | KIM H, LEE M J, KIM J E, PARK S D, MOON H I, PARK W H. Genistein suppresses tumor necrosis factor-α-induced proliferation via the apoptotic signaling pathway in human aortic smooth muscle cells[J]. J Agric Food Chem, 2010, 58: 2015–2019. DOI: 10.1021/jf903802v |
| [22] | XU S Z, ZHONG W, GHAVIDELDARESTANI M, SAURABH R, LINDOW S W, ATKIN S L. Multiple mechanisms of soy isoflavones against oxidative stress-induced endothelium injury[J]. Free Radic Biol Med, 2009, 47: 167–175. DOI: 10.1016/j.freeradbiomed.2009.04.021 |
| [23] | ZHANG H T, WANG Y, DENG X L, DONG M Q, ZHAO L M, WANG Y W. Daidzein relaxes rat cerebral basilar artery via activation of large-conductance Ca2+-activated K+ channels in vascular smooth muscle cells[J]. Eur J Pharmacol, 2010, 630: 100–106. DOI: 10.1016/j.ejphar.2009.12.032 |
| [24] | NAKAYA Y, MAWATARI K, TAKAHASHI A, HARADA N, HATA A, YASUI S. The phytoestrogen ginsensoside Re activates potassium channels of vascular smooth muscle cells through PI3K/Akt and nitric oxide pathways[J]. J Med Invest, 2007, 54: 381–384. DOI: 10.2152/jmi.54.381 |
| [25] | PARK J S, JUNG J S, JEONG Y H, HYUN J W, LE T K, KIM D H, et al. Antioxidant mechanism of isoflavone metabolites in hydrogen peroxide-stimulated rat primary astrocytes:critical role of hemeoxygenase-1 and NQO1 expression[J]. J Neurochem, 2011, 119: 909–919. DOI: 10.1111/jnc.2011.119.issue-5 |
| [26] | XIANG Q, LIN G, XU J, ZHENG S, CHEN S, ZHOU K, et al. The role of caveolin 1 and sprouty 1 in genistein's regulation of vascular smooth muscle cell and endothelial cell proliferation[J]. Eur J Pharmacol, 2010, 648: 153–161. DOI: 10.1016/j.ejphar.2010.08.043 |
| [27] | TERZIC M M, DOTLIC J, MARICIC S, MIHAILOVIC T, TOSIC-RACE B. Influence of red clover-derived isoflavones on serum lipid profile in postmenopausal women[J]. J Obstet Gynaecol Res, 2009, 35: 1091–1095. DOI: 10.1111/jog.2009.35.issue-6 |
| [28] | MATORI H, UMAR S, NADADUR R D, SHARMA S, PARTOW-NAVID R, AFKHAMI M, et al. Genistein, a soy phytoestrogen, reverses severe pulmonary hypertension and prevents right heart failure in rats[J]. Hypertension, 2012, 60: 425–430. DOI: 10.1161/HYPERTENSIONAHA.112.191445 |
| [29] | KURIYAMA S, MORIO Y, TOBA M, NAGAOKA T, TAKAHASHI F, IWAKAMI S, et al. Genistein attenuates hypoxic pulmonary hypertension via enhanced nitric oxide signaling and erythropoietin system[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306: L996–L1005. DOI: 10.1152/ajplung.00276.2013 |
 2017, Vol. 38
2017, Vol. 38


