2. 上海市杨浦区市东医院泌尿外科, 上海 200438;
3. 第二军医大学长海医院病理科, 上海 200433;
4. Division of Urologic Surgery, Washington University School of Medicine, St Louis, MO63110, USA
2. Department of Urology, Shidong Hospital of Yangpu District, Shanghai 200438, China;
3. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
4. Division of Urologic Surgery, Washington University School of Medicine, St Louis, MO 63110, USA
随着人均寿命的延长、现代社会工作压力的增大和社会环境污染的增多,在良性前列腺增生(benign prostatic hyperplasia, BPH)高发人群中,迟发性性腺功能减退症(late-onset hypogonadism, LOH)的发病率也逐渐升高[1-2]。BPH是引起中老年男性排尿障碍最为常见的一种良性疾病,常用的治疗药物有α-肾上腺素受体阻断药、5α-还原酶抑制剂和植物制剂等[3-4];LOH是一种与年龄相关的临床和生化综合征,通常血清睾酮会下降,有典型的睾酮缺乏症状,如性欲减退、勃起功能障碍和肥胖等,因此它的治疗以睾酮替代疗法(testosterone replacement therapy,TRT)为主[5-6]。对于同时罹患这两种疾病的患者的治疗尚存疑虑,虽有相关文献报道TRT不会加剧BPH症状,但因病例数较少等原因无法形成高水平的证据,有待进一步研究[7-8]。为探讨同时罹患BPH和LOH的患者临床用药的疗效及安全性,建立相应的动物模型显然是一种简易、合理且有效的方法。本研究尝试采用腹腔注射环磷酰胺及丙酸睾酮的方法建立BPH合并LOH动物模型,现报告如下。
1 材料和方法 1.1 实验动物及分组雄性SD大鼠80只,6~7周龄,SPF级,体质量约(170±10) g,购自上海西普尔-必凯实验动物有限公司[动物生产许可证号:SCXK(沪)2013-0016]。动物饲养于第二军医大学实验动物中心,室温22~25 ℃,相对湿度45%~60%。以上实验动物通过随机数表法分为BPH合并LOH组、BPH组、LOH组和对照组,每组20只。
1.2 实验药物丙酸睾酮注射液(杭州动物药品厂,25 mg/支,批号:150529);环磷酰胺(南京奥多福尼生物科技有限公司,1 g/瓶,批号:20150309);苯甲酸雌二醇注射液(杭州动物药品厂,4 mg/支,批号:150321);橄榄油(上海靖淮生物技术有限公司,2 L/瓶,批号:20150707);生理盐水(安徽双鹤药业有限责任公司,100 mL/袋,批号:1507143S);戊巴比妥钠(上海润捷化学试剂有限公司,250 g/瓶,批号:20150530);大鼠游离睾酮ELISA检测试剂盒(上海晨易生物科技有限公司)。
1.3 动物给药及血清睾酮测定大鼠适应环境1周后开始造模,采用架式笼养。BPH合并LOH组大鼠给予环磷酰胺[20 mg/(kg·d)]腹腔内连续注射5 d,而后给予丙酸睾酮[50 mg/(kg·d)]腹腔内连续注射28 d;BPH组给予等体积生理盐水(代替环磷酰胺)注射5 d,而后给予丙酸睾酮[50 mg/(kg·d)]注射28 d;LOH组给予环磷酰胺[20 mg/(kg·d)]腹腔内连续注射5 d,而后给予等体积橄榄油(代替丙酸睾酮)注射28 d;对照组给予等体积生理盐水注射5 d,而后给予等体积橄榄油注射28 d。给药前及停药2 d后,分别以断尾取血法取血2次,每次约1.5 mL,离心后置于-80 ℃冰箱保存, 使用大鼠游离睾酮ELISA检测试剂盒测定大鼠血清睾酮含量。
1.4 行为学实验 1.4.1 悬尾实验将计步器固定在实验大鼠左后腿关节处,而后通过固定于大鼠尾根部的棉绳,将大鼠倒悬于空中,确保大鼠倒吊时前腿无法碰及地面。悬尾实验开始前清零计步器及秒表读数,于大鼠脱离地面时开始计时,于大鼠放回地面时结束计时,共5 min。结束实验后立即读数,以减少误差。
1.4.2 负重游泳实验保持水槽中的水温为30 ℃,将质量约为大鼠体质量50%的砝码固定于大鼠尾根部。然后将大鼠投入水槽中,于大鼠入水时开始计时,于砝码落在水槽底部发出撞击声时停止计时,记录总时间。停止计时后,迅速救出实验大鼠,卸下负重并擦干,减少大鼠意外死亡数。
1.4.3 交配实验实验前2 d开始给予去势雌性SD大鼠连续腹腔注射苯甲酸雌二醇(50 μg),诱导雌鼠进入发情期[9-10]。实验时间段为18:00—20:00[11],将雄性大鼠及雌性大鼠各1只放入笼内,并在上方放置摄像头(小蚁1080P智能摄像机二代),摄像头设置为夜间红外拍摄模式,并保持实验环境相对安静,减少外界因素对交配过程的影响。实验结束后及时分离两鼠,观看视频并记录雄性大鼠嗅闻雌鼠阴部及雄性大鼠骑跨雌鼠动作次数(嗅闻阴部、骑跨雌鼠均为大鼠的性行为[12])。
1.5 前列腺指数测定及病理学观察所有实验结束后,采取颈椎脱臼法处死大鼠,观察和解剖分离所有大鼠前列腺。取下新鲜标本用滤纸吸干表面体液及血液后,使用天平(德安特实验室电子天平,精确度0.01 g)称量并记录数值,计算前列腺指数:前列腺指数=前列腺质量(g)×1 000/大鼠体质量(g)。而后将前列腺标本浸泡于甲醛溶液固定,依次进行脱水、石蜡包埋、切片步骤,行H-E染色后,置于光学显微镜(蔡司Axio Imager 2) 下观察并拍照。
1.6 统计学处理应用SPSS 19.0软件进行统计学分析。将实验数据归类整理,计量资料所有数据首先进行正态分布检验,符合正态分布的数据以x±s表示,多组间的数据比较采用完全随机设计的单因素方差分析(one-way ANOVA)。方差齐时整体比较采用F检验,多重比较采用LSD法;方差不齐时采用Welch近似F检验,多重比较采用Dunnett’s T法。检验水准(α)为0.05。
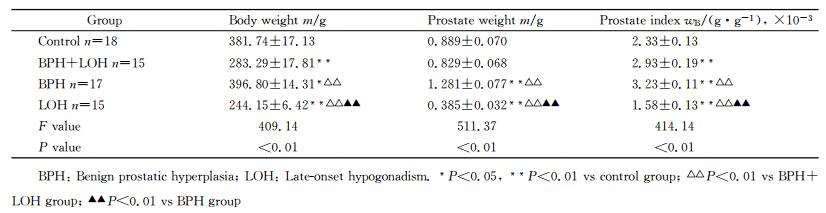
2 结果 2.1 各组大鼠体质量、前列腺质量及前列腺指数的比较实验过程中对照组大鼠死亡2只,BPH合并LOH组死亡5只,BPH组死亡3只,LOH组死亡5只,总体死亡率为18.75%(15/80)。由表 1可见,各组间大鼠体质量差异有统计学意义(P < 0.01),两两比较发现LOH组<BPH合并LOH组<对照组<BPH组(P < 0.05,P < 0.01);各组间大鼠前列腺质量差异有统计学意义(P < 0.01),两两比较发现LOH组<BPH合并LOH组或对照组<BPH组(P < 0.01),其中BPH合并LOH组与对照组差异无统计学意义(P=0.095);各组大鼠前列腺指数差异有统计学意义(P < 0.01),两两比较发现LOH组<对照组<BPH合并LOH组<BPH组(P < 0.01)。
|
|
表 1 各组大鼠体质量、前列腺质量和前列腺指数的比较 Tab 1 Comparison of body weight, prostate weight and prostate index of rats among four groups |
2.2 各组大鼠血清睾酮、运动能力和性行为的比较
由表 2可见,各组大鼠间血清睾酮含量差异有统计学意义(P < 0.01),两两比较发现LOH组<BPH合并LOH组<对照组<BPH组(P < 0.01)。各组大鼠间运动能力差异有统计学意义(P<0.01),两两比较发现,悬尾挣扎次数:LOH组<BPH合并LOH组<对照组<BPH组(P < 0.05,P < 0.01);负重游泳时间:LOH组<BPH合并LOH组<对照组或BPH组(P < 0.01),其中对照组与BPH组差异无统计学意义(P=0.05)。各组大鼠间性行为差异有统计学意义(P < 0.01),两两比较发现,大鼠嗅阴次数:LOH组<BPH合并LOH组<对照组<BPH组(P < 0.01),其中对照组与BPH组差异无统计学意义(P=0.05);骑跨次数:LOH组或BPH合并LOH组<对照组或BPH组(P < 0.01),其中BPH合并LOH组与LOH组(P=0.98)、对照组与BPH组(P=0.82) 差异均无统计学意义。
|
|
表 2 各组大鼠血清睾酮、运动能力和性行为的比较 Tab 2 Comparison of serum testosterone, exercise and sexual behavior of rats between four groups |
2.3 各组大鼠前列腺组织病理学改变的比较
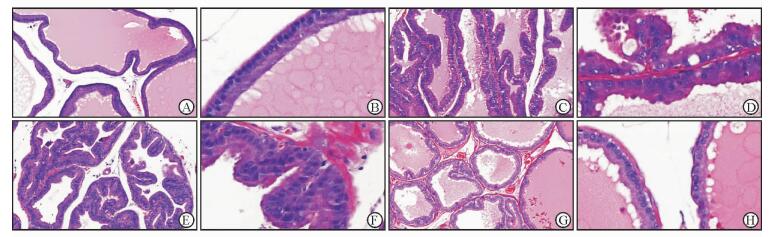
对照组大鼠前列腺腺上皮呈单层柱状上皮,细胞排列整齐,可见吸收空泡,腺体分布较规则,腺腔可见少量分泌物(图 1A、1B); BPH合并LOH组前列腺上皮呈假复层柱状上皮,细胞排列紧密,呈乳头状突向腔内,顶浆分泌明显,腺体分布较密集,腺腔分泌物增多,为前列腺增生表现(图 1C、1D); BPH组前列腺腺上皮呈明显假复层柱状上皮,部分区域细胞层次增加,呈较拥挤的乳头突向腔内,腺体分布明显密集,腺腔分泌物较多,为前列腺增生表现(图 1E、1F); LOH组前列腺腺上皮呈单层扁平上皮或单层柱状上皮,细胞胞质较空,吸收空泡明显,腺体分布规则,腺腔分泌物减少(图 1G、1H)。
|
图 1 各组大鼠前列腺组织病理学改变 Fig 1 Pathological changes of prostatic tissues of rats in different groups A, B: Control group; C, D: BPH+LOH group; E, F: BPH group; G, H: LOH group. BPH: Benign prostatic hyperplasia; LOH: Late-onset hypogonadism. Original magnification: ×100 (A, C, E, G), ×400 (B, D, F, H) |
3 讨论
BPH合并LOH动物模型的构建有助于临床对BPH合并LOH的了解,虽然已报道有单纯BPH大鼠模型和LOH大鼠模型[13-14],但目前尚未有BPH合并LOH动物模型成功建立的报道。BPH大鼠模型成功构建的标准为前列腺指数较正常大鼠升高以及前列腺病理提示增生[13];而LOH大鼠模型构建成功的标准则是血清游离睾酮低于正常大鼠,运动能力下降(如悬尾实验、游泳实验),以及性功能下降[14]。BPH合并LOH的大鼠模型应兼具上述两种模型的特点,即病理上提示前列腺增生,同时血清睾酮和性功能较正常大鼠明显下降。
目前LOH造模多通过建立衰老更年期模型获得,有5种造模方法符合需求,分别是D-半乳糖诱发型、自然衰老型、臭氧损伤型、辐射诱发型和生殖系统破坏型。D-半乳糖诱发型是目前最常用的衰老动物模型,其具有操作简单、结果稳定、价格较低的优点,缺点是造模周期较长[15]。自然衰老型能最真实地展现机体在衰老过程中发生的各种变化,但获取老年动物较困难,饲养周期长,同时老年动物的健康状况较差,死亡率较高[16]。臭氧损伤型和辐射诱发型造模时间短,可以快速获得需要的动物模型,但需要额外的器材,费用较高[17]。生殖系统破坏型采用腹腔注射环磷酰胺,周期短、药物获取方便、有生殖毒性,可成功复制出中老年男性雄激素部分缺乏综合征(PADAM)大鼠模型[18]。
目前报道的BPH造模方法有8种,分别是丙酸睾酮诱导模型、雌激素诱导模型、异种移植动物模型、转基因小鼠模型、自发性BPH模型、胎鼠尿生殖窦植入法、细胞培养法和甾体5α-还原酶抑制剂筛选模型。丙酸睾酮诱导模型和雌激素诱导模型是目前应用最普遍的模型,方法成熟且成功率高,可对鼠类、犬类或猴类进行造模,犬类和猴类价格太高,因成本高造成其推广有局限性,因而多使用大鼠或小鼠进行造模。一般可通过去势和非去势两种方式建立丙酸睾酮诱导模型。去势方法简单、操作方便,可以排除自身激素的影响,但去势后,腺体的增生趋势很难恢复到未去势水平,和临床有差别[19-21]。非去势方法的应用更为普遍,在发病机制和病理特征上也更接近临床,但其可应用范围较窄[22-23]。通过雌激素诱导建模虽然可以更好地反映前列腺增生体内的激素变化和老年患者的BPH状态,但给予激素的比例难以确定[24]。异种移植动物模型适用于短时间内研究移植组织中的某些因素,从免疫层面反应BPH的变化,但由于成本高、失败率较高等原因导致其应用受到限制[25]。成本较高的转基因小鼠模型同样推广受限,虽然其可用于研究细胞转化、变异中的某个致癌基因[26]。自发性BPH模型通过自然衰老过程,观察BPH的发展变化,这是公认的一种适合评价各类BPH药物的模型,是最理想的模型,但是由于周期较长,获取老龄犬困难,很难进行大规模的实验[22]。胎鼠尿生殖窦植入法操作复杂,虽然可以了解间质-上皮在发病过程中的相互作用机制,但对技术要求高[27]。细胞培养法是完全的体外研究,不需要饲养动物,成本较低、实验周期短,但细胞容易受到污染,对培养环境要求高,仅能反映相关细胞的变化[28]。甾体5α-还原酶抑制剂筛选模型主要用于大规模筛选甾体5α-还原酶抑制剂[29]。
参考以往文献的LOH和BPH造模方法,通过预实验,我们发现序贯应用环磷酰胺和丙酸睾酮并且通过给药剂量的探索,可成功构建LOH合并BPH模型。进一步扩大样本量,结果发现BPH合并LOH组大鼠的前列腺质量和前列腺指数虽然低于BPH组,但均高于对照组,且病理提示前列腺增生。同时,BPH合并LOH组大鼠的体质量、血清睾酮水平、悬尾实验和负重游泳实验的结果均小于正常对照组。在更为重要的性行为实验中,BPH合并LOH组大鼠的骑跨次数与LOH组差异无统计学意义,虽然嗅阴次数多于LOH组,但明显少于对照组。以上结果表明,虽然BPH合并LOH组大鼠的各项参数略高于LOH组大鼠,但具备LOH特征。这一模型可以很好地模拟BPH患者存在前列腺增生但同时具有低睾酮的临床特征。
实验中尚有待解决的是大鼠死亡率偏高的问题,尤其是对照组(死亡率10%,2/20) 以及BPH组(死亡率15%,3/20) 的死亡率高于以往的大鼠造模实验[6],在排除药物作用导致大鼠死亡的可能后,改变给药途径或给药剂量将是降低实验大鼠死亡率的方向,但仍需进一步验证。在大鼠运动能力实验中,还存在着计数、计时的人工误差,如何利用数字化的实验记录方法来消除这部分的误差也将是我们下一阶段实验的目标。而在大鼠的性功能实验中,虽然已经采取了数字化记录手段,但实验环境仍有不足,太过安静的实验室交配环境与大鼠自然交配的环境仍存在差异;而且性交实验时采用雌二醇诱导雌性大鼠,也与真实环境下的发情期雌性大鼠有所差异[7],可能会对实验结果产生影响,需要进一步改进。
| [1] | 李宏军, 谷翊群. 男性迟发性性腺功能减退症的发病机制与流行病学[J]. 国际生殖健康/计划生育杂志, 2011, 30: 10–13. |
| [2] | PYE S R, HUHTANIEMI I T, FINN J D, LEE D M, O'NEILL T W, TAJAR A, et al. Late-onset hypogonadism and mortality in aging men[J]. Clin Endocrinol Metab, 2014, 99: 1357–1366. DOI: 10.1210/jc.2013-2052 |
| [3] | 顾方六. 我国良性前列腺增生和前列腺癌发病调查[J]. 北京医科大学学报, 2000, 32: 30–33. DOI: 10.3321/j.issn:1671-167X.2000.01.009 |
| [4] | 高岑, 高志朝, 彭福生. 余杭区前列腺增生患病现状及相关治疗的调查[J]. 中国性科学, 2016, 25: 11–14. |
| [5] | CANGUVEN O, TALIB R A, EL ANSARI W, YASSIN D J, SALMAN M, AI-ANSARI A. Testosterone therapy has positive effects on anthropometric measures, metabolic syndrome components (obesity, lipid profile, diabetes mellitus control), blood indices, liver enzymes, and prostate health indicators in elderly hypogonadal men[J]. Andrologia, 2017. DOI: 10.1111/and.12768 |
| [6] | SHIGEHARA K, KONAKA H, KOH E, NAKASHIMA K, ⅡJIMA M, NOHARA T, et al. Effects of testosterone replacement therapy on hypogonadal men with osteopenia or osteoporosis:a subanalysis of a prospective randomized controlled study in Japan[J]. Aging Male, 2017, 28: 1–7. |
| [7] | SHIGEHARA K, NAMIKI M. Late-onset hypogonadism syndrome and lower urinary tract symptoms[J]. Korean J Urol, 2011, 52: 657–663. DOI: 10.4111/kju.2011.52.10.657 |
| [8] | JARVIS T R, CHUGHTAI B, KAPLAN S A. Testosterone and benign prostatic hyperplasia[J]. Asian J Androl, 2015, 17: 212–216. DOI: 10.4103/1008-682X.140966 |
| [9] | 杨嵘, 张立实, 王以美, 张丽, 黄丽娜, 张廷芬, 等. 雌二醇诱导雌性大鼠真性性早熟模型的建立[J]. 中国药理学与毒理学杂志, 2013, 27: 279–283. DOI: 10.3867/j.issn.1000-3002.2013.02.026 |
| [10] | JONES S L, ANTONIE R A, PFAUS J G. The inhibitory effects of corncob bedding on sexual behavior in the ovariectomized Long-Evansrat treated with estradiol benzoate are overcome by male cues[J]. Horm Behav, 2015, 72: 39–48. DOI: 10.1016/j.yhbeh.2015.05.002 |
| [11] | 李子轲, 韦娜, 卓衍蔷, 文雯, 刘强强, 李宏霞. 合笼时间对大鼠交配率的影响[J]. 现代预防医学, 2011, 38: 3736–3737. |
| [12] | CARRO-JUÁREZ M, RODRÍGUEZ-SANTIAGO M G, FRANCO M A, HUELETL-SOTO M E. Aphrodisiac activity of the aqueous crude extract of purple corn in male rats[J]. Evid Based Complementary Altern Med, 2017. DOI: 10.1177/2156587217708521 |
| [13] | JENA A K, VASISHT K, SHARMA N, KAUR R, DHINGRA M S, KARAN M. Amelioration of testosterone induced benign prostatic hyperplasia by Prunus species[J]. J Ethnopharmacol, 2016, 22: 33–45. |
| [14] | ZANG Z J, JI S Y, DONG W, ZHANG Y N, ZHANG E H, BIN Z. A herbal medicine, saikokaryukotsuboreito, improves serum testosterone levels and affects sexual behavior in old male mice[J]. Aging Male, 2015, 18: 106–111. DOI: 10.3109/13685538.2014.963042 |
| [15] | 姜国良, 于晓, 徐恺, 刘云. 腹腔和皮下注射D-半乳糖衰老大鼠模型分析[J]. 中国老年学杂志, 2013, 33: 1101–1103. DOI: 10.3969/j.issn.1005-9202.2013.05.051 |
| [16] | 吴克芬. 衰老大鼠模型的建立及增龄对大鼠肠黏膜上皮屏障的影响[D]. 上海: 复旦大学, 2013. http://d.wanfangdata.com.cn/Thesis/Y2866604 |
| [17] | 李树梅, 卢胜明, 康峰, 安立刚, 张海峰. 衰老动物模型的研究进展及应用[J]. 中国老年学杂志, 2011, 31: 3869–3872. DOI: 10.3969/j.issn.1005-9202.2011.19.105 |
| [18] | 何清湖. 环磷酰胺复制中老年男性雄激素部分缺乏综合征大鼠模型的研究[J]. 湖南中医药大学学报, 2011, 31: 15–29. DOI: 10.3969/j.issn.1674-070X.2011.01.004.015.03 |
| [19] | 张育军, 侯俊明, 雒向宁, 柏鲁宁, 方永军, 张健康. 益肾活血颗粒对前列腺增生大鼠survivin和caspase-3表达的影响[J]. 陕西中医, 2014, 35: 930–933. |
| [20] | 刘绍龑, 佐艇, 白明, 苗明三. 乌鸡白凤丸对小鼠前列腺增生模型的影响[J]. 中国实验方剂学杂志, 2012, 16: 180–184. DOI: 10.3969/j.issn.1005-9903.2012.02.053 |
| [21] | 黄冬妍, 吴建辉, 孙祖越. 前列腺增生药物评价模型分类及特点比较[J]. 中华男科学杂志, 2014, 20: 181–185. |
| [22] | 吴建辉, 徐斯翀, 潘琦, 苏欣, 闫晗, 李雷, 等. 自发性及睾酮诱导犬前列腺增生模型的比较[J]. 中国实验动物学报, 2013, 2: 21–26. DOI: 10.3969/j.issn.1005-4847.2013.02.005 |
| [23] | 彭修娟, 杨志杰, 刘半仙. 秦岭松花粉治疗小鼠前列腺增生实验研究[J]. 河南中医, 2014, 34: 1048–1049. |
| [24] | 楚元奎, 杨丽, 冉林武, 郎多勇, 李红兵. 枸杞蜂花粉提取物对SD大鼠前列腺增生的影响[J]. 宁夏医科大学学报, 2014, 36: 597–599. |
| [25] | 杨艳玲, 闵旸, 夏玉叶. 良性前列腺增生药理学研究中的动物模型[J]. 世界临床药物, 2011, 32: 51–55. |
| [26] | 汤佩佩, 苗明三. 防治前列腺增生症药物筛选方法的探讨[J]. 中医学报, 2012, 27: 594–599. |
| [27] | 申青, 朱着, 朱柳, 袁牧. 尿生殖窦植入致大鼠良性前列腺增生的组织形态学研究[J]. 中华男科学杂志, 2012, 18: 702–709. |
| [28] | 吴建辉, 李军, 苏欣. 原代培养大鼠前列腺细胞建立前列腺增生筛药模型[J]. 中国实验动物学报, 2013, 21: 10–14. DOI: 10.3969/j.issn.1005-4847.2013.04.003 |
| [29] | 吴建辉, 孙祖越. 酶标仪法甾体5α还原酶抑制剂体外筛选模型的建立[J]. 中华男科学杂志, 2013, 19: 483–486. |
 2017, Vol. 38
2017, Vol. 38