冻融胚胎移植(frozen-thawed embryo transfer,FET)是一项重要的辅助生殖技术,能提高累积妊娠率、降低多胎妊娠率、预防卵巢过度刺激综合征[1-2]。玻璃化冷冻技术的成熟保证了稳定的胚胎冷冻复苏率[3],使FET技术得到了更加广泛的运用。胚胎移植后能否成功妊娠主要取决于胚胎质量及子宫内膜容受性这2个关键因素[4]。因此,在FET周期中直接影响子宫内膜容受性的子宫内膜准备方案的选择尤为重要。目前,临床最常用的子宫内膜准备方案是单纯激素替代方案,通过添加外源性雌激素有效控制子宫内膜发育,适时添加黄体酮启动子宫内膜种植窗的开放,从而掌握胚胎移植的时机,但该方案无法保证完全垂体抑制作用,在用药期间仍可能出现优势卵泡发育,诱导早发促黄体生成素(luteinizing hormone,LH)峰,干扰局部内环境,从而影响胚胎着床[5-6]。而在激素替代方案中加用促性腺激素释放激素激动剂(gonadotrophin-releasing hormone agonist,GnRH-a)降调节可以避免早发的LH峰[6]。本中心在临床实践中考虑到单次大剂量GnRH-a可能存在过度抑制而影响子宫内膜对外来激素敏感性的问题,针对既往着床失败拟再次行FET的患者使用改良超长激素替代方案,采用2次低剂量GnRH-a降调节后再联合激素替代方案进行FET,临床观察可获得良好的妊娠结局。本研究针对改良超长激素替代方案与单纯激素替代方案对既往移植失败患者再次行FET周期助孕的临床结局进行回顾性分析,探讨改良超长激素替代方案对该类患者妊娠结局的影响。
1 资料和方法 1.1 研究对象收集2015年1月至2017年1月于第二军医大学长海医院生殖医学中心接受体外受精/卵胞质内单精子注射-胚胎移植(in vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI-ET)助孕,且前次胚胎种植失败拟行FET的患者共669例。纳入标准:(1) 既往IVF/ICSI-ET和(或)FET周期胚胎种植失败;(2) 既往宫腔镜检查无明显异常;(3) 本次FET周期采用单纯激素替代方案或改良超长激素替代方案。排除标准:此次FET周期放弃移植者、前次临床妊娠再次生育者、前次临床妊娠后未获得活产者。所有患者均签署知情同意书。本研究经长海医院医学伦理委员会审批通过。
1.2 研究方法根据本次FET周期子宫内膜准备方案将患者分为单纯激素组(485例,患者接受单纯激素替代方案准备子宫内膜)和改良超长激素组(184例,患者接受改良超长激素替代方案准备子宫内膜)。
单纯激素替代方案:从移植周期月经第3天开始口服戊酸雌二醇(商品名:补佳乐,1 mg/片,拜耳公司),起始剂量为2 mg、1次/d,5 d后增加至2 mg、2次/d,使用5 d,月经周期第13天B超检查子宫内膜,如果内膜厚度<7.5 mm,戊酸雌二醇口服量可增加至2 mg、3次/d,至B超检查提示子宫内膜厚度≥8 mm时开始肌注黄体酮注射液(20 mg/支,广州白云山明兴制药有限公司) 60 mg/d或黄体酮阴道缓释凝胶(商品名:雪诺同,90 mg/支,默克雪兰诺公司) 90 mg/d转化子宫内膜。在黄体酮转化的第4天移植第3天胚胎,第6天移植第5天囊胚,移植日起联合口服黄体酮软胶囊(商品名:琪宁,100 mg/片,浙江爱生药业有限公司)100 mg、2次/d进行黄体支持。移植后2周,若确定妊娠继续使用,至B超见胎心后逐渐减量至停药。
改良超长激素替代方案:于月经周期第2~3天应用注射用醋酸曲普瑞林(商品名:达菲林,3.75 mg/支,法国益普生生物技术公司)1.5 mg,4周后注射第2针醋酸曲普瑞林1.5 mg,第2次用药后14~21 d检测血清雌二醇(estradiol,E2)≤50 pg/mL、LH≤5 U/L、卵泡刺激素(follicle-stimulating hormone,FSH)≤5 U/L以及子宫内膜厚度≤5 mm,则开始雌激素替代补充,具体方法同上。
1.3 胚胎冷冻方法取卵周期移植或放弃移植后的可用胚胎均采用两步平衡法的玻璃化冷冻技术进行冷冻。具体步骤如下:胚胎置于基础液中冲洗后,置于平衡液中平衡5~7 min(囊胚1.5~2 min),以进入平衡液中的胚胎皱缩后渐恢复至原体积和形态为准;最后置于玻璃化液中45~60 s,迅速将胚胎放置在冷冻载体上,直接投入液氮,并在编号后置于液氮罐中保存。
1.4 胚胎复苏方法拟复苏当天采用快速复温的方式复苏玻璃化冷冻的胚胎,复苏后重新评价胚胎。复苏流程:液氮罐中取出冷冻后的胚胎,迅速投入37 ℃解冻液中,37 ℃下平衡1 min;然后依次置于室温稀释液1中3 min、室温稀释液2中2.5 min、室温洗涤液中2.5 min;入37 ℃、5%CO2平衡过夜的培养液于培养箱中等待移植。
1.5 优质胚胎评价标准按照ASEBIR胚胎评价标准及Istanbul共识[7],根据胚胎发育的速度和形态评价胚胎。优质胚胎定义为:取卵后第3天胚胎即卵裂期胚胎,达到7~9细胞1级、2级为优质卵裂期胚胎;取卵后第5天胚胎即囊胚,达到3期以上级别,且内细胞团为A级或B级、滋养层细胞为A级或B级为优质囊胚。
1.6 胚胎移植方法若移植当天子宫内膜厚度≥7 mm且患者一般情况良好要求移植,选择1~2枚可用复苏后胚胎进行移植;若复苏后胚胎裂解,继续复苏其他冷冻胚胎直至可以移植或无剩余冷冻胚胎。移植过程在腹部B超引导下进行,常规移植1~2枚复苏后胚胎。
1.7 妊娠结局判定移植后14 d检测血清人绒毛膜促性腺激素(human chorionic gonadotropin,hCG),阳性者在移植后30~35 d行腹部B超检查,若B超显示宫内妊娠,见胎心,定义为临床妊娠。
1.8 观察指标一般情况:年龄、体质量指数(BMI)、不孕年限、既往胚胎移植次数。内膜反应情况:激素替代时间和转化日子宫内膜厚度、LH、E2、孕酮水平。移植情况:移植日(ET)子宫内膜厚度、移植胚胎数、囊胚移植率、优质胚胎率。妊娠结局:异位妊娠率(%)=异位妊娠周期数/移植周期数×100%,临床妊娠率(%)=临床妊娠周期数/移植周期数×100%,流产率(%)=流产周期数/临床妊娠周期数×100%。
1.9 统计学处理采用SPSS 18.0软件进行数据分析。计数资料以百分数表示,组间比较采用χ2检验或Fisher确切概率法;定量资料以x±s表示,组间比较采用t检验。检验水准(α)为0.05。
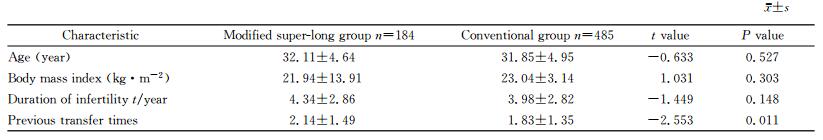
2 结果 2.1 两组患者一般情况比较由表 1可见,两组患者的年龄、BMI、不孕年限差异均无统计学意义(P>0.05);改良超长激素组既往胚胎移植次数多于单纯激素组,差异有统计学意义(P<0.05)。
|
|
表 1 两组患者的一般情况 Tab 1 General characteristics of patients in each group |
2.2 两组内膜准备结果比较
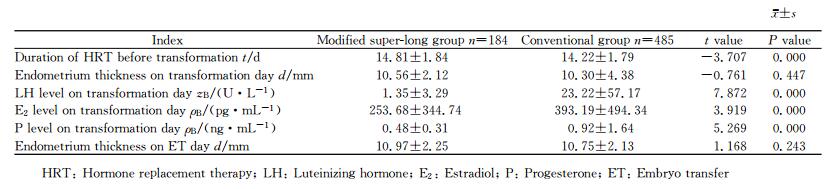
与单纯激素组相比,改良超长激素组患者在转化前雌激素替代治疗(hormone replacement therapy,HRT)的时间长、转化日LH、E2、孕酮的水平低,差异均有统计学意义(P<0.01);两组患者转化日和ET日的子宫内膜厚度差异均无统计学意义(P>0.05)。见表 2。
|
|
表 2 两组患者内膜准备结果比较 Tab 2 Comparison of endometrial preparation outcomes between two groups |
2.3 两组移植胚胎情况比较
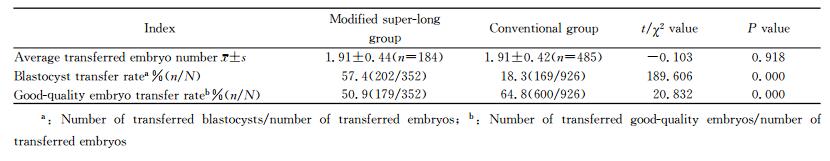
改良超长激素组中囊胚移植率高于单纯激素组(P<0.01),但优质胚胎率则低于单纯激素组(P<0.01)。两组移植胚胎数差异无统计学意义(P>0.05)。见表 3。
|
|
表 3 两组移植情况比较 Tab 3 Comparison of transferred embryos between two groups |
2.4 两组妊娠结局比较
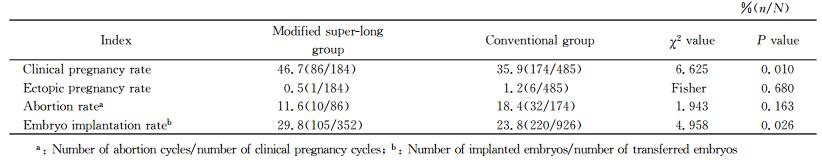
改良超长激素组的临床妊娠率和胚胎着床率均高于单纯激素组,差异有统计学意义(P<0.05)。两组异位妊娠率和早期流产率差异均无统计学意义(P>0.05)。见表 4。
|
|
表 4 两组患者妊娠结局对比 Tab 4 Comparison of pregnancy outcomes between two groups |
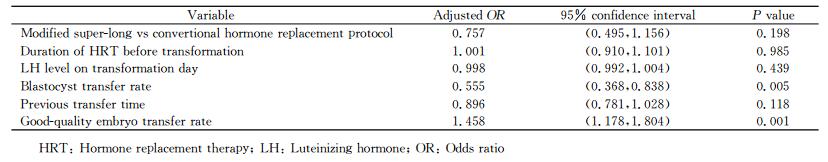
2.5 临床妊娠的logistic多因素回归分析
为了平衡表 1~4所示的这些因素,进行了临床妊娠的logistic多因素回归分析,结果(表 5)提示囊胚移植率和优质胚胎率是临床妊娠率的独立影响因素(P<0.01),子宫内膜准备方案并不是临床妊娠率的独立影响因素。
|
|
表 5 影响临床妊娠的logistic多因素回归分析 Tab 5 Logistic multivariate regression analysis of factors associated with clinical pregnancy rate |
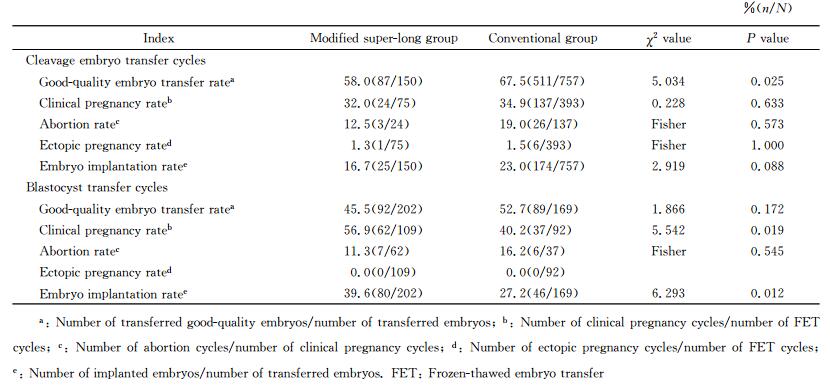
2.6 按照移植胚胎胎龄进行亚组分析
为进一步分析2种内膜准备方案对妊娠结局的影响,我们按照移植胚胎胎龄进行亚组分析,结果见表 6。在卵裂期胚胎移植周期中,单纯激素组优质胚胎率高于改良超长激素组(P<0.05),但两组的胚胎着床率、临床妊娠率、异位妊娠率和早期流产率差异均无统计学意义(P>0.05);在囊胚移植周期中,两组的优质胚胎率和早期流产率差异均无统计学意义(P>0.05),但改良超长激素组的临床妊娠率和胚胎着床率高于单纯激素组(P<0.05)。
|
|
表 6 卵裂期胚胎移植及囊胚移植亚组妊娠结局比较 Tab 6 Comparison of pregnancy outcomes between cleavage embryo and blastocyst transfer cycles subgroups |
3 讨论
胚胎成功着床需要具有发育潜能的胚胎及良好容受性的子宫内膜。FET助孕周期中,成熟的玻璃化冷冻技术保证了稳定的胚胎复苏率,子宫内膜容受性成为影响临床妊娠成功与否的关键因素,因此,选择合适的子宫内膜准备方案在FET助孕周期中极为重要。
目前FET周期常用的子宫内膜准备方案有自然周期、促排卵周期、激素替代周期以及超长方案联合激素替代周期。初次移植冻胚时,临床常根据病因、病情做出个体化选择,但目前仍有部分患者未能通过冻胚移植成功妊娠。分析移植失败的原因,除考虑胚胎因素外,如何提高子宫内膜容受性和优化内膜准备方案仍需进一步探讨。
本中心根据既往研究和临床经验,对传统的GnRH-a降调节方法进行改良,于月经周期第2~3天给予长效GnRH-a(戊酸雌二醇) 1.5 mg,28 d后再次给予长效GnRH-a 1.5 mg,2~3周达到充分降调节后给予雌激素并适时给予孕激素转化内膜。目前,国内外尚无改良超长激素替代方案在FET助孕周期中的对比研究。因其内膜准备耗时较长,本中心目前临床上主要应用于既往多次移植失败不孕患者的FET周期。因此本研究针对性选择既往移植失败再次行FET助孕的患者进行回顾性分析,探讨改良超长激素替代方案对妊娠结局的影响。
本研究结果显示改良超长激素组患者在达到黄体酮转化日标准之前所需的HRT时间长于单纯激素组[(14.81±1.84) d vs (14.22±1.79) d,P<0.01],但实际天数差别不大,提示本改良超长方案中GnRH-a降调节的剂量可有效抑制下丘脑-垂体-卵巢轴,但不会导致过度抑制而影响子宫内膜对外源性雌激素的反应性。此外,改良超长激素组在黄体酮转化日的LH、E2和孕酮的水平均低于单纯激素组,结果也支持GnRH-a降调节激素替代周期可有效避免早发LH峰的结论,由此推测改良超长激素方案中GnRH-a通过有效抑制下丘脑-垂体-卵巢轴,避免其受到高水平雌激素正反馈作用诱导早发LH峰的干扰,从而创造有利于胚胎着床的内环境。
本研究中,在优质胚胎率更低的情况下,改良超长激素组的临床妊娠率和胚胎着床率仍高于单纯激素组,表明其在既往移植失败再行FET助孕患者中的显著优势。但同时研究中改良超长激素组的囊胚移植率较单纯激素组更高(57.4% vs 18.3%,P<0.01)。由于囊胚培养本身具有优选胚胎的作用,囊胚移植后的着床率和妊娠率高于卵裂期胚胎这一优势可能会干扰2种子宫内膜准备方案的临床结局,因此,本研究以是否临床妊娠为结局,通过logistic多因素回归分析了其可能存在的影响因素,发现优质胚胎率和囊胚移植率是临床妊娠结局的影响因素。进一步根据移植胚胎胎龄进行了亚组分析,比较第3天与第5天胚胎移植中2种子宫内膜准备方案的妊娠结局,结果显示卵裂期胚胎移植周期中,单纯激素组优质胚胎率高于改良超长激素组(P<0.05),但两组间胚胎着床率及临床妊娠率差异无统计学意义;囊胚移植周期中,两组优质胚胎率差异无统计学意义,改良超长激素组的胚胎着床率和临床妊娠率高于单纯激素组,差异有统计学意义(P<0.05)。提示改良超长激素替代方案可能通过改善子宫内膜容受性这一途径增加胚胎着床的概率,从而提高临床妊娠率。
改良超长激素替代方案改善子宫内膜容受性的机制与GnRH-a降调节有效抑制内源性LH峰有关,还可通过GnRH-a结合于子宫内膜上的GnRH受体,增加子宫内膜细胞黏附分子的表达,提高子宫内膜容受性,抑制胚胎毒性自身抗体的产生,提高胚胎移植率[8-9]。但改良超长激素替代方案是否可通过免疫调节机制进一步增加子宫内膜容受性,尚有待研究。
综上所述,改良超长激素替代方案可提高冻胚移植周期的临床妊娠率,是反复种植失败患者再次行FET的有效助孕策略。
| [1] | VEECK L L. Does the developmental stage at freeze impact on clinical results post-thaw?[J]. Reprod Biomed Online, 2003, 6: 367–374. DOI: 10.1016/S1472-6483(10)61859-7 |
| [2] | ANDERSON A R, WILKINSON S S, PRICE S, CRAIN J L. Reduction of high order multiples in frozen embryo transfers[J]. Reprod Biomed Online, 2005, 10: 402–405. DOI: 10.1016/S1472-6483(10)61803-2 |
| [3] | DESAI N, BLACKMON H, SZEPTYCKI J, GOLDFARB J. Cryoloop vitrification of human day 3 cleavage-stage embryos:post-vitrification development, pregnancy outcomes and live births[J]. Reprod Biomed Online, 2007, 14: 208–213. DOI: 10.1016/S1472-6483(10)60789-4 |
| [4] | ACHACHE H, REVEL A. Endometrial receptivity markers, the journey to successful embryo implantation[J]. Hum Reprod Update, 2006, 12: 731–746. DOI: 10.1093/humupd/dml004 |
| [5] | GROENEWOUD E R, CANTINEAU A E P, KOLLEN B J, MACKLON N S, COHLEN B J. What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles? A systematic review and meta-analysis[J]. Hum Reprod Update, 2013, 19: 458–470. DOI: 10.1093/humupd/dmt030 |
| [6] | 方颖, 洪黎明, 杨晓葵. 降调节联合激素替代周期方案在多次胚胎种植失败患者冻融胚胎移植周期中的应用[J]. 首都医科大学学报, 2015, 36: 544–547. |
| [7] | Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology; BALABAN B, BRISON D, CALDERÓN G, CATT J, CONAGHAN J, COWAN L, et al. The Istanbul consensus workshop on embryo assessment:proceedings of an expert meeting[J]. Hum Reprod, 2011, 26: 1270–1283. DOI: 10.1093/humrep/der037 |
| [8] | KHAN K N, KITAJIMA M, HIRAKI K, FUJISHITA A, NAKASHIMA M, ISHIMARU T, et al. Cell proliferation effect of GnRH agonist on pathological lesions of women with endometriosis, adenomyosis and uterine myoma[J]. Hum Reprod, 2010, 25: 2878–2890. DOI: 10.1093/humrep/deq240 |
| [9] | 吴艳霞, 杨红玉, 常春. 子宫内膜异位症不孕患者腹腔镜术后应用GnRHa对妊娠的影响[J]. 临床误诊误治, 2013, 26: 68–70. DOI: 10.3969/j.issn.1002-3429.2013.10.029 |
 2017, Vol. 38
2017, Vol. 38