2. 上海市计划生育科学研究所, 国家人口和计划生育委员会计划生育药具重点实验室, 上海 200032;
3. 中国科学院遗传与发育生物学研究所, 北京 100101
2. Shanghai Institute of Planned Parenthood Research, Key Laboratory of Contraceptive Drugs and Devices of National Population and Family Planning Commission of China, Shanghai 200032, China;
3. Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China
在正常健康人群中存在着各种染色体的恒定的微小变异,包括结构、带纹宽窄和着色强度等,其中1、9、16、Y等染色体长臂区和D与G组染色体短臂区的结构异染色质区域较常发生。这类微小而恒定的变异按孟德尔方式遗传,通常无明显的表型效应或病理学意义,称为染色体多态性[1]。
染色体多态性会导致一定的临床效应,如不孕不育和自然流产[2]。研究发现,接受体外受精/卵胞质内单精子显微注射-胚胎移植(in vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI-ET)助孕的不孕不育人群染色体多态性的检出率高于染色体正常的生育人群[3-4]。但也有报道认为染色体多态性不孕不育人群与染色体正常人群接受IVF/ICSI-ET助孕后临床结局的差异并无统计学意义[5-6]。可见染色体多态性与表型效应之间的关系并不清楚。且很少有研究提及高染色体多态性检出率会影响IVF/ICSI-ET助孕的临床结局。因此,本研究回顾分析第二军医大学长海医院生殖医学中心既往接受IVF/ICSI-ET助孕的不孕不育夫妻及活产情况,以阐明染色体多态性是否影响IVF/ICSI-ET治疗的临床结局。
1 资料和方法 1.1 研究资料纳入2015年3月—2016年6月于第二军医大学长海医院生殖医学中心接受IVF/ICSI-ET助孕的不孕不育夫妻1 108对,根据夫妻一方或双方是否存在染色体多态性分为染色体正常组(夫妻双方染色体均正常)和染色体多态性组(夫妻一方或双方存在染色体多态性变异)。纳入标准:女方年龄≤38岁,初次促排卵进行IVF/ICSI-ET助孕的不孕不育夫妻,并且只统计第1个新鲜周期。排除标准:女方年龄>38岁,女方基础卵泡刺激素≥10 IU/L,多囊卵巢综合征及卵巢功能不全者,女方具有子宫畸形及不良妊娠史,染色体核型异常者未纳入本研究。本研究经第二军医大学长海医院伦理委员会批准,所有参与者均签署知情同意书。
1.2 染色体核型分析所有患者均在促排卵周期启动前,在医学遗传学实验室进行染色体核型分析。应用常规方法对其外周血淋巴细胞进行72 h短期培养,每毫升培养液中加入秋水仙素0.8 μg,继续在37 ℃培养箱中培养4~6 h。之后将细胞液移入10 mL的离心管中,360×g离心10 min,弃去上清液,加入37 ℃预热的低渗液氯化钾溶液(0.075 mol/L)处理。固定剂使用甲醇和冰醋酸(体积比为3:1)。对收集的细胞进行G显带处理,显带分辨率为400~550条带,按照人类细胞学国际命名体制进行染色体核型分析。每例病例至少进行20个有丝分裂相的分析,并至少每例有5个核型通过光学显微镜验证确认。
染色体多态性的诊断标准[1]为:(1) Y染色体的长度变异,主要变异部位是Y染色体长臂结构异染色质区,即长臂远端约2/3区段的长度变异。如果Y染色体大于F组或大于第18号染色体,称为“长Y”“大Y”或“巨Y”,描述为Yqh+;若Y染色体的长度为G组染色体长度的1/2以下,称为“小Y”染色体,描述为Yq-,Y染色体变异的患者均进行Y染色体微缺失检测,将有Y染色微缺失的患者排除在研究外。(2) D组、G组近端着丝粒染色体的短臂、随体及随体柄部的次缢痕区(nucleolar organizing region,NOR)的变异,表现为随体的增加(ps+)、减少(ps-)及随体柄增长(pstk+)等;着丝粒的增长或缩短(cen+,cen-)。(3) 第1、9和16号染色体次缢痕的变异,表现为次缢痕的有无或长短的变异(1qh+/-、9qh+/-、16qh+/-)。此外,在1、9、16号和Y染色体的着丝粒染色质区出现的倒位也属于染色体多态性。
1.3 助孕方案及黄体支持方案依据患者年龄、卵巢储备功能情况选择标准长方案或短方案促排卵,当卵泡接近成熟时皮下注射重组人绒毛膜促性腺激素(human chorionic gonadotropin,hCG;商品名:艾泽,默克雪兰诺有限公司,250 μg/支),34~36 h后在阴道B超引导下穿刺取卵,MⅡ卵母细胞经常规IVF/ICSI授精,16~18 h后观察受精情况;取卵后2~3 d观察卵裂及胚胎发育情况。取卵后72 h在B超引导下行胚胎移植,取卵日起常规进行黄体支持[7]。未获卵或无胚胎移植者未纳入。
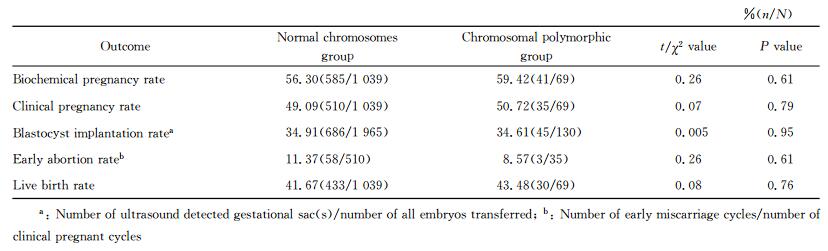
1.4 临床结局观察胚胎移植后12~14 d通过尿妊娠试验检查或抽血查hCG(外周血β-hCG>5 IU/L)确定生化妊娠。移植35 d后行腹部B超检查见孕囊者为临床妊娠,记录孕囊数目、胚芽及胎心搏动情况并随访追踪妊娠结局。看到妊娠囊后、孕12周前的流产或胚胎停育属于早期流产。出生婴儿记录生产方式、畸形情况、出生体质量、是否足月、性别等。同时比较两组的平均MⅡ卵子数、受精率(受精卵数目/MⅡ卵子数×100%)、正常(2PN)受精率(2PN受精卵数目/MⅡ卵子数×100%)、卵裂率(卵裂胚胎数/受精卵数目×100%)、优质胚胎率(优质胚胎数/卵裂胚胎数×100%)、生化妊娠率(生化妊娠数/移植周期数×100%)、临床妊娠率(临床妊娠数/移植周期数×100%)、胚胎种植率(妊娠囊数/移植胚胎数×100%)、早期流产率(早期流产数/临床妊娠数×100%)和活产率(有活产婴儿出生的分娩周期数/移植周期数×100%)。
1.5 统计学处理采用SPSS 16.0软件进行数据处理,计量资料以x±s表示,组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验。检验水准(α)为0.05。
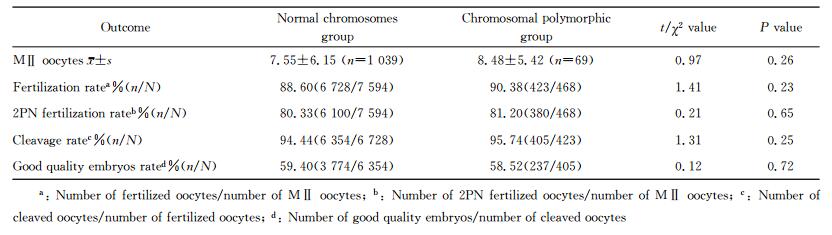
2 结果 2.1 两组患者一般资料的比较本研究共纳入接受IVF/ICSI-ET助孕的不孕不育夫妻1 108对,其中染色体多态性组69对,染色体正常组1 039对。两组女方的平均年龄、男方的平均年龄、女方的体质量指数(body mass index,BMI)、不孕类型、促排卵方案、受精方案的差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 两组患者的一般资料 Tab 1 General characteristics of infertile couples in two groups |
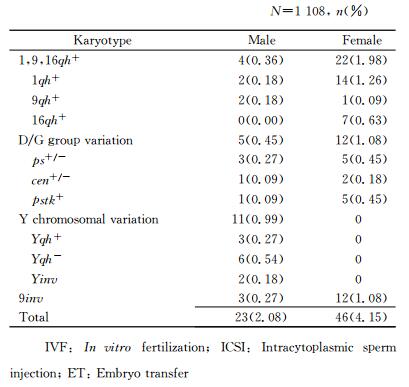
2.2 染色体多态性类型及检出率
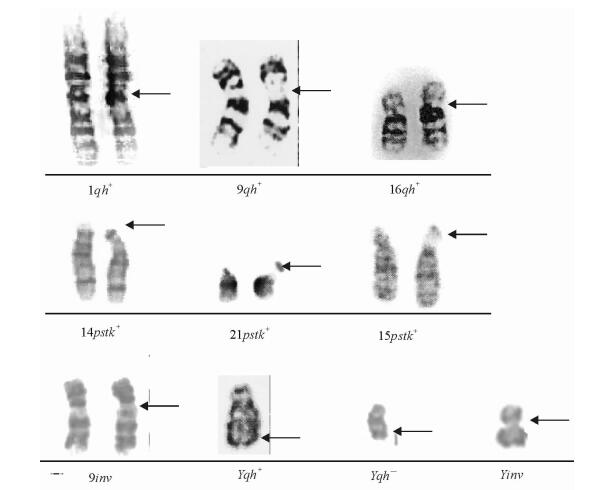
染色体多态性类型及检出率结果见表 2。染色体多态性总检出率为6.22%(69/1 108)。以常染色体次溢痕增加为代表的1qh+、9qh+和16qh+的检出率为2.35%(26/1 108);D/G组染色体多态性变异检出率为1.53%(17/1 108)。臂间倒位染色体多态性的检出率为1.53%(17/1 108),主要为9号染色体臂间倒位[检出率为1.35%(15/1 108)];男性Y染色体多态性的检出率0.99%(11/1 108),主要表现为Yqh+/-、Yinv。主要的染色体多态性核型见图 1。
|
|
表 2 经IVF/ICSI-ET治疗患者的染色体多态性类型及检出率 Tab 2 Frequency of chromosomal polymorphisms in infertile couples receiving IVF/ICSI-ET treatment |
|
图 1 典型的染色体多态核型图(箭头示) Fig 1 Typical examples of some type of chromosomal polymorphisms (arrows) |
2.3 两组患者的实验室结局和临床结局
两组患者的M Ⅱ卵子获得数、受精率、2PN受精率、卵裂率和优质胚胎率差异均无统计学意义(P>0.05,表 3)。两组患者的临床结局见表 4,两组患者的生化妊娠率、临床妊娠率、种植率、早期流产率、活产率的差异均无统计学意义(P>0.05)。
|
|
表 3 两组患者实验室结局的比较 Tab 3 Comparison of lab outcomes between two groups |
|
|
表 4 两组患者临床结局的比较 Tab 4 Comparison of clinical outcomes between two groups |
3 讨论
自将染色体检查归为辅助生殖常规术前检查以来,每对夫妻均需要检查外周血染色体核型。如果检查发现存在染色体多态性,大部分夫妻极度焦虑和困惑,如染色体多态性会不会影响助孕成功率?会不会导致流产?会不会对于后代有影响?关于染色体多态性与患者经过IVF/ICSI-ET助孕后的妊娠结局的关系,目前相关报道较少,而且研究结果存在差异[5-6, 8]。染色体多态性在正常生育人群中的检出率为2.6%[1],而本研究中1 108对接受IVF/ICSI-ET助孕的夫妻中总的染色体多态性检出率为6.22%(69/1 108),明显高于文献的2.6%。也有研究报道不孕不育患者染色体多态性的检出概率较高[9]。
本研究中男性Y染色体多态性的发生率最高(0.99%,11/1 108),且以Yqh+/-为主。关于Y染色体多态性,Minocherhomji等[9]研究发现Y染色体结构异染色质区域的重复序列变长或变短都会因位置效应斑的因素影响精子生成基因的表达,从而影响男性的生育。但也有研究提出了相反的论据,例如,Klantari等[10]研究了发生Y染色体多态性的男性精液参数,发现其与正常核型男性差异无统计学意义。而本次研究中11例Y染色体多态性的不孕不育夫妻中,5例临床妊娠并得到了健康活胎。在较常见的9号染色体倒位方面争论也比较多,有研究报道不孕症的患者9号染色体倒位的发生率高于正常人群[11-12];也有研究发现9号染色体臂间倒位与不孕症及流产率之间不存在相关性[13]。本研究中9号染色体臂间倒位检出率为1.35%(15/1 108),这15例不孕不育夫妻中6例临床妊娠,而只有1例发生早期流产。但因为例数少,差异不具有统计学意义,所以需要进一步大样本研究明确。
本研究结果显示两组之间的一般资料、实验室结局和临床结局之间差异均无统计学意义,且染色体多态性组的受精率、生化妊娠率、活产率等稍高于对照组,早期流产率略低于对照组。传统观点认为,染色体多态性属于正常变异,结构异染色质区域所含DNA主要是转录活性较低的非编码的高度重复序列,涉及基因较少,不会引起明显的表型效应或不良后果。随着分子生物学技术的进展,有研究者开始认为染色体多态性可能与生殖异常相关。例如,有研究指出染色体多态性可能会通过增加男性精子和受精后胚胎的非整倍体影响生殖结局[14]。既往研究也认为,多态核型影响IVF/ICSI-ET的临床结局。例如,Yakin等[15]研究发现具有多态性核型的男性患者的临床妊娠率和胚胎着床率均低于核型正常组男性。但是,此研究包括的病例均为重度少弱精子症和非梗阻性无精子症患者,不能完全代表所有IVF/ICSI-ET治疗的不孕不育人群。与之类似,Liang等[6]研究发现染色体多态性可能会影响IVF的受精率,建议多态性患者使用ICSI提高受精率,但同时指出染色体正常夫妻和染色体多态性夫妻的临床妊娠率、早期流产率差异均无统计学意义,与本研究的结果相似。另外,Hong等[5]研究结果表明,男性染色体多态性除可能会增加早期流产率之外,不影响IVF/ICSI-ET助孕的临床结局。本研究中男方存在染色体多态性的夫妻只有1例发生早期流产,并且两组间早期流产率的差异并无统计学意义。根据我们的临床研究结果,可认为所观察的染色体多态性对于实验室和临床胚胎发育和生殖结局没有明显影响。然而,要得出肯定的结论,一方面需要增大染色体多态性夫妻的样本量,以减少统计学误差;另一方面,由于采用的外周血核型分析只能分辨450~550个条带,不能区分一些微小的重复或缺失,因而需要应用更精确的染色体显带技术研究,以更灵敏地区分可能的微重复或倒位,明确染色体多态性是否影响生殖结局。
综上所述,本研究应用目前的染色体多态性分析方法,得出接受IVF/ICSI-ET助孕的不孕不育夫妻的染色体多态性总检出率(6.22%,69/1 108) 高于正常人群(2.6%[1]),但研究中染色体正常夫妻和染色体多态性夫妻的临床妊娠率、早期流产率和活产率均无明显差异。
| [1] | MADON P F, ATHALYE A S, PARIKH F R. Polymorphic variants on chromosomes probably play a significant role in infertility[J]. Reprod Biomed Online, 2005, 11: 726–732. DOI: 10.1016/S1472-6483(10)61691-4 |
| [2] | CHENG R, MA Y, NIE Y, QIAO X, YANG Z, ZENG R, et al. Chromosomal polymorphisms are associated with female infertility and adverse reproductive outcomes after infertility treatment:a 7-year retrospective study[J]. Reprod Biomed Online, 2017, 35: 72–80. DOI: 10.1016/j.rbmo.2017.03.022 |
| [3] | AHMET OKAY C, ISILAY O, FATMA D, MUNIS D. Cytogenetic results of patients with infertility in middle anatolia, Turkey:do heterochromatin polymorphisms affect fertility?[J]. J Reprod Infertil, 2010, 11: 179–181. |
| [4] | MIERLA D, STOIAN V. Chromosomal polymorphisms involved in reproductive failure in the romanian population[J]. Balkan J Med Genet, 2012, 15: 23–28. |
| [5] | HONG Y, ZHOU Y W, TAO J, WANG S X, ZHAO X M. Do polymorphic variants of chromosomes affect the outcome of in vitro fertilization and embryo transfer treatment?[J]. Hum Reprod, 2011, 26: 933–940. DOI: 10.1093/humrep/deq333 |
| [6] | LIANG J, ZHANG Y, YU Y, SUN W, JING J, LIU R. Effect of chromosomal polymorphisms of different genders on fertilization rate of fresh IVF-ICSI embryo transfer cycles[J]. Reprod Biomed Online, 2014, 29: 436–444. DOI: 10.1016/j.rbmo.2014.06.011 |
| [7] | 张慧琴. 生殖医学理论与实践[M]. 2版. 上海: 上海世界图书出版公司, 2014: 167-178. |
| [8] | XU X, ZHANG R, WANG W, LIU H, LIU L, MAO B, et al. The effect of chromosomal polymorphisms on the outcomes of fresh IVF/ICSI-ET cycles in a Chinese population[J]. J Assist Reprod Genet, 2016, 33: 1481–1486. DOI: 10.1007/s10815-016-0793-2 |
| [9] | MINOCHERHOMJI S, ATHALYE A S, MADON P F, KULKARNI D, UTTAMCHANDANI S A, PARIKH F R. A case-control study identifying chromosomal polymorphic variations as forms of epigenetic alterations associated with the infertility phenotype[J]. Fertil Steril, 2009, 92: 88–95. DOI: 10.1016/j.fertnstert.2008.05.071 |
| [10] | KALANTARI P, SEPEHRI H, BEHJATI F, ASHTIANI Z O, AKBARI M T. Chromosomal studies in infertile men[J]. Tsitol Genet, 2001, 35: 50–54. |
| [11] | MOZDARANI H, MEYBODI A M, KARIMI H. Impact of pericentric inversion of Chromosome 9[inv (9) (p11q12)] on infertility[J]. Indian J Hum Genet, 2007, 13: 26–29. DOI: 10.4103/0971-6866.32031 |
| [12] | UEHARA S, AKAI Y, TAKEYAMA Y, TAKABAYASHI T, OKAMURA K, YAJIMA A. Pericentric inversion of chromosome 9 in prenatal diagnosis and infertility[J]. Tohoku J Exp Med, 1992, 166: 417–427. DOI: 10.1620/tjem.166.417 |
| [13] | DANA M, STOIAN V. Association of pericentric inversion of chromosome 9 and infertility in romanian population[J]. Maedica (Buchar), 2012, 7: 25–29. |
| [14] | MORALES R, LLEDÓ B, ORTIZ J A, TEN J, LLÁCER J, BERNABEU R. Chromosomal polymorphic variants increase aneuploidies in male gametes and embryos[J]. Syst Biol Reprod Med, 2016, 62: 317–324. DOI: 10.1080/19396368.2016.1212949 |
| [15] | YAKIN K, BALABAN B, URMAN B. Is there a possible correlation between chromosomal variants and spermatogenesis?[J]. Int J Urol, 2005, 12: 984–989. DOI: 10.1111/iju.2005.12.issue-11 |
 2017, Vol. 38
2017, Vol. 38