完全性房室传导阻滞是各种心脏病的重要并发症,对人类健康危害极大,植入电子起搏器仍然是其目前主要的治疗手段。电子起搏器在提升患者生活质量和预防心源性猝死方面发挥了不可替代的作用,但其毕竟是机械结构,存在电极感染、易受电磁波干扰、不受神经体液调节、电池寿命限制及不能随机体发育等诸多问题[1]。随着生物医学工程技术的迅速发展,近年来生物心脏起搏成为心律失常治疗研究的热点。所谓生物心脏起搏是指应用基因、细胞等生物学手段对受损的起搏或传导组织进行修复或替代,从而使心脏起搏和传导功能得以恢复。从理论上讲,生物起搏不仅安全有效而且可以维持终身,并能适应神经体液调节和随机体发育而发育,是将来取代电子起搏器治疗严重心律失常的理想选择。
生物心脏起搏的理念在20世纪90年代就已经被提出[2],但其大量研究兴起于21世纪初。其十几年的研发历程大致可以划分为3个发展阶段。早期阶段(约2000—2007年)主要开展起搏基因及细胞导入心脏的研究,证实可以建立异位起搏点;当时这些研究取得的进展令人振奋,甚至有研究人员认为几年内即可启动相关人体临床试验[3-5]。但上述预测后续并没有成为现实。中期阶段(约2008—2013年)研究者们将重点放在体内重编程心肌细胞构建生物起搏器上,虽取得了不错的效果,但离临床应用仍尚远[6-7]。现阶段(约2014至今),相关研究进展大多局限于体外干细胞向起搏细胞的诱导分化,距离临床治疗似乎越来越遥不可及[8-12]。本文通过分析目前生物起搏实现临床应用面临的瓶颈和问题,结合笔者多年来的研究实践, 围绕再建心脏房室传导通路这一课题提出几点思考和看法,供商榷。
1 基因导入、细胞移植及组织构建3种方式哪种有望成为理想解决方案?目前针对房室传导阻滞的生物起搏治疗研究主要包括3种思路:(1) 递送基因或细胞到室间隔或心室壁,在传导阻滞点下位建立一个新的起搏点,加快心室自主节律,达到替代电子起搏器治疗的目的[13-14];(2) 递送基因或细胞至心脏房室传导阻滞部位,将损伤的组织定点修复,使心脏房室之间获得正常的信号冲动传导[14-15];(3) 运用组织构建的办法,在房室交界处构建一束“肌桥”(即心传导束),通过该“肌桥”实现心房和心室之间的生理性电传导[16-18]。在上述思路所涉及的生物起搏治疗方式中,基因导入和细胞移植被广泛开展,但目前研究存在很多瓶颈和问题,如基因在体内的安全性、长效性、可调控性尚难保证,递送系统亦不能达到高效、安全、导向性好的要求;细胞移植后容易弥散迁移,导致难以形成稳定同步的起搏节律和紧密的功能性偶联等。尤其是,递送基因或细胞到心脏、在传导阻滞点下位建立起搏点加快心室自主节律的思路和植入电子起搏器类似,毕竟只是对房室传导阻滞所产生心律失常症状的缓解治疗,而对患者的彻底治愈和心功能的全面改善作用有限。
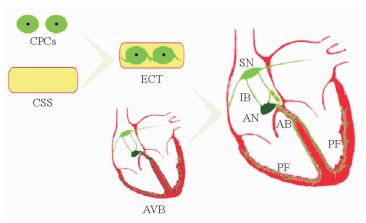
在笔者看来,相较于上述基因和细胞治疗存在的困难,运用组织构建的办法在房室交界处构建一束“肌桥”再建传导通路,即构建组织工程化心传导束(engineered conduction tract or tissue,ECT),应为房室传导阻滞治疗的理想解决方案。利用ECT在心房和心室间架设“肌桥”治疗房室传导阻滞,由于是组织移植修复治疗,所以避免了基因的不可控、不稳定和细胞的易弥散、易迁移。此外,与在下位传导通路建立新起搏点以缓解症状不同,ECT治疗旨在于心房与心室间再建一条新传导通路,这种方式有利于患者的彻底治愈和心功能的全面改善。笔者所在第二军医大学再生医学研究中心,近年来积极开展ECT的研究(图 1、图 2),已证实将所构建的ECT移植入体内可沟通房室间传导[19-22],这一工作的深入开展必将对心脏房室传导阻滞的生物起搏治疗产生重要影响。
|
图 1 组织工程化心传导束的体外构建及体内移植入心脏房室交界区 Fig 1 Engineered conduction tract or tissue (ECT) was prepared in vitro and then transplanted into atrioventricular junction in vivo CPCs: Cardiac progenitor cells; CSS: Collagen sponge scaffold; AVB: Atrioventricular block; SN: Sinoatrial node; IB: Interauricular bundle; AN: Atrioventricular node; AB: Atrioventricular bundle; PF: Purkinje fiber |

|
图 2 组织工程化心传导束大体及H-E染色观察 Fig 2 Engineered conduction tract or tissue (ECT) was observed by macroscopic and H-E staining A: Gross morphology of ECT cultured for 2 weeks (length 8.0 mm, width 2.5 mm); B: H-E staining of ECT cultured for 2 weeks; the cultured cells formed a conductive fibrillar structure on the scaffold |
2 组织构建治疗房室传导阻滞尽快实现临床应用有何捷径?
目前就如何尽快实现生物起搏的临床转化,科学家们持不同的观点。一部分研究者认为,细胞移植由于易致心律失常、易致瘤、易迁移弥散及缺少足够的临床前研究等,而离临床应用较远;相比之下,基因治疗不仅在心力衰竭和帕金森病中已开展了临床Ⅰ/Ⅱ期试验,在心律失常疾病模型中亦积累了足够多的临床前研究,且未发现任何致心律失常性,预示其更接近临床[23-24]。另一部分研究者则持相反的观点,他们认为转基因始终存在安全隐患,细胞移植有更乐观的前景[1, 10, 25];尤其是近期Protze等[10]将人类多潜能干细胞通过非基因改造的办法诱导为起搏细胞,并且移植到动物体内起搏宿主心肌获得成功,使研究者们对5~10年内启动起搏细胞移植治疗的临床试验充满信心[26]。
从理论上讲,ECT治疗心脏房室传导阻滞更接近临床,但若要短期内实现应用仍需考虑适宜的构建策略。ECT构建主要涉及种子细胞、支架材料、细胞支架复合及体内移植等方面,其中,种子细胞是决定构建物是否具有传导功能以及能否修复病损传导组织的关键因素。选择适宜的起搏、传导种子细胞来源,能够使ECT治疗房室传导阻滞在临床上的推广应用变得容易[27]。目前,构建生物起搏器涉及的种子细胞主要包括窦房结细胞、幼稚心肌细胞、胚胎源性干细胞[28-29]、诱导性多能干细胞[30]、骨髓间充质干细胞、脂肪干细胞等。窦房结细胞及幼稚心肌细胞对移植部位微环境的适应能力差且供体来源缺乏,临床实用价值不大。胚胎源性干细胞、诱导性多能干细胞由于免疫排斥、致瘤性等安全性问题尚有待深入研究,短期内应用于临床有较多顾虑。对比之下,骨髓间充质干细胞、脂肪干细胞等成体干细胞在供给来源、安全伦理、分化潜力方面均有很大的优势,其对生物起搏器能否短期内应用于临床具有重要意义。笔者认为,若能用非基因改造的方法将来源于自体的成体干细胞诱导分化为起搏及传导细胞,作为构建ECT的种子细胞,则可以使生物起搏和ECT治疗心脏房室传导阻滞的研究看到临床应用的前景。近年来,我中心多项基金课题开展了干细胞向起搏细胞或传导细胞分化的研究,尝试采用条件培养基、ET-1、NRG-1等多种非基因改造的办法,诱导骨髓多能成体祖细胞、脂肪干细胞、胚胎心脏祖细胞等向起搏细胞或传导细胞方向分化,取得了重要进展[31-37]。上述工作的深入开展,有望加快生物起搏/ECT治疗向临床转化的步伐。
3 组织构建治疗房室传导阻滞临床应用必须考虑的关键问题是什么?研究初步证实,ECT可以再建房室通路,且比细胞和基因治疗更稳定[19-22];但若要实现临床转化,尚需明确进一步的研究方向和拟解决的关键问题。关于这一点,学者们提出了不同的看法。Choi等[27]认为ECT心房端的高电阻抗、ECT自动反应性及其能否随宿主心脏一起发育等是尚需深入探讨的问题。Hou等[16]和Cingolani等[17]则认为,心室端电信号的“捕获”困难或ECT-心室肌界面超极化灌流等问题是下一步研究的重点。Kohl[18]则提出了ECT移植治疗相关的一系列问题,如移植定位、移植后的结构稳定性、血管化、免疫原、电机械偶联等,认为这些问题均需进一步探讨。
上述提出的问题中有一些并不普遍,如血管化(决定于移植体径宽)、自动反应性(与种子细胞有关)等;有一些则随着该领域的研究进展,已经或者可望获得较好的解决[38-42]。笔者认为,若要真正实现房室间生理性电传导及临床转化,一个极为关键的问题目前必须解决,即ECT移植后如何保证正常的房室延搁。正常房室传导电信号要经过房室交界处房室结的延搁,心房、心室才能先后有序地收缩,完成泵血功能。例如人心脏房室交界处的传导速度很慢(0.02~0.1 m/s),所以电信号在该处产生延搁(0.1 s)。而目前研究构建的传导束,其传导速度远远高于房室交界处,故其移植后并不能像正常房室交界一样对信号进行延搁,进而导致心房、心室难以依次起搏、协调收缩。若要解决这一难题,则必须对ECT的传导速度进行调控,使其移植后能够产生生理性房室传导。
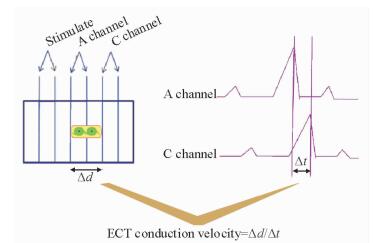
笔者在ECT的构建研究中证实了上述判断,利用课题组成功试制一种性能稳定的体外传导组织测速装置(图 3),检测到所构建ECT传导速度为1.50~2.14 m/s[43-44]。这一速度远远高于正常房室交界处,类似在体心脏房室束及左右束支的传导速度。进一步的在体研究显示,ECT移植一段时间后动物出现明显预激综合征,说明这一传导速度不能实现生理性房室延搁。因此,如何调控ECT的传导速度使能产生生理性房室延搁,是实现其临床应用需解决的关键问题。
|
图 3 组织工程化心传导束传导速度检测装置及信号示意图 Fig 3 Detection device and signal wave schematic diagram of conduction velocity of engineered conduction tract or tissue (ECT) Δd: Distance between A and C channel; Δt: Signal conduction time between A and C channel |
4 对ECT进行传导速度调控是否有可行性方案?
心脏组织内影响传导速度快慢的主要结构性因素是缝隙连接蛋白的表达分布。例如,窦房结和房室结主要由起搏细胞(P细胞)、移行细胞(T细胞)组成,表达缝隙连接蛋白的数量相对较少,且以传导性低的Connexin45和Connexin30.2(慢传导表型)为主,故其传导速度(窦房结为0.05 m/s,房室结则约为0.02 m/s)较心传导系统中的其他组织慢[45-46]。而房室束及左右束支则主要由浦肯野细胞组成,缝隙连接蛋白类型亦以传导性高的Connexin40和Connexin43(快传导表型)为主,故房室束及左右束支传导速度较快,达1.2~2 m/s。因此,心脏不同部位组织细胞类型和缝隙连接蛋白的表型分布与其传导速度的快慢直接相关。
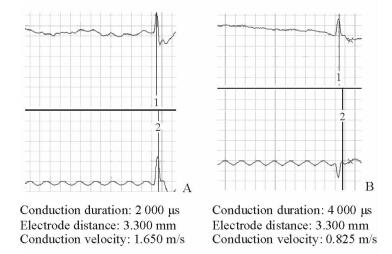
笔者课题组最初构建的ECT传导速度快,近似在体心脏房室束及左右束支的传导速度,构建物中的细胞类型及缝隙连接蛋白的表达是其结构基础[18-20]。经检测所构建传导束以浦肯野细胞和心肌细胞类型为主,缝隙连接蛋白以传导性高的Connexin40和Connexin43分布较多。后续ECT传导速度调控研究进一步显示,当采用控制构建参数的方式时,上述ECT中细胞类型及缝隙连接蛋白表达会出现一定的变化,即小量P细胞/Connexin45增加,且Connexin40和Connexin43轻度下调,而相应的传导速度也随之变慢。因此,调控ECT中的细胞类型及其缝隙连接可以达到调控ECT传导速度的目的(图 4)。但上述方式对ECT中细胞类型及缝隙连接的调控力度有限,相应传导速度的调控幅度也不大,说明若要实现生理性房室延搁,须围绕“细胞类型及缝隙连接蛋白”这一关键点,考虑构建物传导速度的进一步调控。
|
图 4 组织工程化心传导束传导速度调控效果验证 Fig 4 Test of the regulating effect of the conduction velocity of engineered conduction tract or tissue (ECT) A: The conduction velocity of ECT before regulating; B: The conduction velocity of ECT after regulating. 1: Signal of input A channel; 2: Signal of input C channel |
Choi等[27]和Hou等[16]的研究中,均提到ECT若能像房室结一样工作则达到理想的治疗状态。但在ECT已有研究报道中并没能得出对其传导速度进行调控的可行性方案。近年来,随着心脏发育生物学研究的快速发展,房室交界的组织发育、慢传导结构及表型等形成的机制逐渐得到较深入的阐明[47]。例如,一系列信号通路、转录因子等的相互关系及作用网络被发现与房室交界慢传导结构及表型的形成有关(表 1)[7, 47-53]。这些发现将有助于我们设计ECT传导速度进一步调控的可行性方案。
|
|
表 1 心脏房室交界发育中信号通路及转录因子调控缝隙连接表型的作用[7, 47-53] Tab 1 Signaling pathways and transcription factors effectively regulating connexin phenotype in atrioventricular junction development[7, 47-53] |
5 结语
与电子起搏器相比,生物起搏治疗心脏房室传导阻滞具有无可比拟的优势。但目前该领域研究处于体外构建及动物实验阶段,应用于临床尚面临着许多问题。ECT是生物起搏治疗房室传导阻滞较理想的解决方案,具有良好的应用前景;非基因改造成体干细胞为起搏细胞或传导细胞,能加快生物起搏和ECT治疗向临床转化的步伐;ECT实现生理性房室传导及临床应用必须调控传导速度,ECT中的细胞类型及缝隙连接蛋白是传导速度调控的关键。我们相信在不久的将来,生物起搏技术有望应用于临床治疗房室传导阻滞,造福于人类。
| [1] | VEDANTHAM V. New approaches to biological pacemakers:links to sinoatrial node development[J]. Trends Mol Med, 2015, 21: 749–761. DOI: 10.1016/j.molmed.2015.10.002 |
| [2] | KING W L. Method of providing a biological pacemaker:US5103821[P]. 1992-04-14. |
| [3] | GEPSTEIN L, FELD Y, YANKELSON L. Somatic gene and cell therapy strategies for the treatment of cardiac arrhythmias[J]. Am J Physiol Heart Circ Physiol, 2004, 286: H815–H822. |
| [4] | ROSEN M R. Biological pacemaking:a concept whose time has come...or is coming[J]. Heart, 2007, 93: 145–146. |
| [5] | MORRIS G M, BOYETT M R. Perspectives-biological pacing, a clinical reality?[J]. Ther Adv Cardiovasc Dis, 2009, 3: 479–483. DOI: 10.1177/1753944709345792 |
| [6] | SADAHIRO T, YAMANAKA S, IEDA M. Direct cardiac reprogramming:progress and challenges in basic biology and clinical applications[J]. Circ Res, 2015, 116: 1378–1391. DOI: 10.1161/CIRCRESAHA.116.305374 |
| [7] | VAN WEERD J H, CHRISTOFFELS V M. The formation and function of the cardiac conduction system[J]. Development, 2016, 143: 197–210. DOI: 10.1242/dev.124883 |
| [8] | BIRKET M J, RIBEIRO M C, VERKERK A O, WARD D, LEITOGUINHO A R, DEN HARTOGH S C, et al. Expansion and patterning of cardiovascular progenitors derived from human pluripotent stem cells[J]. Nat Biotechnol, 2015, 33: 970–979. DOI: 10.1038/nbt.3271 |
| [9] | LI Y, LI B, ZHANG C, ZHANG J, ZENG M, ZHENG Z. Effect of NRG-1/ErbB signaling intervention on the differentiation of bone marrow stromal cells into sinus node-like cells[J]. J Cardiovasc Pharmacol, 2014, 63: 434–440. DOI: 10.1097/FJC.0000000000000068 |
| [10] | PROTZE S I, LIU J, NUSSINOVITCH U, OHANA L, BACKX P H, GEPSTEIN L, et al. Sinoatrial node cardiomyocytes derived from human pluripotent cells function as a biological pacemaker[J]. Nat Biotechnol, 2017, 35: 56–68. |
| [11] | SAITO Y, NAKAMURA K, YOSHIDA M, SUGIYAMA H, OHE T, KUROKAWA J, et al. Enhancement of spontaneous activity by HCN4 overexpression in mouse embryonic stem cell-derived cardiomyocytes-a possible biological pacemaker[J]. PLoS One, 2015, 10: e0138193. DOI: 10.1371/journal.pone.0138193 |
| [12] | IONTA V, LIANG W, KIM E H, RAFIE R, GIACOMELLO A, MARBÁN E, et al. SHOX2 overexpression favors differentiation of embryonic stem cells into cardiac pacemaker cells, improving biological pacing ability[J]. Stem Cell Reports, 2015, 4: 129–142. DOI: 10.1016/j.stemcr.2014.11.004 |
| [13] | CHO H C. Pacing the heart with genes:recent progress in biological pacing[J]. Curr Cardiol Rep, 2015, 17: 65. DOI: 10.1007/s11886-015-0620-x |
| [14] | XIAO Y F. Cell and gene therapy for arrhythmias:repair of cardiac conduction damage[J]. J Geriatr Cardiol, 2011, 8: 147–158. DOI: 10.3724/SP.J.1263.2011.00147 |
| [15] | YOKOKAWA M, OHNISHI S, ISHIBASHI-UEDA H, OBATA H, OTANI K, MIYAHARA Y, et al. Transplantation of mesenchymal stem cells improves atrioventricular conduction in a rat model of complete atrioventricular block[J]. Cell Transplant, 2008, 17: 1145–1155. DOI: 10.3727/096368908787236594 |
| [16] | HOU Y B, ZOU C W, WANG Y, LI D C, LI Q B, LI H X, et al. Establishing a new electrical conduction pathway by anastomosis of the right auricle and right ventricle assisted by mesenchymal stem cells in a canine model[J]. Transplant Proc, 2011, 43: 3980–3986. DOI: 10.1016/j.transproceed.2011.09.017 |
| [17] | CINGOLANI E, IONTA V, CHENG K, GIACOMELLO A, CHO H C, MARBÁN E. Engineered electrical conduction tract restores conduction in complete heart block:from in vitro to in vivo proof of concept[J]. J Am Coll Cardiol, 2014, 64: 2575–2585. DOI: 10.1016/j.jacc.2014.09.056 |
| [18] | KOHL P. Structural and functional recoupling of atrial and ventricular myocardium:new conduits for electrical flow[J]. J Am Coll Cardiol, 2014, 64: 2586–2588. DOI: 10.1016/j.jacc.2014.09.055 |
| [19] | ZHANG C, ZHANG X, YANG X. Create an engineered conduction tissue by seeding cardiac progenitor cells on gelatin foam[J]. FASEB J, 2012, 26: 454–455. |
| [20] | 李晓童, 张喜, 张传森, 杨向群, 李玉泉. 组织工程化心传导束的初步构建[J]. 解剖学杂志, 2012, 35: 41. DOI: 10.3969/j.issn.1005-1457.2012.046 |
| [21] | LI X, ZHANG X, ZHANG C, LI Y, YANG X. The construction and transplantation of the tissue engineered cardiac conduction bundle[J]. Ann Anat, 2014, 196S1(Abstract): 249. |
| [22] | 张喜, 张传森, 杨向群, 吴爱群, 李玉泉, 蔺海燕. 一种组织工程化传导束及其构建方法与应用: ZL201110405812. 0[P]. 2013-12-25. |
| [23] | BOINK G J, CHRISTOFFELS V M, ROBINSON R B, TAN H L. The past, present, and future of pacemaker therapies[J]. Trends Cardiovasc Med, 2015, 25: 661–673. DOI: 10.1016/j.tcm.2015.02.005 |
| [24] | CINGOLANI E. Biological pacemakers:ready for the clinic?[J]. Trends Cardiovasc Med, 2015, 25: 674–675. DOI: 10.1016/j.tcm.2015.03.003 |
| [25] | CHAUVEAU S, ANYUKHOVSKY E P, BEN-ARI M, NAOR S, JIANG Y P, DANILO P Jr, et al. Induced pluripotent stem cell-derived cardiomyocytes provide in vivo biological pacemaker function[J]. Circ Arrhythm Electrophysiol, 2017, 10: e004508. DOI: 10.1161/CIRCEP.116.004508 |
| [26] | Scientists produce functional heart pacemaker cells[N/OL]. Stem Cells Portal, 2016-12-19[2017-03-02]. http://www.stemcellsportal.com/news/scientists-produce-functional-heart-pacemaker-cells. |
| [27] | CHOI Y H, STAMM C, HAMMER P E, KWAKU K F, MARLER J J, FRIEHS I, et al. Cardiac conduction through engineered tissue[J]. Am J Pathol, 2006, 169: 72–85. DOI: 10.2353/ajpath.2006.051163 |
| [28] | XUE T, CHO H C, AKAR F G, TSANG S Y, JONES S P, MARBAN E, et al. Functional integration of electrically active cardiac derivatives from genetically engineered human embryonic stem cells with quiescent recipient ventricular cardiomyocytes:insights into the development of cell-based pacemakers[J]. Circulation, 2005, 111: 11–20. DOI: 10.1161/01.CIR.0000151313.18547.A2 |
| [29] | CHO H C, KASHIWAKURA Y, MARBÁN E. Creation of a biological pacemaker by cell fusion[J]. Circ Res, 2007, 100: 1112–1115. DOI: 10.1161/01.RES.0000265845.04439.78 |
| [30] | SHIBA Y, HAUCH K D, LAFLAMME M A. Cardiac applications for human pluripotent stem cells[J]. Curr Pharm Des, 2009, 15: 2791–2806. DOI: 10.2174/138161209788923804 |
| [31] | ZHANG X, ZHANG C S, LIU Y C, YANG X Q, XIONG S H, WEN Y, et al. Isolation, culture and characterization of cardiac progenitor cells derived from human embryonic heart tubes[J]. Cells Tissues Organs, 2009, 190: 194–208. DOI: 10.1159/000204750 |
| [32] | ZHANG X, GUO J P, CHI Y L, LIU Y C, ZHANG C S, YANG X Q, et al. Endothelin-induced differentiation of Nkx2.5+ cardiac progenitor cells into pacemaking cells[J]. Mol Cell Biochem, 2012, 366(1/2): 309–318. |
| [33] | ZHANG X, GUO J P, ZHANG C S, YANG X Q, LIU Y C. Differentiation of embryonic heart tube-derived cardiac progenitor cells into pacemaker-like cells[J]. Eur Heart J, 2010, 31(Abstract Supplement): 398. |
| [34] | ZHANG X, SHEN M R, XU Z D, HU Z, CHEN C, CHI Y L, et al. Cardiomyocyte differentiation induced in cardiac progenitor cells by cardiac fibroblast-conditioned medium[J]. Exp Biol Med (Maywood), 2014, 239: 628–637. DOI: 10.1177/1535370214525323 |
| [35] | 陈磊, 姬瑞娟, 邓子军, 张喜, 张传森, 李玉泉, 等. 阻断经典Wnt通路对棕色脂肪干细胞向起搏样细胞分化的作用[J]. 解剖学杂志, 2015, 38: 133–136. DOI: 10.3969/j.issn.1001-1633.2015.02.003 |
| [36] | 张喜, 张传森. 胚胎源性多能干细胞向心脏起搏细胞定向诱导分化的方法: ZL 200710042044. 0[P]. 2011-08-03. |
| [37] | 张传森, 李晓童, 张喜. 一种从成体兔的成熟脂肪细胞诱导分化为心肌样细胞的方法: ZL201110404788. 9[P]. 2013-08-21. |
| [38] | MEYERS J D, JAY P Y, RENTSCHLER S. Reprogramming the conduction system:onward toward a biological pacemaker[J]. Trends Cardiovasc Med, 2016, 26: 14–20. DOI: 10.1016/j.tcm.2015.03.015 |
| [39] | ONGSTAD E, KOHL P. Fibroblast-myocyte coupling in the heart:potential relevance for therapeutic interventions[J]. J Mol Cell Cardiol, 2016, 91: 238–246. DOI: 10.1016/j.yjmcc.2016.01.010 |
| [40] | QUINN T A, CAMELLITI P, ROG-ZIELINSKA E A, SIEDLECKA U, POGGIOLI T, O'TOOLE E T, et al. Electrotonic coupling of excitable and nonexcitable cells in the heart revealed by optogenetics[J]. Proc Natl Acad Sci USA, 2016, 113: 14852–14857. DOI: 10.1073/pnas.1611184114 |
| [41] | PACAK C A, COWAN D B. Fabrication of myogenic engineered tissue constructs[J]. J Vis Exp, 2009. DOI: 10.3791/1137 |
| [42] | SILL B, ALPATOV I V, PACAK C A, COWAN D B. Implantation of engineered tissue in the rat heart[J]. J Vis Exp, 2009. DOI: 10.3791/1139 |
| [43] | 李晓童, 张传森, 张喜, 孙爱军. 测量组织工程化构建物电传导速度的装置与方法: ZL201310744104. 9[P]. 2015-08-26. |
| [44] | 李晓童, 张传森, 张喜, 孙爱军. 一种组织工程化构建物测速装置: ZL201320882080. 9[P]. 2014-11-05. |
| [45] | TEMPLE I P, INADA S, DOBRZYNSKI H, BOYETT M R. Connexins and the atrioventricular node[J]. Heart Rhythm, 2013, 10: 297–304. DOI: 10.1016/j.hrthm.2012.10.020 |
| [46] | DHEIN S, SEIDEL T, SALAMEH A, JOZWIAK J, HAGEN A, KOSTELKA M, et al. Remodeling of cardiac passive electrical properties and susceptibility to ventricular and atrial arrhythmias[J]. Front Physiol, 2014, 5: 424. DOI: 10.3389/fphys.2014.00424.eCollection2014 |
| [47] | KWON C, TOMASELLI G F. Coins of the realm in atrioventricular junction development[J]. Circ Res, 2015, 116: 386–388. DOI: 10.1161/CIRCRESAHA.114.305681 |
| [48] | GILLERS B S, CHIPLUNKAR A, ALY H, VALENTA T, BASLER K, CHRISTOFFELS V M, et al. Canonical wnt signaling regulates atrioventricular junction programming and electrophysiological properties[J]. Circ Res, 2015, 116: 398–406. DOI: 10.1161/CIRCRESAHA.116.304731 |
| [49] | LUXÁN G, D'AMATO G, MacGROGAN D, DE LA POMPA J L. Endocardial Notch signaling in cardiac development and disease[J]. Circ Res, 2016, 118: e1–e18. DOI: 10.1161/CIRCRESAHA.115.305350 |
| [50] | RENTSCHLER S, HARRIS B S, KUZNEKOFF L, JAIN R, MANDERFIELD L, LU M M, et al. Notch signaling regulates murine atrioventricular conduction and the formation of accessory pathways[J]. J Clin Invest, 2011, 121: 525–533. DOI: 10.1172/JCI44470 |
| [51] | SINGH R, HOOGAARS W M, BARNETT P, GRIESKAMP T, RANA M S, BUERMANS H, et al. Tbx2 and Tbx3 induce atrioventricular myocardial development and endocardial cushion formation[J]. Cell Mol Life Sci, 2012, 69: 1377–1389. DOI: 10.1007/s00018-011-0884-2 |
| [52] | MUNSHI N V, MCANALLY J, BEZPROZVANNAYA S, BERRY J M, RICHARDSON J A, HILL J A, et al. Cx30.2 enhancer analysis identifies Gata4 as a novel regulator of atrioventricular delay[J]. Development, 2009, 136: 2665–2674. DOI: 10.1242/dev.038562 |
| [53] | LIU F, LU M M, PATEL N N, SCHILLINGER K J, WANG T, PATEL V V. GATA-binding factor 6 contributes to atrioventricular node development and function[J]. Circ Cardiovasc Genet, 2015, 8: 284–293. DOI: 10.1161/CIRCGENETICS.113.000587 |
 2017, Vol. 38
2017, Vol. 38



