非肺源性急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是外科重症监护病房(surgical intensive care unit,SICU)的常见危重症,常由脓毒症、大量输血、重症胰腺炎、失血性休克等因素导致,病死率高[1]。呼气末正压通气(positive end expiratory pressure,PEEP)是ARDS患者非常重要的治疗方法,PEEP可使陷闭的肺泡和小气道复张,防止复张后再陷闭,增加肺泡内压,减少肺泡渗出[2]。但PEEP过小可使肺泡萎陷,PEEP过大则易导致肺过度充气,均影响患者的血流动力学[3-4]。
全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)是指由感染或非感染性因素导致的炎症介质过量释放、炎症细胞过度激活而产生的一种病理生理状态。SIRS是ARDS的主要发病机制[1],其中白介素(IL)-2、IL-6、IL-8、肿瘤坏死因子α(TNF-α)是促炎因子,IL-4、IL-10是抗炎因子。乌司他丁是机体内存在的一种糖蛋白,属于蛋白酶抑制剂,联合口服激素可控制间质性肺炎患者的炎症反应,减轻肺纤维化,改善肺的弥散功能[5]。乌司他丁具有广泛的抑酶谱,能抑制炎症细胞因子网络的形成[6]。乌司他丁对ARDS患者具有肺保护作用,已积累了大量的临床经验和循证证据[7-8]。
正常人胸腔内不同位置的呼吸力学特征具有不均一性,这种不均一性在ARDS患者中更为突出,不仅影响气体交换,而且使呼吸机相关肺损伤的发生概率增加[2],因此对ARDS患者治疗时进行呼吸力学指标监测非常重要。本研究将我院2014年6月—2016年6月SICU收治的87例中重度非肺源性ARDS患者分为试验组和对照组,分别在常规治疗的基础上给予乌司他丁联合肺泡复张法或单纯肺泡复张法治疗,分析两种治疗方案对患者血清中参与ARDS炎症反应网络的IL-6、IL-10和TNF-α含量[1],桡动脉血气分析结果,以及呼吸机监测指标吸气峰压(peak inspiratory pressure,PIP)、气道平台压(plateau airway pressure,Pplat)、肺静态顺应性(static pulmonary compliance,Cs)和肺动态顺应性(dynamic pulmonary compliance,Cd)影响的差异,并探讨乌司他丁联合肺泡复张法对ARDS的干预作用。
1 资料和方法 1.1 研究对象根据ARDS柏林定义[9],选取2014年6月—2016年6月我院收治的87例全麻术后患者,其中特殊肝段切除术32例、肝门部胆管癌根治术30例、胰十二指肠切除术17例、肾癌根治术5例、肾上腺肿瘤切除术3例。纳入标准:(1) 术后急性起病;(2) 氧合指数(oxygenation index,OI)≤200 mmHg (1 mmHg=0.133 kPa)且PEEP≥5 cmH2O(1 cmH2O=0.098 kPa),并行有创机械通气;(3) 呼吸衰竭排除心源性水肿因素;(4) 影像学可见双侧肺浸润。排除标准:肺部手术、气胸、心衰、慢性阻塞性肺疾病、哮喘、躯干畸形、困难气道、生存期小于7 d者。本研究经第二军医大学东方肝胆外科医院医学伦理委员会审批通过,纳入研究的所有患者均签署书面知情同意书。
1.2 试验设计与分组将87例患者随机分为2组,试验组42例,对照组45例。试验组患者行乌司他丁联合肺泡复张法治疗,对照组单纯行肺泡复张法治疗。乌司他丁(广东天普生物化学制药有限公司,031508034,10万U/瓶),使用剂量:20万U加生理盐水至100 mL,静滴,每天2次,7 d为一个疗程;对照组以等量生理盐水代替。肺泡复张采用PEEP滴定法,最适方法如下:先调整PEEP为20~24 cmH2O促进肺复张,维持10 min,每5~10 min下调2~4 cmH2O直至0。保持吸入氧浓度分数(inspired oxygen fraction,FiO2)为0.8,每次下调PEEP后测定氧分压(partial pressure of oxyge,PaO2)。PaO2/FiO2下降>20%时的PEEP为最适PEEP。此方法联合静态压力容积(P-V)曲线低位拐点法,最终设置PEEP为8~16 cmH2O,同时保持Pplat≤35 cmH2O。
两组患者的共同治疗原则如下:(1) 积极治疗原发病,如抗感染、纠正休克等;(2) 使用Drager300呼吸机行有创机械通气,模式为压力A/C,使用异丙酚镇静、芬太尼镇痛;(3) 根据2012年中华医学会重症医学分会制定的机械通气与脱机指南,对满足脱机评估的患者行自主呼吸试验(spontaneous breathing test,SBT),通过者行脱机拔管;(4) 维持平均动脉压≥65 mmHg;(5) 避免高热、适度的营养支持、维持内环境等措施。治疗期间严密监测患者的生命体征(GE Dash2500监护仪),并根据血压、氧饱和度随时调整镇静药物的泵入剂量及呼吸机参数。
1.3 监测指标使用血气分析仪(GEM Premier3000) 监测并记录两组患者治疗前及治疗后1~7 d的桡动脉PaO2、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)和FiO2,并计算OI(OI=PaO2/FiO2)。记录两组患者治疗前及治疗后第7天的PIP、Pplat、Cs和Cd。
1.4 ELISA检测血清炎症因子分别采用IL-6、IL-10、TNF-α ELISA试剂盒(均购自厦门慧嘉生物科技有限公司)测定两组患者治疗前和治疗后第7天的血清炎症因子IL-6、IL-10、TNF-α的含量。按照试剂盒操作说明进行标本处理后,用酶标仪(Bio-tek ELx800) 测定450 nm处的光密度(D)值,计算IL-6、IL-10、TNF-α的含量。
1.5 统计学处理采用SPSS 19.0软件进行数据处理。计量资料以x±s表示,组间比较采用t检验。计数资料比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 两组患者的一般资料两组患者的年龄、性别、急性生理及慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、呼吸频率、体表面积差异均无统计学意义(P>0.05),具有可比性(表 1)。
|
|
表 1 两组患者一般资料的比较 |
2.2 两组患者治疗前后桡动脉血气分析结果
如图 1所示,两组患者治疗后桡动脉PaO2、PaCO2和OI均呈上升趋势。治疗后第2、3、5、6、7天,试验组患者的桡动脉PaO2均高于对照组(P<0.05);治疗后第1、3、5、7天,试验组患者的桡动脉PaCO2均高于对照组(P<0.05);治疗后第6、7天,试验组患者的桡动脉OI与对照组相比差异有统计学意义(P<0.05)。
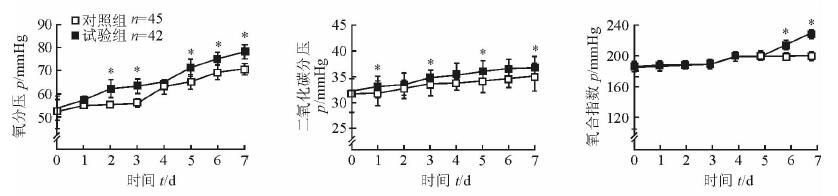
|
图 1 两组患者治疗前后的桡动脉血气分析结果 1 mmHg=0.133 kPa.*P<0.05与同时间点对照组比较. x±s |
2.3 两组患者治疗前后的呼吸力学指标的变化
治疗后第7天监测两组患者的呼吸力学指标,结果(图 2) 显示,试验组和对照组患者的PIP和Pplat与治疗前相比均下降(P<0.05),但试验组低于对照组(P<0.05);两组患者的Cs、Cd与治疗前相比均上升(P<0.05),但试验组高于对照组(P<0.05)。
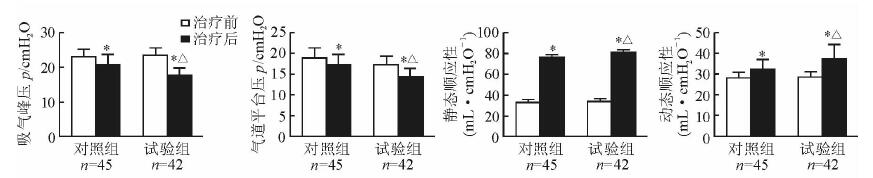
|
图 2 两组患者治疗前后呼吸力学指标的变化 1 cmH2O=0.098 kPa. *P<0.05与同组治疗前比较;△P<0.05与对照组治疗后比较. x±s |
2.4 两组患者治疗前后血清IL-6、IL-10、TNF-α含量的比较
ELISA检测两组患者治疗前及治疗后第7天时的血清IL-6、IL-10、TNF-α含量,结果(图 3) 显示两组患者的血清IL-6、TNF-α含量较治疗前均减少(P<0.05),IL-10含量增加(P<0.05);但试验组变化更明显,与对照组治疗后相比差异有统计学意义(P<0.05)。

|
图 3 两组患者治疗前后血清白介素(IL)-6、IL-10、肿瘤坏死因子α(TNF-α)含量的比较 *P<0.05与同组治疗前比较;△P<0.05与对照组治疗后比较. x±s |
3 讨论
炎症因子通过作用于肺内机械与化学感受器引发呼吸浅快、气道高反应性,同时导致毛细血管的通透性增加以及收缩功能失调,肺间质、肺泡水肿,从而导致ARDS的发生[10-11]。研究表明,ARDS患者血浆和肺泡灌洗液中炎症因子水平明显高于正常人,且炎症因子水平和患者的生存率密切相关[12]。可见,炎症介质参与ARDS的发生、发展过程,抗炎对ARDS的治疗极为重要。本研究结果显示,ARDS患者经乌司他丁联合肺泡复张法治疗后,血清促炎因子IL-6、TNF-α含量较单纯行肺泡复张法治疗的患者减少、抗炎因子IL-10含量增加,表明乌司他丁可通过延缓SIRS治疗非肺源性ARDS。
肺泡复张的主要目的是使萎陷的肺泡打开,但在打开这些萎陷肺泡的同时,也会使附近的正常肺泡过度扩张甚至破裂[13]。均匀的肺内改变可使复张效果更好,而内源性ARDS的不均匀改变可能在使萎陷肺泡尚未完全复张时,原来相对正常的肺泡却已过度开放;而外源性ARDS的病理分布较内源性相对均匀,损伤程度相对较轻。故本研究选取的研究对象均为外源性ARDS患者。在实际进行肺泡复张操作时,肺泡复张的压力选择和PEEP的调节是影响复张效果最重要的因素[14]。适宜的PEEP是治疗ARDS的重要手段,可使ARDS患者可复张肺泡保持开放,且随着PEEP的升高肺功能改善、OI升高[15];但PEEP过高可导致气压伤以及循环不稳定[16]。目前如何选择最合适的PEEP尚无定论。在无自主呼吸条件下,根据P-V曲线找到低位拐点所对应的压力,将PEEP定位在此压力+2 cmH2O,是PEEP选择方法的理论基础[17]。本研究根据氧浓度的滴定,个体化选择最利于肺泡复张的PEEP,并随患者病情调整,使萎陷肺泡完全开放并维持开放状态,同时尽量避免肺损伤以减少其对血流动力学的影响。本研究比较乌司他丁联合肺泡复张法(试验组)和单纯肺泡复张法(对照组)治疗患者的血气分析和呼吸力学指标,结果显示两组患者治疗后第7天的PaO2、OI均上升,且试验组上升程度大于对照组。试验组的OI持续>200 mmHg,表明患者脱机可能性增高。治疗后两组患者PaCO2上升,但仍在正常值范围,没有临床意义。治疗后第7天,两组患者的PIP、Pplat较治疗前均下降,Cs、Cd均上升,但试验组患者治疗后上述4个指标的变化程度均大于对照组,差异有统计学意义(P<0.05),表明乌司他丁可提高OI,改善肺功能。
综上所述,在常规治疗基础上,使用肺泡复张法治疗ARDS可改善患者OI和炎症反应,而肺泡复张联合使用乌司他丁后患者的OI和炎症反应改善更明显,提示乌司他丁可改善OI、抑制过度的炎症反应、减轻机械及化学肺损伤。
| [1] | MÁCA J, JOR O, HOLUB M, SKLIENKA P, BURŠA F, BURDA M, et al. Past and present ARDS mortality rates:a systematic review[J]. Respir Care, 2017, 62: 113–122. DOI: 10.4187/respcare.04716 |
| [2] | 刘大为. 机械通气与急性呼吸窘迫综合征[J]. 中国危重病急救医学, 2010, 22: 129–130. DOI: 10.3760/cma.j.issn.1003-0603.2010.03.001 |
| [3] | 喻文, 罗红敏. 更高呼气末正压可改善ARDS肥胖患者的存活率[J]. 中华危重病急救医学, 2017, 29: 50–55. |
| [4] | SAHETYA S K, GOLIGHER E C, BROWER R G. Fifty years of research in ARDS. Setting positive end-expiratory pressure in the acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2017, 195: 1429–1438. DOI: 10.1164/rccm.201610-2035CI |
| [5] | GAO C, LI R, WANG S. Ulinastatin protects pulmonary tissues from lipopolysaccharide-induced injury as an immunomodulator[J]. J Trauma Acute Care Surg, 2012, 72: 169–176. |
| [6] | SONG Z, CHEN G, LIN G, JIA C, CAO J, AO G. The ultra-early protective effect of ulinastatin on rabbit acute lung injury induced by paraquat[J]. BMC Emerg Med, 2013, 13(Suppl 1): S7. |
| [7] | LUO Y, CHE W, ZHAO M. Ulinastatin post-treatment attenuates lipopolysaccharide-induced acute lung injury in rats and human alveolar epithelial cells[J]. Int J Mol Med, 2017, 39: 297–306. |
| [8] | LIN B, LIU Y, LI T, ZENG K, CAI S, ZENG Z, et al. Ulinastatin mediates protection against vascular hyperpermeability following hemorrhagic shock[J]. Int J Clin Exp Pathol, 2015, 8: 7685–7693. |
| [9] | ARDS Definition Task Force, RANIERI V M, RUBENFELD G D, THOMPSON B T, FERGUSON N D, CALDWELL E, FAN E, et al. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307: 2526–2533. |
| [10] | MEDURI G U. The role of the host defence response in the progression and outcome of ARDS:pathophysiological correlations and response to glucocorticoid treatment[J]. Eur Respir J, 1996, 9: 2650–2670. DOI: 10.1183/09031936.96.09122650 |
| [11] | SCHROEDER J E, WEISS Y G, MOSHEIFF R. The current state in the evaluation and treatment of ARDS and SIRS[J]. Injury, 2009, 40(Suppl 4): S82–S89. |
| [12] | BHATIA M, MOOCHHALA S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome[J]. J Pathol, 2004, 202: 145–156. DOI: 10.1002/(ISSN)1096-9896 |
| [13] | MOLONEY E D, GRIFFITHS M J. Protective ventilation of patients with acute respiratory distress syndrome[J]. Br J Anaesth, 2004, 92: 261–270. DOI: 10.1093/bja/aeh031 |
| [14] | 贾子毅, 刘晓伟, 刘志. 机械通气氧合指数对ARDS患者预后评估的价值:附228例回顾性分析[J]. 中华危重病急救医学, 2017, 29: 45–50. DOI: 10.3760/cma.j.issn.2095-4352.2017.01.010 |
| [15] | HSU C F, CHENG J S, LIN W C, KO Y F, CHENG K S, LIN S H, et al. Electrical impedance tomography monitoring in acute respiratory distress syndrome patients with mechanical ventilation during prolonged positive end-expiratory pressure adjustments[J]. J Formos Med Assoc, 2015, 115: 195–202. |
| [16] | STAHL C A, MÖLLER K, STEINMANN D, HENZLER D, LUNDIN S, STENQVIST O. Determination of 'recruited volume' following a PEEP step is not a measure of lung recruitability[J]. Acta Anaesthesiol Scand, 2015, 59: 35–46. DOI: 10.1111/aas.2015.59.issue-1 |
| [17] | GORDO F, CONEJO I. What PEEP level should I use in my patient?[J]. Med Intensiva, 2017, 41: 267–269. DOI: 10.1016/j.medin.2016.10.010 |
 2017, Vol. 38
2017, Vol. 38



