临床实践发现部分患者对抗血小板药物存在抵抗性,导致抗血小板药物疗效不佳和易发生血小板高反应性(high on-treatment platelet reactivity,HTPR)[1]。本研究旨在利用临床基线和常规指标,筛选与HTPR相关的危险因素并构建危险因素评分,以帮助医师快速识别急性心肌梗死(acute myocardial infarction,AMI)经皮冠脉介入(percutaneous coronary intervention,PCI)治疗后可能发生血小板高反应性的患者。
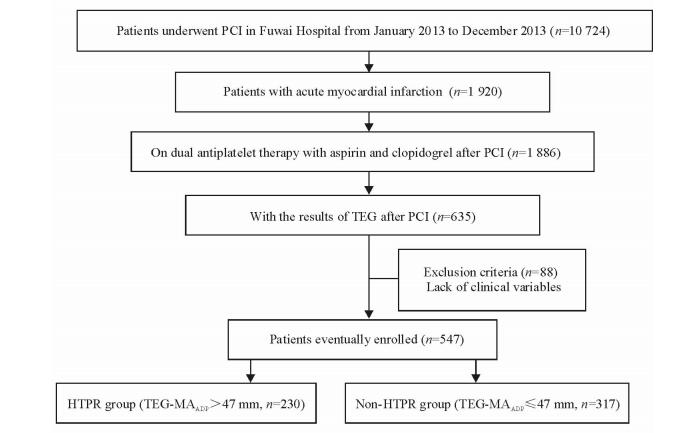
1 资料和方法 1.1 研究对象本研究为单中心观察性研究。纳入标准:(1)2013年1月至12月于北京协和医学院阜外医院行PCI治疗的AMI患者;(2) 患者术后服用阿司匹林100 mg/d加氯吡格雷75 mg/d双联抗血小板治疗;(3) 有PCI治疗后血栓弹力图检测结果。排除标准:缺失血常规、心功能、肾功能等临床指标者。依据文献[2]报道,定义血栓弹力图最大凝块强度(TEG-MAADP)>47 mm为存在HTPR。将所有纳入患者中TEG-MAADP>47 mm的患者归为血小板高反应组(HTPR组),TEG-MAADP≤47 mm的患者归为非血小板高反应组(非HTPR组),采用病例对照研究模式进行临床因素-血小板功能关联分析,筛选出与HTPR发生相关的临床因素,构建危险因素评分。本研究经阜外医院伦理委员会审批通过,所有患者均已签署知情同意书。研究设计流程如图 1所示。
|
图 1 研究设计流程图 Fig 1 Flow diagram describing the study design PCI: Percutaneous coronary intervention; HTPR: High on-treatment platelet reactivity; TEG: Thrombelastogram; MAADP: ADP-induced platelet-fibrin clot strength; ADP: Adenosine diphosphate |
1.2 评分构建
纳入患者的年龄、性别、体质量指数(BMI)、高血压、高脂血症、糖尿病、吸烟、左室射血分数(LVEF)、血肌酐(Scr)、血小板(PLT)计数和血红蛋白(Hb)等临床常用变量,用于筛选与HTPR独立相关的临床危险因素并构建评分。对于连续性变量,在分析前依据临床公认界值转换为二分类变量,具体如下:高龄(>75岁)、肥胖(BMI>30 kg/m2)、心脏功能减低(LVEF < 50%)、肾功能减低(Scr>133 μmol/L)、血小板增多(PLT>300×109/L)以及高血红蛋白血症(Hb>160 g/L)。
1.3 统计学处理采用SPSS 20.0软件进行数据处理与分析。计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以率表示,组间比较采用χ2检验。采用单因素logistic回归分析筛选出与HTPR相关的临床指标(P < 0.05),将这些指标放入多因素logistic回归模型中,经校正后进一步筛选出与HTPR独立相关的临床危险因素。多因素logistic回归模型中P < 0.05的临床变量被最终纳入评分模型,风险以比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)表示,并依据OR值权重给予赋分,构建HTPR临床风险评分。采用受试者工作特征(receiver operating characteristic,ROC)曲线划定能最佳预测HTPR的评分界值。检验水准(α)为0.05。
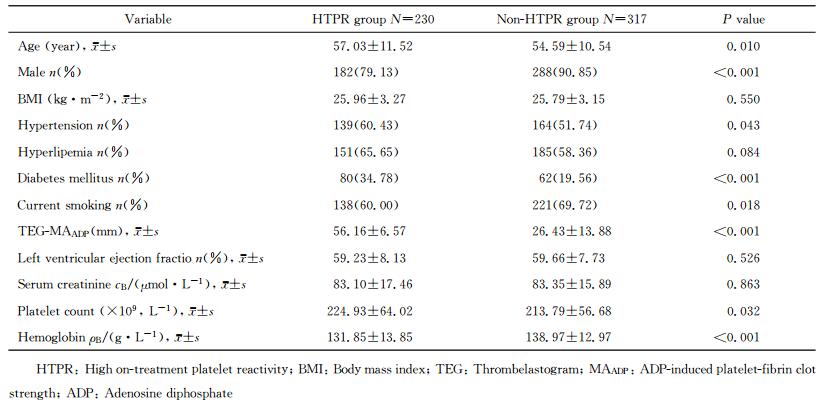
2 结果 2.1 患者的临床特征2013年1月至12月共1 920例AMI患者在阜外医院行PCI,其中1 886例患者术后服用阿司匹林加氯吡格雷双联抗血小板治疗。635例患者有PCI治疗后TEG-MAADP检测结果,排除88例存在临床缺失项的患者,最终547例患者纳入本研究。其中230例(42.05%)患者存在HTPR,TEG-MAADP值高于非HTPR组患者[(56.16±6.57) mm vs (26.43±13.88) mm,P < 0.001],两组患者的临床基线资料见表 1。
|
|
表 1 两组患者的临床特征 Tab 1 Clinical characteristics of patients in two groups |
2.2 危险评分构建
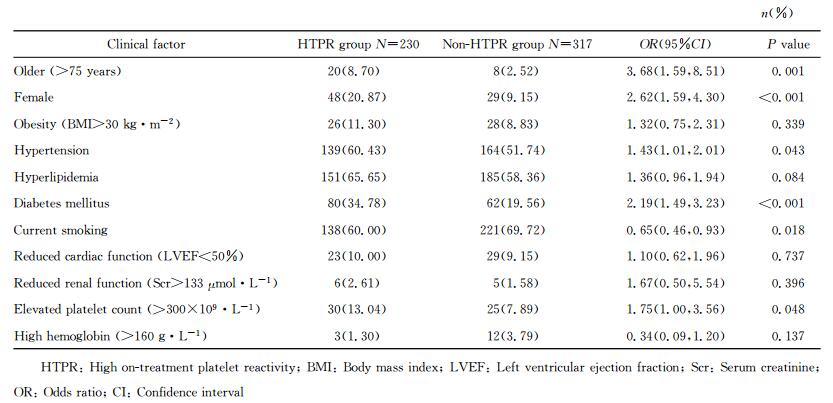
单因素logistic回归分析筛选发现,高龄(>75岁)、女性、合并高血压、合并糖尿病和血小板增多(PLT>300×109/L) 5个临床因素与HTPR的发生相关,详见表 2。进一步行多因素logistic回归分析显示,高龄(>75岁)、女性、合并糖尿病是HTPR的独立危险因素。依据OR值权重赋予相应分值,具体如下:高龄(>75岁)3分(OR=2.87,95%CI 1.19~6.89),女性2分(OR=2.14,95%CI 1.27~3.60),合并糖尿病2分(OR=2.09,95%CI 1.40~3.12),分值范围0~7分。多因素logistic回归分析及HTPR评分构建见表 3。
|
|
表 2 临床因素对HTPR影响的单因素分析 Tab 2 Univariate analysis of clinical factors related to HTPR |
|
|
表 3 临床因素对HTPR影响的多因素回归分析及评分构建 Tab 3 Establishment of the risk score for predicting HTPR by multivariate analysis |
2.3 血小板反应性比较
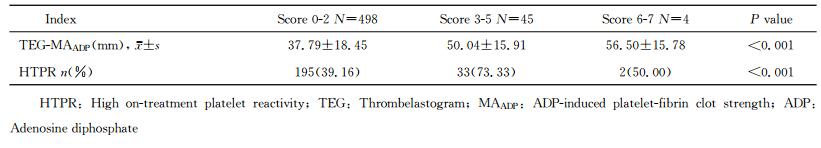
统计所有患者得分,依据总分将患者分为3组:0~2分为低危组,3~5分为中危组,6~7分为高危组,结果显示3组间各血小板反应性指标比较差异均有统计学意义(P < 0.001),即得分越高血小板反应性越高。各组人数、血小板反应性及HTPR比例见表 4。ROC曲线分析显示得分>2分能有效预测是否存在HTPR[曲线下面积(AUC)=0.627,95%CI 0.579~0.675,P < 0.001],灵敏度为50.9%,特异度为72.6%。得分>2分患者的血小板反应性和HTPR比例均高于≤2分的患者(P < 0.001)。
|
|
表 4 依据评分分组比较血小板反应性 Tab 4 Comparison of platelet reactivity among different score levels |
3 讨论
诸多研究表明HTPR与心肌梗死、脑卒中、支架血栓等缺血性事件显著相关,血小板功能检测和基因检测已被推荐用于临床,旨在帮助识别可能存在HTPR的患者[1, 3],从而指导个体化治疗,如加大药物剂量、更换药效更强的新型抗血小板药物等[4-5],然而无论是血小板功能检测还是基因检测都存在一定的局限性:(1) 都要抽取患者血液,增加了患者和医护人员的负担;(2) 普及度均欠缺,部分医院并不具备相关检测设备;(3) 都需要耗费一定时间,不利于医师即时优化治疗策略;(4) 都增加了患者的医疗费用。因此,本研究提出是否可以利用临床基线和常规指标筛选出与HTPR发生相关的临床危险因素,并构建危险评分,旨在通过该评分系统帮助临床医师对患者血小板反应性做出全面评估,快速识别可能发生HTPR的患者,省去额外的检测时间和费用,进而给予患者针对性的个体化抗血小板治疗。
本研究通过单因素分析发现高龄(>75岁)、女性、合并高血压、合并糖尿病和血小板增多(PLT>300×109/L)与HTPR发生相关。既往也有诸多研究表明这些临床因素与HTPR发生密切相关。Cuisset等[6]和Silvain等[7]发现无论是在负荷剂量下还是在维持剂量下检测血小板反应性,年龄>75岁的患者的HTRP比例均高于≤75岁的患者。既往研究表明女性更易发生HTPR,考虑主要与性激素水平相关[8-10]。Kim等[11]分析推测血压增高患者易发生HTPR,可能与血管剪切应力增加促进血小板黏附、聚集有关。糖尿病是公认的导致HTPR发生的重要因素之一,其机制可能与促进血小板激活和增加血管炎症反应密切相关[12-13]。Jakl等[14]指出血小板计数>400×109/L可导致HTPR发生风险增高,可能与增多的血小板是潜在的强有力促聚集因素相关。本研究通过多因素logistic回归分析发现,高龄(>75岁)、女性、合并糖尿病是HTPR发生的独立危险因素,被纳入评分构建模型。
本研究是首次在AMI-PCI患者中利用临床指标构建HTPR危险评分,结果显示得分越高,越容易发生HTPR,这与既往研究结论相同:Geisler等[15]在非选择性冠心病(包括各型心绞痛和心肌梗死)患者中建立PREDICT评分评估HTPR的发生风险,将筛选出的危险因素包括心功能减低(LVEF < 55%)赋3分、合并糖尿病和肾功能减低(Scr>15 mg/L)各赋2分、高龄(>65岁)和表型为急性冠脉综合征各赋1分,结果显示PREDICT评分(分值范围0~9分)不仅能有效识别HTPR,还能预测出院后30 d的临床事件,得分>5分的患者临床不良事件显著增加。Droppa等[16]在稳定冠心病患者中建立PREDICT-STABLE评分来预测HTPR的风险,将筛选出的危险因素包括高龄(>63岁)赋3分、合并糖尿病和超重(BMI>30 kg/m2)各赋2分、心功能减低(LVEF < 55%)和肾功能减低(Scr>11 mg/L)各赋1分,分值范围0~9分,结果显示0~3、4~6、7~9分3组患者间的血小板反应性存在差异,其中7~9分组的1年不良事件发生率高于0~3分组。以上研究均表明,临床因素危险评分可以快速有效地帮助医师识别HTPR高危患者和评估患者临床预后,为抗血小板治疗策略的选择提供循证依据。
本研究的局限性为研究是单中心观察性研究,故得出的结果仍有待大规模多中心的前瞻性研究证实。此外,研究样本量偏小,统计效能不足以评估临床事件,因此需要通过进一步扩大样本量验证分析评分是否能有效评估患者临床预后。
综上所述,临床因素与HTPR发生密切相关,构建临床危险评分能协助医务人员快速识别可能发生HTPR的患者,从而指导抗血小板个体化治疗。
| [1] | WISMAN P P, ROEST M, ASSELBERGS F W, DE GROOT P G, MOLL F L, VAN DER GRAAF Y, et al. Platelet-reactivity tests identify patients at risk of secondary cardiovascular events:a systematic review and meta-analysis[J]. J Thromb Haemost, 2014, 12: 736–747. DOI: 10.1111/jth.12538 |
| [2] | TANTRY U S, BONELLO L, ARADI D, PRICE M J, JEONG Y H, ANGIOLILLO D J, et al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding[J]. J Am Coll Cardiol, 2013, 62: 2261–2273. DOI: 10.1016/j.jacc.2013.07.101 |
| [3] | HAMM C W, BASSAND J P, AGEWALL S, BAX J, BOERSMA E, BUENO H, et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation:the task force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2011, 32: 2999–3054. DOI: 10.1093/eurheartj/ehr236 |
| [4] | PRICE M J, MURRAY S S, ANGIOLILLO D J, LILLIE E, SMITH E N, TISCH R L, et al. Influence of genetic polymorphisms on the effect of high-and standard-dose clopidogrel after percutaneous coronary intervention:the GIFT (Genotype Information and Functional Testing) study[J]. J Am Coll Cardiol, 2012, 59: 1928–1937. DOI: 10.1016/j.jacc.2011.11.068 |
| [5] | GURBEL P A, ERLINGE D, OHMAN E M, NEELY B, NEELY M, GOODMAN S G, et al. Platelet function during extended prasugrel and clopidogrel therapy for patients with ACS treated without revascularization:the TRILOGY ACS platelet function substudy[J]. JAMA, 2012, 308: 1785–1794. DOI: 10.1001/jama.2012.17312 |
| [6] | CUISSET T, QUILICI J, GROSDIDIER C, FOURCADE L, GABORIT B, PANKERT M, et al. Comparison of platelet reactivity and clopidogrel response in patients ≤ 75 years versus > 75 years undergoing percutaneous coronary intervention for non-ST-segment elevation acute coronary syndrome[J]. Am J Cardiol, 2011, 108: 1411–1416. DOI: 10.1016/j.amjcard.2011.06.060 |
| [7] | SILVAIN J, CAYLA G, HULOT J S, FINZI J, KERNEIS M, O'CONNOR S A, et al. High on-thienopyridine platelet reactivity in elderly coronary patients:the SENIOR-PLATELET study[J]. Eur Heart J, 2012, 33: 1241–1249. DOI: 10.1093/eurheartj/ehr407 |
| [8] | CAPODANNO D, ANGIOLILLO D J. Impact of race and gender on antithrombotic therapy[J]. Thromb Haemost, 2010, 104: 471–484. DOI: 10.1160/TH10-04-0232 |
| [9] | MARCUCCI R, CIONI G, GIUSTI B, FATINI C, ROSSI L, PAZZI M, et al. Gender and anti-thrombotic therapy:from biology to clinical implications[J]. J Cardiovasc Transl Res, 2014, 7: 72–81. DOI: 10.1007/s12265-013-9534-4 |
| [10] | BREET N J, SLUMAN M A, VAN BERKEL M A, VAN WERKUM J W, BOUMAN H J, HARMSZE A M, et al. Effect of gender difference on platelet reactivity[J]. Neth Heart J, 2011, 19: 451–457. DOI: 10.1007/s12471-011-0189-y |
| [11] | KIM H, LEE H K, HAN K, JEON H K. Prevalence and risk factors for aspirin and clopidogrel resistance in patients with coronary artery disease or ischemic cerebrovascular disease[J]. Ann Clin Lab Sci, 2009, 39: 289–294. |
| [12] | GEISLER T, MUELLER K, AICHELE S, BIGALKE B, STELLOS K, HTUN P, et al. Impact of inflammatory state and metabolic control on responsiveness to dual antiplatelet therapy in type 2 diabetics after PCI:prognostic relevance of residual platelet aggregability in diabetics undergoing coronary interventions[J]. Clin Res Cardiol, 2010, 99: 743–752. DOI: 10.1007/s00392-010-0179-x |
| [13] | FERREIRO J L, ANGIOLILLO D J. Challenges and perspectives of antiplatelet therapy in patients with diabetes mellitus and coronary artery disease[J]. Curr Pharm Des, 2012, 18: 5273–5293. DOI: 10.2174/138161212803251916 |
| [14] | JAKL M, SEVCIK R, CERAL J, FATOROVA I, HORACEK J M, VOJACEK J. Mean platelet volume and platelet count:overlooked markers of high on-treatment platelet reactivity and worse outcome in patients with acute coronary syndrome[J]. Anadolu Kardiyol Derg, 2014, 14: 85–86. |
| [15] | GEISLER T, GRASS D, BIGALKE B, STELLOS K, DROSCH T, DIETZ K, et al. The Residual Platelet Aggregation after Deployment of Intracoronary Stent (PREDICT) score[J]. J Thromb Haemost, 2008, 6: 54–61. |
| [16] | DROPPA M, TSCHERNOW D, MVLLER K A, TAVLAKI E, KARATHANOS A, STIMPFLE F, et al. Evaluation of clinical risk factors to predict high on-treatment platelet reactivity and outcome in patients with stable coronary artery disease (PREDICT-STABLE)[J]. PLoS One, 2015, 10: e121620. DOI: 10.1371/journal.pone.0121620 |
 2017, Vol. 38
2017, Vol. 38