2. 第二军医大学东方肝胆外科医院腹腔镜科, 上海 200438;
3. 第二军医大学东方肝胆外科医院胆道三科, 上海 200438
2. Department of Laparoscopic, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
3. Department of Biliary Tract Surgery(Ⅱ), Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
肝移植是目前治疗终末期肝病最有效的方法之一[1],但其同时具有较高的并发症发生率;肝移植术后易发生血管并发症、胆道并发症、感染、排斥反应等常见并发症,如何预防各类并发症是各大肝移植中心探讨的热点问题[2-5]。本手术组在临床实践中发现肝周大量积血也是肝移植术后的常见并发症之一。术后肝周大量积血是指术后30 d内经B超、CT或磁共振成像(MRI)检查发现的肝周积血或血凝块,体积在500 mL以上,以皮肤、巩膜黄染突然加重,全血白细胞计数及中性粒细胞比例短时间内显著升高,肝功能受损(血清总胆红素及谷丙氨酸转氨酶快速上升或恢复停滞)为典型临床表现;同时,部分患者还伴有感染、精神神经症状及肾功能损害等临床表现,严重者可危及患者生命。本研究回顾性分析了第二军医大学东方肝胆外科医院胆道一科2004年3月至2007年4月收治的117例同种异体原位肝移植患者的临床资料,初步探讨了该类并发症的发生原因及防治措施,现报告如下。
1 资料和方法 1.1 一般资料2004年3月至2007年4月在第二军医大学东方肝胆外科医院胆道一科行同种异体原位肝移植的患者共117例,均为成人尸体肝移植。所有患者围手术期死亡12例:术中心跳停止且心肺复苏失败死亡1例,术后腹腔出血死亡2例(其中1例为肝穿后腹腔出血),多器官功能障碍综合征(MODS)死亡2例,急性呼吸窘迫综合征(ARDS)死亡1例,颅内出血死亡2例,移植物抗宿主病(GVHD)死亡1例,弥漫性血管内凝血(DIC)死亡2例,供体无功能死亡1例。故最终105例纳入本研究,其中男性90例(85.7%),女性15例(14.3%),男女比例为6:1;年龄28~70岁,平均(47.81±9.25) 岁。有病毒性肝炎感染病史者93例(88.6%),其中乙型肝炎90例、丙型肝炎3例;无病毒性肝炎感染病史者12例(11.4%)。既往有腹部手术病史者18例(17.1%)。术后病理报告示恶性肿瘤患者84例(80.0%),包括肝细胞癌75例(89.2%)、肝门部胆管癌5例(6.0%)、肝内胆管癌1例(1.2%)、混合性肝癌1例(1.2%)、胆囊癌1例(1.2%)、肝血管肉瘤1例(1.2%);良性终末期肝病患者21例,其中肝炎后肝硬化15例(71.4%)、胆汁性肝硬化5例(23.8%)、Wilson’s病1例(4.8%)。
1.2 手术概况手术方式分为经典非转流肝移植(93例)和背驼式肝移植(12例)两种,术中部分附加脾切除(1例)或脾动脉结扎术(2例)。供肝有9例为轻度脂肪肝,其余均为正常肝。腹主动脉灌注器官保存液(UW液) 2 000 mL,门静脉灌注UW液4 000 mL,胆道灌注UW液200 mL。热缺血时间均≤10 min,供肝修正及肝移植均为同一手术组人员。吻合方式:腔静脉为3-0 proline线连续外翻吻合;门静脉、肝静脉采用5-0 proline线连续外翻吻合;动脉修整为喇叭口,7-0 proline线间断吻合;胆管采用7-0 proline线间断吻合,不放置支撑管;其中96例行胆管-胆管端端吻合,8例行胆管-胆管端侧吻合,1例行胆肠吻合。
1.3 术后处理、观察及近期(术后1个月内)并发症发生情况患者术后均转入特护病房,予以吸氧、镇痛等常规对症处理,常规连续使用抗生素3 d抗感染,胃肠减压2~4 d,至患者肛门排气。大部分患者术后3~5 d内恢复进食,单腔引流管的计划拔除时间为术后连续3 d腹腔液引流量少于10 mL。移植后抗排斥反应方案有以下两种:(1) 激素+他克莫司(FK506)+吗替麦考酚酯胶囊(81例);(2) 达利珠单抗(或注射用巴利昔单抗)+他克莫司(FK506)+吗替麦考酚酯胶囊(24例)。术后1、3、5、7、10、14 d常规采血检测患者血常规、肝肾功能、电解质、血淀粉酶、腹腔液淀粉酶。
105例患者术后1个月内并发症情况:9例发生肝周大量积血;肺部感染17例;腹腔感染21例;细菌性肠炎10例;术后胰腺炎22例;术后胆漏5例;出现精神症状(主要表现为烦躁或多语)5例;急性轻度排斥反应2例;FK506中毒3例;吗替麦考酚酯胶囊致骨髓抑制2例;GVHD 1例。
1.4 统计指标统计分析各患者的下列各项指标因素。(1) 术前因素:性别、年龄、上腹部手术史、术前血红蛋白水平、术前白细胞水平、术前血小板水平、术前血清白蛋白水平、术前血清凝血酶原时间、术前血清总胆红素水平、术前是否感染肝炎病毒。(2) 术中因素:肿瘤大小、腹水、肝硬化、术中出血量、供体脂肪肝、热缺血时间、冷缺血时间、手术时间、无肝期、手术方式。(3) 术后因素:移植后抗排斥方案、术后急性胰腺炎、术后胆漏。
1.5 统计学处理采用SPSS 16.0软件进行数据处理。患者的基本情况采用描述性统计,采用χ2检验筛选与肝移植术后肝周大量积血相关的危险因素,将P<0.10的单因素纳入logistic多元回归模型中行多因素分析,分析肝移植术后肝周大量积血的独立危险因素,并建立回归方程。检验水准(α)为0.05。
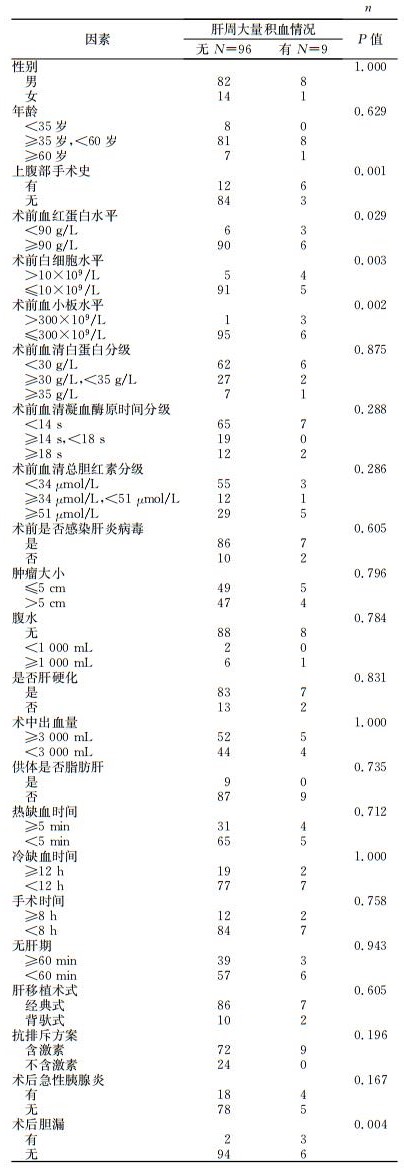
2 结果 2.1 肝周大量积血危险因素的单因素分析单因素分析结果(表 1) 可见,肝移植术后肝周大量积血与患者上腹部手术史(P=0.001)、术前血红蛋白水平(P=0.029)、术前白细胞水平(P=0.003)、术前血小板水平(P=0.002)、术后胆漏(P=0.004) 均有关联。
|
|
表 1 肝移植术后肝周大量积血危险因素的单因素分析 |
2.2 肝周大量积血危险因素的多因素分析
将单因素分析中P<0.10的指标(上腹部手术史、术前血红蛋白水平、术前白细胞水平、术前血小板水平、术后胆漏)行多因素分析。结果(表 2) 可见,患者既往上腹部手术史(P=0.008,OR=15.000)、术后胆漏(P=0.034,OR=20.770) 是肝移植术后肝周大量积血的独立危险因素。
|
|
表 2 肝移植术后肝周大量积血危险因素的多元回归分析 |
2.3 肝周大量积血患者的临床表现及相应处理措施
105例患者中9例术后3~29 d经B超检查发现肝周大量积血或血凝块。这9例患者中,出现皮肤、巩膜黄染加重者7例(77.8%),神智淡漠者2例(22.2%),尿量减少者1例(11.1%),发热者1例(11.1%),全血白细胞计数及中性粒细胞比例迅速升高者7例(77.8%);肝功能检查示血清丙氨酸转氨酶升高者7例(77.8%),血清总胆红素水平升高者7例(77.8%),白细胞升高与肝脏损伤同步出现者6例(66.7%)。
9例患者中6例经手术清除肝周积血及血凝块后治愈;2例序贯实施B超引导下穿刺引流术、肝周积血及血凝块清除术后获得治愈(其中1例清除肝周血凝块后,发现胆管吻合口受血凝块压迫部分坏死,补充实施坏死胆管切除+胆肠吻合术);1例经单纯B超引导下肝周积血穿刺引流术后治愈。6例患者术后腹腔积血或血凝块送细菌培养可检出大肠杆菌、肺炎克雷伯杆菌或屎肠球菌等致病细菌生长。
3 讨论腹腔内感染是肝移植术后最常见的并发症之一,也是导致肝移植受体围手术期死亡的主要原因之一[6]。肝周大量积血形成后如不及时清理,可能成为细菌生长的良好培养基,引起腹腔内感染。
本手术组在临床观察中发现,陈旧性积血的典型B超表现为肝周间隙内的“液性暗区”,陈旧性血凝块的典型B超表现为肝周腔隙内的“略强回声区”;陈旧性积血的典型CT表现为“液性低密度区,增强后无强化”,陈旧性血凝块的典型CT表现为“软组织样密度影,增强后无强化”;陈旧性血凝块的MRI表现为T1不均匀低信号,T2不均匀高信号,增强后无强化。CT及MRI能够明确诊断肝周大量积血及血凝块,显示其具体分布范围,并可指导再次手术。
本组患者中既往有上腹部手术史者18例,其中6例术后并发肝周大量积血,统计学分析提示上腹部手术史是术后肝周大量积血的独立危险因素(单因素:P=0.001;多因素:P=0.008),考虑原因可能是既往上腹部手术导致腹腔内粘连,术中分离创面大,分离面广泛渗血,加之肝移植患者肝脏储备功能差,凝血因子合成能力较弱,如果合并脾功能亢进则常伴有血小板大量破坏,往往难以彻底止血。术后创面继续渗血亦可引起血小板、凝血因子等成分大量消耗,进一步加重出血;部分积血形成血凝块,分隔包裹,不易引出,进而形成肝周大量积血。
胆漏也是肝移植术后的常见并发症之一,其发生率为1%~25%[7]。本组105例患者中有5例发生术后胆漏(发生率4.8%),其中3例出现肝周大量积血。单因素和多因素分析均显示术后胆漏与肝周大量积血相关,考虑其原因可能是漏出的胆汁对血管断端(尤其是细小血管或毛细血管丛)具有腐蚀性,可溶解血痂或导致结扎线脱落,引起出血;当出血量不大时即表现为渗血,经历一段时间后最终导致肝周大量积血或血凝块形成,伴发腹腔内感染。胆漏发生的原因很多,首先是肝移植手术本身对胆管血供的破坏,肝外胆管的血供主要来自于肝动脉(主要是右肝动脉)、胆囊动脉、胃十二指肠动脉,移植术中胆道吻合后,血供主要来自于吻合后的肝动脉,其周围的血管网受到不同程度的破坏;其次为胆管滋养血管内血栓形成,例如,廖毅等[8]研究显示,供者术前如未能全身肝素化,易导致肝动脉滋养胆管的小分支发生微血栓;再次为移植后的排斥反应,可影响胆管吻合口的愈合[9]。
本组9例术后肝周大量积血患者的肝功能均受到不同程度的损伤,主要表现为总胆红素水平的再次升高(7例)或停止下降(2例)及丙氨酸转氨酶水平的再次升高(7例)。肝功能受损主要是由胆管受压或毒素吸收所致,本组中1例出现肝内胆管显著扩张、肝门胆管狭窄的影像学表现。虽然术后9例患者中仅1例体温轻度升高,但有6例肝周积血或血凝块细菌培养显示有致病细菌生长,表明由于肝移植术中及术后应用了大剂量的免疫抑制剂,体温正常可能是“假象”,腹腔内感染是客观存在的。研究中部分患者的全血白细胞总数及中性粒细胞比例出现迅速反跳,表现为“类白反应”:白细胞总数在2~4 d内升高到>30×109/L(3例),其中1例达到53.3×109/L,其表现与其他感染表现差别明显,其白细胞升高速度越快,总胆红素上升速度亦越快。
肝移植术后肝周大量积血可导致肝功能损伤、胆管狭窄、腹腔内感染等并发症,甚至可能会导致移植失败,因此要防止术后肝周大量积血的产生。术中应仔细分离粘连部位,严密止血,尽可能避免分离面的渗血,辨清胆管滋养血管并加以合理保护,同时保证胆管吻合确切以减少胆漏的发生。此外,对于有上腹部手术史或认为术中肝门部渗血可能性大的患者,可适当延长引流管放置时间。
肝周大量积血一旦产生,患者往往会出现皮肤、巩膜黄染再次加重,总胆红素及丙氨酸转氨酶水平再次升高,以及类白反应等特征性临床表现。肝移植术后患者如果出现以上临床表现,需要考虑肝周大量积血的可能。此时可以通过B超、CT、MRI等影像学手段明确诊断,诊断明确后经内科保守治疗肝功能及血常规无好转迹象者,需要果断采取外科治疗措施。少量、局限性的肝周积血可以行B超引导下穿刺引流术;而肝周积血分布范围较广或以血凝块为主时,则需要再次手术清除积血及血凝块。及时清除肝周积血和血凝块可以阻断其进一步导致严重并发症的进程,是有效的治疗手段。此外,术后还需要根据积血或血凝块的细菌培养及药敏结果选用敏感抗生素,进一步巩固治疗效果,避免腹腔内感染。
| [1] | 郑树森, 俞军, 张武. 肝移植在中国的发展现状[J]. 临床肝胆病杂志, 2014, 30: 2–4. DOI: 10.3969/j.issn.1001-5256.2014.01.001 |
| [2] | 张胜, 周杰, 谭永法, 谭凯. 肝移植术后腹腔大出血的相关因素分析[J]. 广东医学, 2012, 33: 770–772. DOI: 10.3969/j.issn.1001-9448.2012.06.019 |
| [3] | 李江斌, 杜锡林, 董瑞, 阴继凯, 鲁建国. 肝移植相关心血管并发症的发生与防治[J]. 临床肝胆病杂志, 2014, 30: 75–77. DOI: 10.3969/j.issn.1001-5256.2014.01.022 |
| [4] | 范鹏飞. 活体肝移植术后胆道并发症相关危险因素的研究[J]. 天津医药, 2012, 40: 1155–1156. DOI: 10.3969/j.issn.0253-9896.2012.11.020 |
| [5] | 邓永林, 沈中阳. 不同类型肝移植术后免疫抑制方案应用策略[J]. 中国中西医结合急救杂志, 2014, 21: 194–197. DOI: 10.3969/j.issn.1008-9691.2014.03.009 |
| [6] | 王永刚, 吴金术, 蒋波, 刘初平, 彭创, 田秉璋. 原位肝移植后的严重腹腔感染[J]. 中国组织工程研究, 2013, 17: 7703–7708. DOI: 10.3969/j.issn.2095-4344.2013.44.008 |
| [7] | 周尊强, 周光文. 肝移植术后胆道并发症的病因及防治研究进展[J]. 器官移植, 2013, 4: 373–376. DOI: 10.3969/j.issn.1674-7445.2013.06.016 |
| [8] | 廖毅, 张启瑜, 虞冠锋, 吴存造, 孙贤斌, 郑少玲. 24例不置T管胆总管对端吻合式肝移植术后胆道并发症的病因分析[J]. 肝胆胰外科杂志, 2007, 19: 12–14. DOI: 10.3969/j.issn.1007-1954.2007.01.005 |
| [9] | WOJCIEKI M, MILKIEWICZ P, SILVA M. Biliary tract complications after liver transplantation:a review[J]. Dig Surg, 2008, 25: 245–257. DOI: 10.1159/000144653 |
 2017, Vol. 38
2017, Vol. 38