舌鳞状细胞癌(tongue squamous cell carcinoma, TSCC)是口腔癌中发病率最高的恶性肿瘤之一,具有恶性程度高、浸润性生长及早期发生颈淋巴结转移的特点。大量研究表明,缺氧微环境可以促进肿瘤细胞的增殖、凋亡、侵袭、转移和血管生成等[1-3],而TSCC与肿瘤干细胞中多种分子的异常调节机制密切相关。作为肿瘤干细胞的转录因子,SOX2 (SRY-like HMG box 2) 和OCT4(octamer binding factor 4) 在干细胞构建及生物学特性方面具有重要作用,两者可以作为共同的干性基因参与恶性肿瘤的发生和转移[4-5]。因此,以SOX2和OCT4为生物学标志物来监测TSCC的发生、侵袭,以及评估肿瘤的预后及治疗效果具有一定的应用前景。本研究选取化学药物去铁胺(desferrioxamine, DFO)为模拟低氧物,研究低氧状态下舌鳞癌SCC-15细胞系中SOX2和OCT4的表达情况,初步探讨干细胞转录因子SOX2和OCT4在TSCC的预后评估中的应用价值。
1 材料和方法 1.1 细胞与试剂人口腔舌鳞癌SCC-15细胞株由首都医科大学附属北京口腔医院馈赠。无支原体胎牛血清、青霉素/链霉素、胰蛋白酶、乙二胺四乙酸(EDTA)、DFO、焦碳酸乙二酯(DEPC)购自美国Sigma公司;CCK-8试剂盒购自江苏凯基生物技术股份有限公司;PrimeScriptTM反转录试剂盒、Premix Ex Taq Ⅱ(Tli RNaseH Plus)购自日本TaKaRa公司;TRIzol试剂购自美国Invitrogen公司。
1.2 细胞培养与分组SCC-15细胞培养于含有10%胎牛血清的α-MEM(美国Gibco公司)低糖培养液中,置于37 ℃、5%CO2的饱和湿度培养箱中培养,每隔1 d冲洗换液1次,细胞传代2次。待细胞生长至培养皿的70%时取对数生长期SCC-15细胞,用于后续实验。实验分为2组,常氧组细胞不加DFO,模拟低氧组每孔加入100 μmol/L DFO 100 μL,每组设5个复孔。
1.3 CCK-8法检测细胞的增殖情况取处于对数生长期的SCC-15细胞,0.25%胰酶消化后使用完全培养液重悬成细胞悬液,1 000 r/min (离心半径5 cm)离心5 min后重悬于α-MEM低糖培养液中,用血球计数板计数细胞,配制成细胞密度为2×104/mL的单细胞悬液。将细胞悬液加入96孔板中,调整细胞密度为2×103/孔,置37 ℃、5% CO2培养箱继续培养。在加药后24、48、72、96、120 h时行CCK-8检测。检测前每孔加入10 μL CCK-8液,避光放置4 h后振荡器振荡10 min,用酶标仪(450 nm)检测各孔的光密度(D)值。实验重复3次取平均值,绘制细胞生长曲线。
1.4 细胞周期分析细胞培养24 h后,消化收集DFO处理过的SCC-15细胞,PBS洗涤细胞,2 000 r/min(离心半径5 cm)离心5 min,并调整细胞密度为1×106/mL;制备的单细胞悬液用体积分数为70%乙醇固定12 h,4 ℃保存,染色前1 000 r/min (离心半径5 cm)离心5 min,弃去固定液,PBS清洗3次,重悬于200 μL PBS中。加入1 mg/mL的RNase 100 μL,37 ℃水浴30 min;再加入400 μL PI染色混匀,4 ℃避光30 min后上流式细胞仪检测并分析结果。
1.5 细胞凋亡分析用不含EDTA的胰酶消化后,2 000 r/min (离心半径5 cm)、4 ℃离心5 min收集细胞;用预冷的PBS洗涤细胞2次,2 000 r/min (离心半径5 cm)、4 ℃离心5 min。收集(1~5)×105细胞,加入100 μL 1×结合缓冲液重悬细胞, 然后加入5 μL Annexin Ⅴ-EGFP和5 μL PI,轻轻混匀,避光、室温反应10 min,上流式细胞仪(flow cytometry, FCM)检测,记录并分析激发波长为488 nm时的红色荧光。
1.6 蛋白质印迹法检测SCC-15细胞中低氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)、SOX2、OCT4蛋白的表达收集SCC-15细胞, 加入DFO药物作用24 h,用预冷PBS冲洗2次,然后加入50 μL细胞裂解液,振荡器震荡数次,充分裂解后在冰上放置20 min, 离心半径5 cm、12 000 r/min离心5 min, 收集上清液行定量分析。取已定量的总蛋白行12%SDS-PAGE,电转移至硝酸纤维素膜上,放入5% BSA室温封闭过夜。取出膜,于摇床上用TBST洗膜5 min×3次,每次10 min, 加入TBST稀释的HIF-1α(Boster公司,1:200)、OCT4(Abcam公司,1:1 000) 或SOX2 (Abcam公司,1:1 000),4 ℃孵育过夜。TBST洗膜5 min×3次,加入辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jackson公司,1:2 000) 和HRP标记的羊抗小鼠二抗(Jackson公司,1:2 000) 室温孵育2 h。TBST洗膜10 min×3次。将膜置于化学发光检测试剂(试剂A:试剂B=1:1) 中反应2 min,取出膜,甩去多余液体,保鲜膜包好后在暗室中用X线胶片感光、显影、定影,凝胶分析系统分析蛋白的表达。
1.7 qRT-PCR检测HIF-1α、SOX2、OCT4 mRNA的表达取未加药和加药24 h后的细胞,按照TRIzol试剂说明书要求提取细胞总RNA,按照反转录试剂盒说明书要求采用特异性下游引物法反转录生成cDNA。HIF-1α上游引物:5′-CAC CAC AGG ACA GTA CAG GAT-3′, 下游引物:5′-CGT GCT GAA TAA TAC CAC TCA CA-3′;SOX2上游引物:5′-TGG ACA GTT ACG CGC ACA T-3′,下游引物:5′-CGA GTA GGA CAT GCT GTA GGT-3′; OCT4上游引物:5′-CTG GGT TGA TCC TCG GAC CT-3′, 下游引物:5′-CCA TCG GAG TTG CTC TCC A-3′;管家基因GAPDH上游引物:5′-GAT GCC CCC ATG TTC GTC AT-3′,下游引物:5′-TCT TCT GGG TGG CAG TGA TG-3′。PCR反应条件为95 ℃预变性60 s; 95 ℃ 30 s、54 ℃ 45 s、72 ℃ 60 s,共30个循环;72 ℃延伸10 min。检测HIF-1α、SOX2、OCT4的扩增效率,实验重复3次取均值。采用2-ΔΔCt法计算各mRNA的相对表达量。
1.8 统计学处理应用SPSS 19.0软件进行数据处理,所有计量数据以x±s表示,组间差异比较采用单因素方差分析(one-way ANOVA)检验。组间比较采用Student’s t检验。检验水准(α)为0.05。
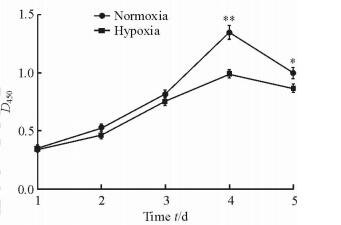
2 结果 2.1 模拟低氧对SCC-15细胞增殖的影响应用CCK-8法检测两组细胞在常氧和模拟低氧状态下的细胞增殖率。结果发现,常氧状态下细胞的增殖率随着时间推移而逐渐增高,在第4天时达到最高;而模拟低氧状态抑制了细胞的增殖率,在DFO处理后第4~5天,模拟低氧组细胞增殖率均低于常氧组,差异有统计学意义(P < 0.05,P < 0.01;图 1)。
|
图 1 常氧和模拟低氧条件下SCC-15细胞的增殖曲线 Fig 1 Proliferation of SCC-15 cells in normoxia and hypoxia groups *P < 0.05, **P < 0.01 vs hypoxia group. n=3, x±s |
2.2 模拟低氧对SCC-15细胞周期变化的影响
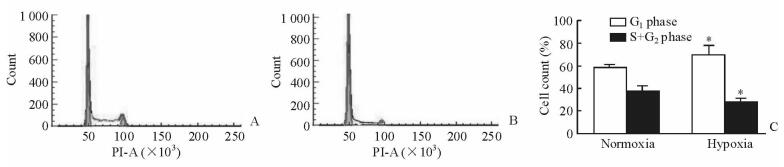
应用流式细胞仪观察两组SCC-15细胞的细胞周期变化。结果显示,加药培养24 h后,与常氧组相比,模拟低氧组SCC-15细胞周期的再分布发生变化,G1期细胞所占比例上升[(70.28±2.56)% vs (58.19±1.86)%)],S+G2期细胞所占比例下降[(28.37±1.23)% vs (37.16±1.36)%)],差异有统计学意义(P < 0.05)。表明低氧阻滞了细胞G1期,使S+G2期细胞占比降低(图 2)。
|
图 2 常氧和模拟低氧条件下SCC-15细胞的周期变化 Fig 2 Cell cycle of SCC-15 cells in normoxia and hypoxia groups A: Normoxia group; B: Hypoxia group; C: Statistical chart of the SCC-15 cells proportion in G1 phase and S+G2 phase. PI: Propidium iodide. *P < 0.05 vs normoxia group. n=3, x±s |
2.3 模拟低氧对SCC-15细胞凋亡的影响
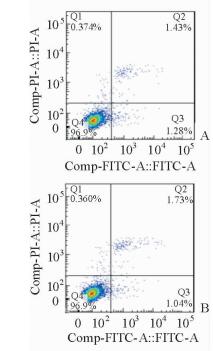
培养24 h后,常氧组与模拟低氧组中SCC-15细胞的凋亡率差异无统计学意义(P > 0.05,图 3)。
|
图 3 常氧(A)和模拟低氧(B)条件下SCC-15细胞的凋亡情况 Fig 3 Apoptosis rate of SCC-15 cells in normoxia (A) and hypoxia (B) groups PI: Propidium iodide; FITC: Flurescein isothiocyanate |
2.4 模拟低氧条件下SCC-15细胞中HIF-1α、SOX2、OCT4蛋白的表达变化
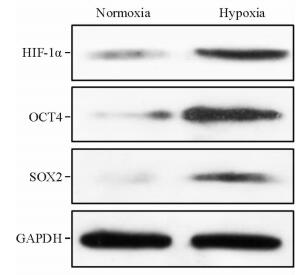
蛋白质印迹法检测结果显示,加药作用24 h后与常氧组比较,模拟低氧组SCC-15细胞中HIF-1α、SOX2、OCT4蛋白的表达均升高,且HIF-1α(0.383±0.003)、OCT4(0.603±0.003) 蛋白的升高幅度大于SOX2(0.228±0.003) 蛋白,差异有统计学意义(P < 0.05,P < 0.01;图 4)。
|
图 4 常氧和模拟低氧条件下SCC-15细胞中HIF-1α、SOX2及OCT4的蛋白表达 Fig 4 Expressions of HIF-1α, SOX2 and OCT4 of SCC-15 cells in normoxia and hypoxia groups HIF-1α: Hypoxia-inducible factor 1α; SOX2: Sry-like hmg box-2; OCT4: Octamer binding factor-4 |
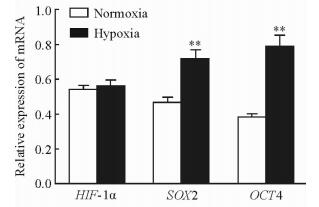
2.5 模拟低氧条件下SCC-15细胞中HIF-1α、SOX2、OCT4 mRNA的表达变化
qRT-PCR结果显示,加药作用24 h后常氧组与模拟低氧组SCC-15细胞中HIF-1α mRNA的表达水平差异无统计学意义(P > 0.05),而模拟低氧组SOX2、OCT4 mRNA的表达水平均高于常氧组(P < 0.01,图 5)。
|
图 5 常氧和低氧条件下SCC-15细胞中HIF-1α、SOX2及OCT4 mRNA表达 Fig 5 Expressions of HIF-1α, SOX2 and OCT4 mRNA of SCC-15 cells in normoxia and hypoxia groups HIF-1α: Hypoxia-inducible factor 1α; SOX2: Sry-like hmg box-2; OCT4: Octamer binding factor-4. **P < 0.01 vs normoxia group. n=3, x±s |
3 讨论
低氧在实体肿瘤中普遍存在,低氧环境为肿瘤呈现其恶性表型创造了所必需的条件,被认为是肿瘤进展及预后差的独立因素。研究表明低氧具有调控癌细胞分化的能力,可通过促进肿瘤干细胞生成和表观遗传修饰增强肿瘤恶性潜能[6]。低氧诱导的信号通路主要由HIF-1α调节,HIF-1α在细胞生长、分化、迁移、血管生成及能量代谢等方面均发挥重要作用[7]。DFO作为模拟低氧物可有效模拟细胞低氧微环境,并且对细胞的生物学特性无不良作用,在细胞实验中广泛使用[8]。在低氧微环境中,肿瘤组织的新生血管紊乱、血液供应能力下降、氧气消耗增加,肿瘤细胞的生物学功能产生了重要变化[9]。低氧的相关作用机制主要表现为促进肿瘤新生血管生成、抑制肿瘤细胞凋亡、影响细胞周期、促进肿瘤侵袭和远处转移等[10-11]。本实验使用DFO模拟低氧环境,检测低氧条件下舌鳞癌SCC-15细胞的生物学行为及相关因子的表达情况,为HIF-1α用于TSCC治疗进一步提供理论基础。
本实验分别使用qRT-PCR和蛋白质印迹法检测HIF-1α mRNA和蛋白的表达情况,从而确定DFO的低氧模拟效果,结果发现使用DFO模拟低氧后,HIF-1α蛋白的表达升高,但其mRNA的表达未见显著变化,提示DFO可能是通过抑制HIF-1α在蛋白水平的降解来模拟低氧。细胞的增殖、周期及凋亡是评价细胞生物学行为的重要指标,本实验使用CCK-8法检测细胞的增殖情况,流式细胞仪检测细胞的周期及凋亡情况。结果发现模拟低氧组SCC-15细胞的增殖率低于常氧组,说明低氧抑制了细胞的增殖能力。此外,低氧条件下G1期细胞所占比例上升,S+G2期细胞所占比例下降,表明低氧引起了G1期细胞的阻滞,导致S+G2期细胞占比下降。相比常氧条件,在24 h的低氧条件下舌鳞癌SCC-15细胞的凋亡未见明显增加。上述发现与Zhou等[12]的研究结果一致。
SOX2和OCT4作为干细胞的转录因子,在维持细胞自我更新和多向分化过程中具有决定性作用。恶性肿瘤的发生、发展与SOX2及OCT4关系密切。研究发现,在多种实体恶性肿瘤细胞中,SOX2和OCT4均高度表达,且OCT4与SOX2可以联合应用作为预后判断指标,其表达程度越高,肿瘤恶性程度越高[13-16]。Chiou等[17]报道在口腔鳞癌中OCT4的高表达与患者的预后成反比,即OCT4表达越高,预后越差。本研究发现低氧条件下HIF-1α、SOX2、OCT4蛋白的表达均升高,而且HIF-1α、OCT4蛋白的升高幅度大于SOX2蛋白,可能与其恶性程度增高密切相关。作为TSCC肿瘤的载体,舌体组织的血管系统非常丰富,血管内皮生长因子(vascular endothelial growth factor,VEGF)在促进内皮细胞分裂、增殖和提高血管通透性方面具有重要作用。本课题组前期研究发现,HIF-1α介导上调VEGF mRNA和蛋白的水平[18],即低氧促进TSCC中VEGF的高表达,调控TSCC的血管生成,进而促进TSCC的发展,但其是否和干细胞转录因子SOX2和OCT4相关,还有待进一步证实。
口腔癌的发生和发展与肿瘤低氧微环境密切相关[19]。低氧促进SOX2和OCT4的高表达,进而影响癌细胞的自我更新和分化潜能,导致在生物学特性上具有更高的恶性程度。胡鑫[20]研究发现SOX2和OCT4在维持肿瘤干细胞增殖过程中具有重要作用,使用RNA干扰SOX2和OCT4可以抑制肿瘤干细胞富集的胃癌细胞的增殖,其凋亡亦可受到影响,但确切的生物学分子机制还有待进一步明确。
综上,本研究表明TSCC中干细胞转录因子SOX2和OCT4在低氧微环境中可高表达;抑制HIF-1α在蛋白水平的降解可以抑制干细胞增殖,同时SOX2和OCT4的作用也可能受到影响。目前,尚未有大量文献报道干细胞转录因子SOX2和OCT4在TSCC中的高表达与TSCC临床病例分期、分化程度及预后生存率方面的相关性。SOX2和OCT4的阳性表达是否也可以作为TSCC患者预后的标志,还需要更有力的证据支持。
| [1] | ELLIS L M, HICKLIN D J. VEGF-targeted therapy:mechanisms of anti-tumour activity[J]. Nat Rev Cancer, 2008, 8: 579–591. DOI: 10.1038/nrc2403 |
| [2] | QIANG L, WU T, ZHANG H W, LU N, HU R, WANG Y J, et al. HIF-1a is critical for hypoxia-mediated maintenance of glioblastoma stem cells by activating Notch signaling pathway[J]. Cell Death Differ, 2012, 19: 284–294. DOI: 10.1038/cdd.2011.95 |
| [3] | WICKRAMASINGHE N S, BANERJEE K, NAGARAJ N S, VIGNESWARAN N, ZACHARIAS W. Hypoxia alters cathepsin B/inhibitor profiles in oral carcinoma cell lines[J]. Anticancer Res, 2005, 25: 2841–2849. |
| [4] | CHUANG W Y, CHANG Y S, CHAO Y K, YEH C J, LIU Y H, TSENG C K, et al. High sex determining region Y-box 2(SOX2) expression correlates with absence of nodal metastasis in esophageal squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2015, 8: 9248–9255. |
| [5] | BOTQUIN V, HESS H, FUHRMANN G, ANASTASSIADIS C, GROSS M K, VRIEND G, et al. New POU dimer configuration enhancer by Oct-4 and Sox-2[J]. Genes Dev, 1998, 12: 2073–2090. DOI: 10.1101/gad.12.13.2073 |
| [6] | BRAHIMI HORN M C, BELLOT G, POUYSSEGUR J. Hypoxia and energetic tumor metabolism[J]. Curr Opin Genet Dev, 2010, 21: 67–72. |
| [7] | FRAGA A, RIBEIRO R, MEDEIROS R. Tumor hypoxia:the role of HIF[J]. Actas Urol Esp, 2009, 33: 941–951. DOI: 10.1016/S0210-4806(09)72891-8 |
| [8] | HIRSILA M, KOIVUNEN P, XU L, SEELEY T, KIVIRIKKO K I, MYLLYHARJU J, et al. Effect of desferrioxamine and metals on the hydroxylases in the oxygen sensing pathway[J]. FASEB J, 2005, 10: 1308–1310. |
| [9] | TREDAN O, GALMARINI C M, PATEL K, TANNOCK I F. Drug resistance and the solid tumor microenvironment[J]. J Nat Cancer Inst, 2007, 99: 1441–1454. DOI: 10.1093/jnci/djm135 |
| [10] | CHAN D A, GIACCIA A J. Hypoxia, gene expression, and metastasis[J]. Cancer Metastasis Rev, 2007, 26: 333–339. DOI: 10.1007/s10555-007-9063-1 |
| [11] | MELILLO G. Targeting hypoxia cell signaling for cancer therapy[J]. Cancer Metastasis Rev, 2007, 26: 341–352. DOI: 10.1007/s10555-007-9059-x |
| [12] | ZHOU X, HUANG D, XUE Z, XU X, WANG K, SUN Y, et al. Effect of HIF-1α on biological activation of human tongue squamous cell carcinoma SCC-15 cells in vitro[J]. Int J Oncol, 2015, 46: 2346–2354. |
| [13] | SHOLL L M, LONG K B, HORNICK J L. Sox2 expression in pulmonary non-small cell and neuroendoerin ecarcinomas[J]. Appl Immunohistochem Mol Morphol, 2010, 18: 55–61. DOI: 10.1097/PAI.0b013e3181b16b88 |
| [14] | GANGEMI R M, GRIFFERO F, MARUBBI D, PERERA M, CAPRA M C, MALATESTA P, et al. Sox2 silencing in glioblastoma tumor-initiating cells causes stop of proliferation and loss of tumorigenicity[J]. Stem Cells, 2009, 27: 40–48. DOI: 10.1634/stemcells.2008-0493 |
| [15] | CHEN Y C, HSU H S, CHEN Y W, TSAI T H, HOW C K, WANG C Y, et al. Oct-4 expression maintained cancer stem like propeaies in lung cancer-derived CD133-positive cells[J/OL]. PLoS One, 2008, 3:e2637. doi:10.1371/journal.pone.0002637. |
| [16] | GE N, LIN H X, XIAO X S, GUO L, XU H M, WANG X, et al. Prognostic significance of Oct4 and Sox2 expression in hypopharyngeal squamous cell carcinoma[J]. J Trnsl Med, 2010, 8: 94. DOI: 10.1186/1479-5876-8-94 |
| [17] | CHIOU S H, YU C C, HUANG C Y, LIN S C, LIU C J, TSAI T H, et al. Positive correlations of Oct4 and Nanog in oral cancer stem like cells and high-grade oral squamous cell carcinoma[J]. Clin Cancer Res, 2008, 14: 4085–4095. DOI: 10.1158/1078-0432.CCR-07-4404 |
| [18] | 闵睿, 康非吾, 王开, 吴湣, 朱炎. 低氧诱导下Tca8113细胞HIF-1α与VEGF的表达及血管生成相关性研究[J]. 口腔颌面外科杂志, 2009, 4: 234–238. DOI: 10.3969/j.issn.1005-4979.2009.04.003 |
| [19] | RYU M H, PARK H M, CHUNG J, LEE C H, PARK H R. Hypoxia-inducible factor-1alpha mediates oral squamous cell carcinoma invasion via upregulation of alpha5 integrin and fibronectin[J]. Biochem and Biophys Res Commun, 2010, 393: 11–15. DOI: 10.1016/j.bbrc.2010.01.060 |
| [20] | 胡鑫. siRNA干扰转录因子SOX2和OCT4对胃癌干细胞增殖的影响[D]. 大连: 大连医科大学, 2011. |
 2017, Vol. 38
2017, Vol. 38


