胃癌是我国最常见的恶性肿瘤之一,居消化系统恶性肿瘤之首,胃癌的早期发现与治疗对改善患者预后至关重要。近年来,随着内镜器械及技术的快速发展,越来越多的胃黏膜病变被早期发现,其中内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已成为早期胃黏膜病变的主要治疗手段。
ESD是由内镜下黏膜切除术(endoscopic mucosal resection,EMR)演化而来的微创技术,具有创伤小、恢复快、切除率高、并发症少、手术费用低等优点,但相比EMR其难度更高,手术时间和风险大大增加,并且其难度直接受病变特点影响。2012年10月至2014年8月在第二军医大学长海医院消化内镜中心接受ESD治疗的早期胃黏膜病变患者共214例,均取得了较好的治疗效果。现报告如下。
1 资料和方法 1.1 一般资料2012年10月至2014年8月在第二军医大学长海医院消化内镜中心接受ESD治疗的早期胃癌或癌前病变患者共214例,其中男性150例、女性64例;年龄32~86岁,平均(61.6±10.6) 岁。所有患者在术前均签署知情同意书。研究经第二军医大学长海医院伦理委员会审批通过。
1.2 手术器械与试剂Olympus GIF-Q260J内镜。靛胭脂(南京微创医学科技股份有限公司)、甘油果糖氯化钠注射液(辰欣药业股份有限公司)。ESD附件:注射针(NM-4L-1,Olympus)、Dual刀(KD-650L,Olympus)、IT刀(KD-611L,Olympus)、透明帽(D-201-11804,Olympus)、电凝钳(FD-410LR,Olympus)、止血夹(HX-610-090L, HX-600-135L;Olympus)、高频电发生器(VIO 200D,ERBE)、CO2气泵(UCR,Olympus)。
1.3 治疗方法病灶周围标记:在距病变边缘5 mm处进行环形标记。黏膜下注射:使病灶充分抬举,对于部分病灶抬举不佳者应重新评估ESD治疗的可行性。环形切开黏膜:切开过程应于标记点外侧进行,以防病灶残留。黏膜下剥离:充分利用透明帽保持黏膜层与固有肌层分开以进行剥离,术中对于较粗的血管需使用电凝钳预处理,以防严重出血影响视野及严重并发症的发生。创面处理:对可能存在出血的残留血管行常规电凝处理,对较大的血管残端及固有肌层损伤部位行止血夹处理。
1.4 标本处理切除后的标本用生理盐水冲洗干净后通过细针展平并固定于平板上,标示病灶口侧端及肛侧端,记录病灶大小。将固定的标本浸泡于10%甲醛溶液(标本与溶液的比例为1:10) 中,送病理检查。
1.5 术后处理及随访术后第1天禁食,监测患者血压、脉搏、呼吸等生命体征,观察腹部体征,进行必要的实验室和影像学检查,如临床表现及相关检查无异常,术后第2天可进流食。对于存在穿孔的患者需严格禁食5 d。ESD治疗后第3、6、12个月定期随访,行内镜及相关检查。无残留病灶、复发者此后每年随访1次;有残留病灶或复发者根据具体情况再次行内镜检查或追加外科手术切除,后每3个月随访1次。
1.6 统计学处理采用SPSS 21.0软件进行数据处理。计量资料以x±s表示,计数资料以率表示。病灶大小及手术时间等计量资料比较采用单因素方差分析,计数资料比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 术前评估214例患者术前接受内镜窄带成像(narrow band imaging,NBI)检查者67例(31.3%),NBI联合放大内镜(magnifying endoscopy,ME)检查者39例(18.2%),超声内镜(endoscopic ultrasonography,EUS)检查者50例(23.4%),CT检查者50例(23.4%),术前活组织检查者192例(89.7%)。依据术后病理,病灶局限于黏膜层者187例,其中术前接受NBI检查者56例(29.9%)、NBI联合ME检查者34例(18.2%)、EUS检查者42例(22.5%)、CT检查者42例(22.5%)、术前活组织检查者169例(90.4%);病灶累及黏膜下层者27例,其中术前接受NBI检查者11例(40.7%)、NBI联合ME检查者5例(18.5%)、EUS检查者8例(29.6%)、CT检查者8例(29.6%)、术前活组织检查者23例(85.2%)。
2.2 病灶特征214例患者中,病灶位于贲门者46例(21.5%);位于胃底者2例(0.9%);位于胃体者38例(17.8%),其中胃体大弯4例(1.9%)、胃体小弯20例(9.3%)、胃体前壁11例(5.1%)、胃体后壁3例(1.4%);位于胃角者49例(22.9%);位于胃窦者79例(36.9%),其中胃窦大弯16例(7.5%)、胃窦小弯16例(7.5%)、胃窦前壁29例(13.6%)、胃窦后壁18例(8.4%)。病灶分布以胃窦最多、胃角次之、胃底最少,胃体病变以小弯居多,胃窦病变以前壁居多。
214例病灶长径最小值为1 cm,最大值为12 cm,平均(4.48±1.65) cm;病灶面积最小值为1 cm2,最大值为96 cm2,平均(17.58±13.69) cm2。贲门与胃底、胃窦、胃角、胃体等不同部位病灶长径分别为(4.36±1.14)、(4.20±1.83)、(4.67±1.60)、(4.96±1.79) cm,病灶面积分别为(14.93±7.47)、(15.81±13.39)、(19.81±14.67)、(21.74±17.63) cm2。不同病变部位的病灶长径及病灶面积差异均无统计学意义(P > 0.05)。
2.3 手术情况214例患者均顺利完成ESD治疗,其中104例(48.6%)患者采用了气管插管静脉麻醉,无麻醉相关意外发生。病灶切除时间为14~290 min,平均为(59.9±49.6) min;胃窦病变的平均切除时间短于胃体[(47.5±36.2) min vs (79.5±70.4) min,P < 0.05],其他各部位间差异均无统计学意义;黏膜内病变的平均切除时间短于累及黏膜下层的病变[(57.6±48.8) min vs (75.8±53.2) min,P < 0.05],其他各不同深度病变间差异均无统计学意义。
术中有2例(0.9%)患者发生大出血,均在内镜下成功止血;2例(0.9%)发生穿孔,均在病变切除后及时止血夹夹闭;未发生气腹、腹腔感染等其他术中严重并发症。术后5例(2.3%)患者发生延迟性出血,其中4例发生在术后12 h内,1例发生在术后2周,主要表现为呕血、黑便,均在内镜下成功止血;无1例发生术后延迟性穿孔; 术后随访发现5例(2.3%)患者复发,复发时间分别为第6、12、12、27、33个月,均接受了第2次ESD治疗。
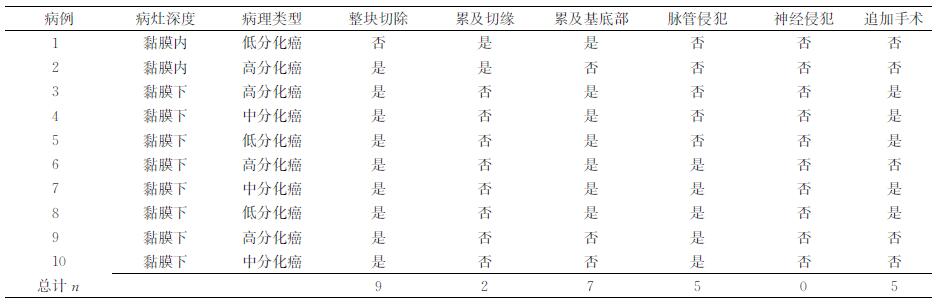
依据术后病理判断,214例病灶中有206例为整块切除,整块切除率为96.3%;8例分块切除病灶中有1例为R1切除(镜下见切缘有癌细胞)。206例整块切除病灶中197例为完整切除,完整切除率为92.1%;9例为R1切除。214例病灶的病理类型分别为低级别上皮内瘤变84例(39.2%)、高级别上皮内瘤变55例(25.7%)、高分化癌45例(21.0%)、中分化癌19例(8.9%)、低分化癌11例(5.1%)。在所有10例R1切除病灶中,癌细胞累及切缘者2例、累及基底部者7例、脉管侵犯者5例;5例在ESD后追加了外科手术,其余结合内镜治疗情况及个人意愿选择定期内镜随访(表 1)。
|
|
表 1 10例R1切除病灶的术后处理 |
3 讨论
ESD是一项难度较大的微创手术,对内镜医师的操作技能有很高的要求,并且手术难度也受病灶部位、大小、深度等多种因素的影响[1]。本研究中214例患者的病变分布部位以胃窦最多,其余依次为胃角、贲门与胃底、胃体。不同病变部位的病灶大小差异无统计学意义,但对比不同病变部位的手术时间发现,胃体病变的病灶平均切除时间长于胃窦病变,提示胃体病变手术难度高于胃窦。此外,累及黏膜下层病变部位的病灶平均切除时间长于黏膜内病变,提示病变越深,手术难度越大。
与EMR等内镜下治疗技术相比,ESD虽然具有整块切除率高、切除范围广等优势,但其技术要求更高、操作时间更长,容易导致出血、穿孔等并发症的发生[2-3]。精细的内镜操作及对较大血管的预处理是防止术中大出血发生的有效方法,但ESD术中仍会发生不可预料的难治性出血,本研究中有2例(0.9%)患者发生术中大出血,发生率与国外报道(1.8%~3.6%)相似[4]。一般情况下,ESD术中出血只要处理及时,均可在内镜下成功止血,否则要终止内镜治疗转外科处理,以免造成严重后果。穿孔也是ESD术中的严重并发症之一,发生率约为1%~7%[5]。ESD术中穿孔一般都能及时发现,只要具备良好的内镜操作经验,应用止血夹即可有效夹闭穿孔。本研究中有2例(0.9%)患者发生术中穿孔,均在术中及时发现并以止血夹夹闭创面,未出现气腹及腹腔感染等严重并发症。术中及时控制出血点、剥离过程中充分黏膜下注射、透明帽保持视野均有利于防止术中穿孔。
术后延迟性出血是ESD较为常见的术后并发症,其发生与患者的基础状况、病灶大小、操作时间、操作者经验、创面处理等多种因素有关,国外报道胃ESD术后延迟性出血的发生率为4.1%[6]。本研究中有5例患者发生术后延迟性出血,发生率为2.3%,其中4例发生在术后12 h内、1例发生在术后2周。延迟性出血一旦发生应在急诊内镜下行止血治疗;如仍不能控制,则需数字减影血管造影(DSA)或外科手术治疗。本研究中出现的5例术后延迟性出血因发现及时,均在内镜下成功止血,无严重情况发生。为预防术后延迟性出血的发生,在病灶完整剥离后应仔细检查创面,对裸露的血管残端及存在出血风险的血管进行处理。术后给予患者口服质子泵抑制剂(proton pump inhibitor,PPI)也是降低术后延迟性出血发生率的有效方法[7-9],本研究中所有患者在ESD术后均接受了2个月的PPI强化治疗。有研究认为,相对于单用PPI,PPI联合胃黏膜保护剂对治疗术后溃疡及降低术后延迟性出血发生率更有效[10]。术后延迟性穿孔是另一种报道较多的ESD术后并发症,其发生率约为0.1%~0.45%[11-12],但本研究中214例患者无1例发生术后延迟性穿孔。有研究认为患者的血糖水平、妊娠及ESD术中固有肌层损伤是术后延迟性穿孔的危险因素[13]。本研究认为创面处理是预防术后延迟性穿孔的关键因素之一,应详细检查创面范围内固有肌层的损伤情况,对于存在固有肌层损伤的部位以止血夹夹闭,术后严格禁食、抑酸、抗炎治疗。
ESD术后病理是为预后判断及诊疗决策提供依据的基石。本研究中214例病变的术后病理包括高级别上皮内瘤变、低级别上皮内瘤变、高分化癌、中分化癌、低分化癌。对于诊断为癌的病变应仔细评估其水平切缘及基底部情况,对于水平切缘有累及的病灶应扩大切除范围,对于基底部有累及的病灶应考虑是否追加外科手术,但常规病理难以判断病灶黏膜下浸润深度,因此应结合内镜治疗情况、术后病理及患者意愿等因素综合决策。本研究中有5例患者因病灶癌细胞累及基底部而追加了外科手术;1例分块切除的病变虽提示病灶累及切缘及基底部,但因难以准确判断外科手术的必要性,最终患者选择了定期随访,术后24个月的内镜随访未发现残留病灶及复发病灶;1例切缘见高级别上皮内瘤变的患者经内镜医师判断后选择了定期随访,术后24个月复查无异常;2例切缘阴性但病理提示脉管累及的患者最终选择了定期随访,在术后18、24个月的内镜及CT随访中均未发现异常病灶。有1例癌细胞累及基底部且存在脉管受累的患者(病理类型为高分化癌)拒绝进一步外科治疗,术后36个月的内镜随访未发现残留病灶。因此,内镜医师对术后病理的解读应结合内镜治疗情况综合判断,对于浸润较深、分化差的高危患者应选择进一步的手术治疗;对于判断困难或拒绝外科治疗的患者则可采取严密的内镜随访,监测病灶变化[14-15]。
目前,ESD的快速发展与广泛应用已经使早期胃黏膜病变的治疗模式由以外科手术为主转变为以内镜治疗为主,极大地改善了患者的预后及术后生活质量。ESD已成为内镜治疗技术的典型代表,但临床上开展ESD仍然存在较多问题,例如早期病变的内镜诊疗存在“重治疗、轻诊断”的偏倚现象,导致ESD的适应证把握不严格,甚至出现过度ESD治疗的现象。本研究中,尽管患者术前病理大多提示为重度不典型增生,但经术后病理证实为低级别上皮内瘤变的比例为39.3%。术前、术后病理结果的差异可能与不同单位病理科的诊断差异有关,也可能与病变异型程度的部位差异有关,但已充分说明术前精确评估存在不足。本研究结果显示ESD术前行NBI、NBI联合ME、EUS、CT检查的比例均较低,分别为31.3%、18.2%、23.4%、23.4%;而术后证实累及黏膜下层的病变行术前NBI、NBI联合ME、EUS、CT评估的比例分别为40.7%、18.5%、29.6%、29.6%。术前评估不准确容易导致两种不必要的ESD:一是良性病变的过度ESD治疗,二是部分浸润较深病变ESD术后追加外科手术治疗。因此,应进一步加强、完善ESD术前评估,对于术前活组织检查提示异型增生、上皮内瘤变或癌的病灶,应进行ME及EUS检查以确定病灶深度和范围,对于浸润较深的病灶则需行增强CT扫描进一步评估病变周围情况,从而制定出合理的治疗与随访方案,尽量避免不必要的、不应该的ESD治疗,降低患者的创伤与经济负担[16-17]。
综上所述,ESD治疗早期胃癌及癌前病变是安全可靠的,但应进行细致、完善的术前评估;术后病理是判断预后及诊疗决策的关键,应根据病变浸润深度、异型程度做出科学严密的治疗及随访计划。
| [1] | MURATA A, OKAMOTO K, MURAMATSU K, MATSUDA S. Endoscopic submucosal dissection for gastric cancer:the influence of hospital volume on complications and length of stay[J]. Surg Endosc, 2014, 28: 1298–1306. DOI: 10.1007/s00464-013-3326-4 |
| [2] | FACCIORUSSO A, ANTONINO M, DI MASO M, DI MASO M, MUSCATIELLO N. Endoscopic submucosal dissection vs endoscopic mucosal resection for early gastric cancer:a meta-analysis[J]. World J Gastrointest Endosc, 2014, 6: 555–563. DOI: 10.4253/wjge.v6.i11.555 |
| [3] | SAITO I, TSUJI Y, SAKAGUCHI Y, NIIMI K, ONO S, KODASHIMA S, et al. Complications related to gastric endoscopic submucosal dissection and their managements[J]. Clin Endosc, 2014, 47: 398–403. DOI: 10.5946/ce.2014.47.5.398 |
| [4] | TOYONAGA T, MAN-I M, EAST J E, NISHINO E, ONO W, HIROOKA T, et al. 1, 635 endoscopic submucosal dissection cases in the esophagus, stomach, and colorectum:complication rates and long-term outcomes[J]. Surg Endosc, 2013, 27: 1000–1008. DOI: 10.1007/s00464-012-2555-2 |
| [5] | FUJISHIRO M, YAHAGI N, KAKUSHIMA N, KODASHIMA S, MURAKI Y, ONO S, et al. Outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms in 200 consecutive cases[J]. Clin Gastroenterol Hepatol, 2007, 5: 678–683. DOI: 10.1016/j.cgh.2007.01.006 |
| [6] | NA S, AHN J Y, CHOI K D, KIM M Y, LEE J H, CHOI K S, et al. Delayed bleeding rate according to the forrest classification in second-look endoscopy after endoscopic submucosal dissection[J]. Dig Dis Sci, 2015, 60: 3108–3117. DOI: 10.1007/s10620-015-3693-x |
| [7] | PARK C H, LEE S K. Preventing and controlling bleeding in gastric endoscopic submucosal dissection[J]. Clin Endosc, 2013, 46: 456–462. DOI: 10.5946/ce.2013.46.5.456 |
| [8] | ONO S, KATO M, ONO Y, NAKAGAWA M, NAKAGAWA S, SHIMIZU Y, et al. Effects of preoperative administration of omeprazole on bleeding after endoscopic submucosal dissection:a prospective randomized controlled trial[J]. Endoscopy, 2009, 41: 299–303. DOI: 10.1055/s-0029-1214530 |
| [9] | LEE S H, LEE C K, CHUNG I K, SHIM Y S, LEE T H, LEE S H, et al. Optimal duration of proton pump inhibitor in the treatment of endoscopic submucosal dissection-induced ulcers:a retrospective analysis and prospective validation study[J]. Dig Dis Sci, 2012, 57: 429–434. DOI: 10.1007/s10620-011-1941-2 |
| [10] | TAKAYAMA M, MATSUI S, KAWASAKI M, ASAKUMA Y, SAKURAI T, KASHIDA H, et al. Efficacy of treatment with rebamipide for endoscopic submucosal dissection-induced ulcers[J]. World J Gastroenterol, 2013, 19: 5706–5712. DOI: 10.3748/wjg.v19.i34.5706 |
| [11] | SUZUKI H, ODA I, SEKIGUCHI M, ABE S, NONAKA S, YOSHINAGA S, et al. Management and associated factors of delayed perforation after gastric endoscopic submucosal dissection[J]. World J Gastroenterol, 2015, 21: 12635–12643. DOI: 10.3748/wjg.v21.i44.12635 |
| [12] | KANG S H, LEE K, LEE H W, PARK G E, HONG Y S, MIN B H. Delayed perforation occurring after endoscopic submucosal dissection for early gastric cancer[J]. Clin Endosc, 2015, 48: 251–255. DOI: 10.5946/ce.2015.48.3.251 |
| [13] | KAKUSHIMA N, FUJISHIRO M. Endoscopic submucosal dissection forgastrointestinal neoplasms[J]. World J Gastroenterol, 2008, 14: 2962–2967. DOI: 10.3748/wjg.14.2962 |
| [14] | KIM D Y, HONG S J, CHO G S, JEONG G A, KIM H K, HAN J P, et al. Long-term efficacy of endoscopic submucosal dissection compared with surgery for early gastric cancer:a retrospective cohort study[J]. Gut Liver, 2014, 8: 519–525. DOI: 10.5009/gnl13061 |
| [15] | CHOI J H, KIM E S, LEE Y J, CHO K B, PARK K S, JANG B K, et al. Comparison of quality of life and worry of cancer recurrence between endoscopic and surgical treatment for early gastric cancer[J]. Gastrointest Endosc, 2015, 82: 299–307. DOI: 10.1016/j.gie.2015.01.019 |
| [16] | NONAKA K, NISHIMURA M, KITA H. Role of narrow band imaging in endoscopic submucosal dissection[J]. World J Gastrointest Endosc, 2012, 4: 387–397. DOI: 10.4253/wjge.v4.i9.387 |
| [17] | LEE M W, KIM G H, I H, PARK D Y, BAEK D H, LEE B E, et al. Predicting the invasion depth of esophageal squamous cell carcinoma:comparison of endoscopic ultrasonography and magnifying endoscopy[J]. Scand J Gastroenterol, 2014, 49: 853–861. |
 2017, Vol. 38
2017, Vol. 38