2. 徐州市中心医院创伤科, 徐州 221009
2. Department of Trauma, Xuzhou Central Hospital, Xuzhou 221009, Jiangsu, China
随着人口老龄化程度加重,股骨粗隆间骨折已经成为一个普遍且严重影响健康的问题。防旋转股骨近端髓内钉(proximal femoral nail antirotation, PFNA)是目前临床应用最普遍的手术治疗方法,其可以降低植入物并发症,并且能够提供角度稳定和旋转稳定性,对于严重骨质疏松和不稳定型老年高风险股骨粗隆间骨折患者而言更为有利[1-2]。临床上,外科医师往往因为PFNA手术时间短、手术创伤小、术中显性失血量少等因素忽略了患者的围手术期隐性失血[3-4]。目前的相关研究在样本量、数据处理、研究方法上没有明确不同骨折分型对于PFNA术后隐性失血的影响。本研究分析了接受PFNA手术的不同AO分型的股骨粗隆间骨折患者的资料,旨在探讨围手术期不同分型患者隐性失血量的差异。
1 资料和方法 1.1 一般资料根据纳入及排除标准收集2013年3月至2016年3月间于徐州市中心医院创伤科采取PFNA治疗的股骨粗隆间骨折患者的病例资料,共48例,其中男21例、女27例;年龄35~93岁,平均(70.6±13.7) 岁;身高1.53~1.86 m,平均(1.66±0.137) m;体质量指数20.3~26.0 kg/m2,平均(23.4±1.5) kg/m2。致伤原因:摔伤22例,交通事故伤17例,高处坠落伤9例。美国麻醉医师协会(ASA)分级:Ⅰ级18例,Ⅱ级17例,Ⅲ级10例,Ⅳ级3例。受伤至手术时间1~7 d,平均(4.2±2.1) d。手术时间40~104 min,平均(60.5±12.1) min。骨折按AO分型,A1、A2、A3型各16例。麻醉方式全部采用全麻。
纳入标准:(1) 明确诊断为新鲜单侧、初次骨折患者;(2) 伤前6个月内无抗凝药物、抗血小板药物服用史,且术前检查凝血功能、肝功能正常;(3) 无消化道溃疡及出血病史,无血液系统疾病等慢性疾病史;(4) 手术均采用牵引床闭合复位,由同一名医生按照标准手术操作规范进行PFNA内固定治疗;(5) 有准确的身高、体质量信息;(6) 术前及术后1、3、5、7 d均有血常规检查;(7) 围手术期患者各项生命体征平稳;(8) 手术当日24 h内补液量小于2 000 mL。排除标准:(1) 年龄小于18岁;(2) 多发骨折或多发伤,病理性骨折;(3) 慢性贫血病史;(4) 术后出现肉眼血尿、血便;(5) 未采用PFNA标准手术操作;(6) 合并有严重的先天免疫系统疾病、内科疾病。
1.2 检测指标将所有患者按照AO分型分为A1、A2、A3组。比较每组患者手术前后的血红蛋白量(Hb)和红细胞比容(HCT)。应用Gross方程[5],使用围手术期平均HCT计算红细胞容量和围手术期失血量。如果输血,1单位浓缩红细胞相当于200 mL标准红细胞容量,实际出血量需加上这部分输血量。(1) 总血红细胞丢失量=术前血容量(PBV)×(术前HCT-术后HCT)。(2) PBV=k1×h3+k2×w+k3 (h:身高; w:体质量)。k为常数,男:k1=0.366 9,k2=0.032 19,k3=0. 604 1;女:k1=0. 356 1,k2=0. 033 08,k3=0.183 3。(3) 理论失血总量=总血红细胞丢失量/术前HCT。(4) 围手术期实际失血量=隐性失血量+显性失血量=根据手术前后HCT变化计算的理论失血总量+输血量。
1.3 围手术期处理按照PFNA标准操作流程,记录从切皮开始到切口缝合完毕的手术时间及术中失血量。术后统一放置引流管,记录每日引流量,并在引流量<50 mL/d时予以拔除。术前、术后即刻及术后第1、3、5、7天常规复查血常规,对Hb<80 g/L的患者给予输血,术后第3天复查血常规作为最终测量的Hb和HCT。
1.4 统计学处理应用SPSS 20.0软件进行数据分析,两组患者的一般资料和失血量比较采用独立样本t检验,率的比较采用χ2检验。检验水准(α)为0.05。
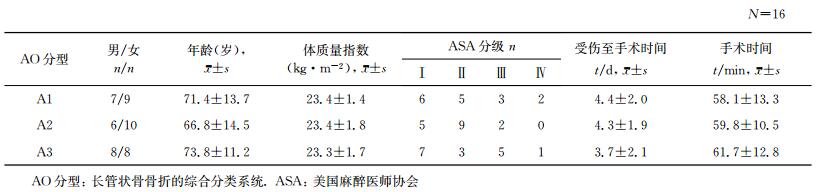
2 结果 2.1 一般资料比较3组患者的性别、年龄、体质量指数、ASA分级、受伤至手术时间、手术时间的差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 3组患者一般资料比较 |
2.2 各组间失血量比较
由表 2可见,3组患者的术中失血量及术后失血量差异均无统计学意义(P>0.05)。而在总失血量及隐性失血量方面,A3组高于A1及A2组(P < 0.05),且A2组患者的隐性失血量高于A1组,差异有统计学意义(P < 0.05)。A1、A2、A3组患者隐性失血量占总失血量的比例分别为81.8%、85.9%、84.9%,3组间差异无统计学意义(P>0.05)。
|
|
表 2 3组患者的失血量比较 |
2.3 各组间输血情况比较
3组患者术后异体血输血率分别为A1型:18.8%(3/16);A2型:31.2%(5/16)、A3型:56.2%(9/16);A1、A2、A3组患者术后异体血输血量分别为(240.3±26.5)、(374.1±37.9)、(488.5±56.4) mL。A3组的异体血输血量和输血率均高于A1、A2组,A2组的异体血输血量和输血率均高于A1组(P<0.05)。
3 讨论股骨粗隆间骨折是一种干骺端骨折,局部丰富的血运、髓腔和肌肉空隙增加了隐性失血的可能。目前围手术期隐性失血的原因和机制尚不明确。Jung等[6]认为隐性失血的原因是手术切口的血液从血管中溢出,进入肌间隔组织,导致Hb水平的降低。Smith等[7]研究认为, 不稳定型股骨粗隆间骨折隐性失血较稳定型骨折明显增多,主要原因是严重粉碎的骨折导致更多的游离脂肪酸、术中的髓内脂肪和骨折碎片进入血液循环,加剧毛细血管床的开放。也有研究认为复杂的股骨粗隆间骨折隐性失血量大,是由于骨折创伤时大量的髓内出血和应激性胃肠道出血[8]。我们在临床诊治中应该重视围手术期隐性失血量,个体化评估总失血量,加强围手术期的监护,及时纠正贫血,防止深静脉血栓形成和加强患肢的功能锻炼。
本研究分析了不同AO分型的股骨粗隆间骨折患者围手术期的隐性失血情况,发现术中失血量、术后失血量在A1、A2、A3型患者间差异无统计学意义(P>0.05),排除了应对不同类型骨折时,外科医师手术操作对围手术期总失血量的影响。A3型骨折患者的隐性失血量和总失血量均高于A1、A2型患者(P<0.05),这可能是因为严重粉碎的骨折类型的手术操作时间相对较长,受伤和手术时经历的创伤更为严重,加剧了毛细血管床的开放,使更多的血液进入肌间隔。而且3组患者的隐性失血量占总失血量的比例都在80%以上,说明了隐性失血在围手术期的重要性。而且更多的隐性失血量也使得不稳定骨折患者的异体血输血量和输血率明显增加,增加了输血相关风险。
近年来股骨粗隆间骨折多进行手术治疗,因此无法获得保守治疗和手术治疗患者的隐性失血量的数据资料,缺乏保守治疗和手术治疗对隐性失血量的比较的临床研究,不能排除手术对隐性失血量造成的影响。目前缺乏评估围手术期失血量的统一标准及分析因素的局限性也是本研究的不足之处。本研究证实了股骨粗隆间骨折患者围手术期大量隐性失血的存在,复杂的骨折隐性失血问题更加突出,值得外科医师关注。
| [1] | LI J, CHENG L, JING J. The Asia proximal femoral nail antirotation versus the standard proximal femoral antirotation nail for unstable intertrochanteric fractures in elderly Chinese patients[J]. Orthop Traumatol Surg Res, 2015, 101: 143–146. DOI: 10.1016/j.otsr.2014.12.011 |
| [2] | SADIC S, CUSTOVIC S, JASAREVIC M, FAZLIC M, SMAJIC N, HRUSTIC A, et al. Proximal femoral nail antirotation in treatment of fractures of proximal femur[J]. Med Arch, 2014, 68: 173–177. DOI: 10.5455/medarh. |
| [3] | TANG P, HU F, SHEN J, ZHANG L, ZHANG L. Proximal femoral nail antirotation versus hemiarthroplasty:a study for the treatment of intertrochanteric fractures[J]. Injury, 2012, 43: 876–881. DOI: 10.1016/j.injury.2011.11.008 |
| [4] | MA J, XING D, MA X, XU W, WANG J, CHEN Y, et al. The percutaneous compression plate versus the dynamic hip screw for treatment of intertrochanteric hip fractures:a systematic review and meta-analysis of comparative studies[J]. Orthop Traumatol Surg Res, 2012, 98: 773–783. DOI: 10.1016/j.otsr.2012.07.004 |
| [5] | GROSS J B. Estimating allowable blood loss:corrected for dilution[J]. Anesthesiology, 1983, 58: 277–280. DOI: 10.1097/00000542-198303000-00016 |
| [6] | JUNG W H, CHUN C W, LEE J H, HA J H, KIM J H, JEONG J H. No difference in total blood loss, haemoglobin and haematocrit between continues and intermittent wound drainage after total knee arthroplasty[J]. Knee Surg Sports Traumatol Arthrosc, 2013, 21: 2831–2836. DOI: 10.1007/s00167-012-2253-6 |
| [7] | SMITH G H, TSANG J, MOLYNEUX S G, WHITE T O. The hidden blood loss after hip fracture[J]. Injury, 2011, 42: 133–135. DOI: 10.1016/j.injury.2010.02.015 |
| [8] | FOSS N B, KEHLET H. Hidden blood loss after surgery for hip fracture[J]. J Bone Joint Surg Br, 2006, 88: 1053–1059. |
 2017, Vol. 38
2017, Vol. 38