甲状腺结节是临床上常见的疾病,近年来,随着甲状腺结节经皮微波或射频消融治疗的创新研究与发展应用,消融治疗在临床上取得了肯定的效果[1-2]。对于消融后疗效的影像评价,已有学者利用弹性超声探讨研究[3],但一般是进行消融前与消融后即刻的对比,鲜有关于后续随访的报道。本研究拟分析运用弹性成像评价经皮射频消融治疗人体甲状腺良性结节的可行性及动态随访治疗后病灶质地的变化情况,总结实际操作经验,为甲状腺射频消融的长期疗效的评估提供新的客观影像依据。
1 资料和方法 1.1 研究对象入选对象为2011年5月至2013年8月在第二军医大学长海医院超声科接受射频消融治疗的21例甲状腺患者,共34枚良性结节(所有结节均经穿刺活检病理诊断证实);男性7例、女性14例,年龄19~75岁,中位年龄45岁。本研究通过第二军医大学长征医院医学伦理委员会审批通过,所有患者均签署知情同意书。入选标准:(1) 结节最大直径在10~20 mm(既满足单次消融即可覆盖整个结节,又便于穿刺活检取材成功);(2) 结节外甲状腺组织无弥漫性疾病,以避免基础疾病导致的靶区弹性变化的异常;(3) 所有结节均为实性,排除囊性和囊实性病灶。
1.2 仪器与设备采用CelonLab ENT射频消融仪(德国Celon AG医疗仪器公司),脚踏启动,消融功率5 W;与之匹配的电极为CelonProBreath单针双极式消融电极,直径1.1 mm,射频工作段长度1 cm。采用Preirus弹性超声诊断仪(日本Hitachi公司),探头频率5~13 MHz,对目标区域进行弹性成像。
1.3 设定感应器区域由于热消融治疗时温度从针道中央向边缘处呈梯度性递减,靶区弹性亦呈现梯度性改变的趋势[4]。因此,为了研究甲状腺结节内不同区域的弹性变化,本研究对每个结节设定2个感兴趣区域,即:(1) 中心区为消融针道及其周围邻近约3 mm以内的组织;(2) 边缘区为消融靶区边界内侧约3 mm区域的组织。
1.4 检查方法常规二维超声检查患者消融后的甲状腺,观察甲状腺内消融区域的大小、内部回声、边界及其血供状况。弹性超声可根据弹性成像图的颜色评价组织的弹性或硬度,也可以通过应变率(strain ratio,SR)进行定量比较。本研究所用方法为后者,即获得弹性图像后,以消融靶区同一水平的正常甲状腺组织为参照,测得靶区的SR,先勾画出靶区的轮廓,SR记为A,再勾画出同一层的正常甲状腺组织,两者面积大小基本相同,SR记为B,系统自动计算获得SR比值,即B/A。为尽量减少测量误差,上述过程均由同一位具有熟练操作弹性超声经验的医师完成,于消融后1、3、6、12个月重复检查上述消融靶区的二维及弹性超声,分别测得对应病灶中心区、边缘区的SR。每次重复取样3次计算平均值,将图片结果存储于工作站待分析。
1.5 统计学处理应用SPSS 19.0软件,统计量为各靶区消融后SR的算术均数。对同一靶区测值随时间变化不同的SR分别进行两独立样本t检验。对病灶靶区同时间不同区域(中心区、边缘区)消融后的SR进行两组间双样本等方差假设t检验。检验水准(α)为0.05。
2 结果 2.1 消融后不同时间点同一靶区的弹性成像图特征弹超声性图像(图 1) 显示,所有甲状腺结节消融前以黄、绿色为主,消融后均变为蓝色、深蓝色,而未消融区的色彩与消融前相同或近似,提示消融后靶区弹性降低,质地变硬;同一消融区的SR比值随时间延长而逐渐减小,提示消融区弹性逐渐升高,质地逐渐变软。由表 1可见,相邻各时间点间中心区消融后SR的差异均有统计学意义(P < 0.01);中心区SR减小幅度的变化在1个月至3个月间最小,平均值差为7.65,在6个月至12个月间最大,平均值差为9.91。因边缘区SR在消融后各时间点间的差异均无统计学意义(P > 0.05),可认为边缘区的弹性程度随消融后时间的延长无明显变化。
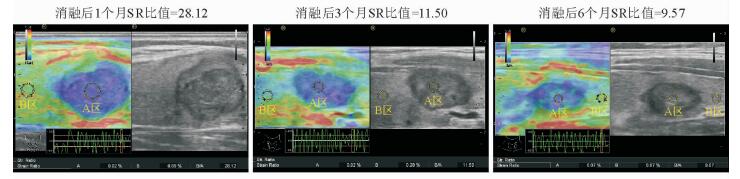
|
图 1 甲状腺良性结节射频消融后不同时间点中心区的弹性成像图 A区:消融靶区;B区:正常组织. SR:应变率 |
|
|
表 1 甲状腺良性结节不同靶区射频消融后不同时间点的SR比较 |
2.2 消融后同一时间点不同靶区(中心区、边缘区)的弹性成像图特征
弹性超声图像(图 2) 显示消融区中心区的颜色以蓝色、深蓝色为主;边缘区的颜色以黄绿色及蓝绿色混合性为主;而未消融区的色彩与消融前相同或近似,提示消融区的弹性由中心向边缘区逐渐升高,质地变软。
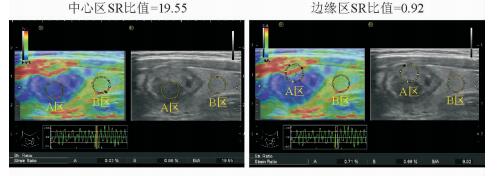
|
图 2 甲状腺良性结节射频消融后1个月不同靶区弹性成像图 A区:消融靶区;B区:正常组织. SR:应变率 |
3 讨论 3.1 射频消融治疗效果的影像评估
超声引导下射频消融治疗肿瘤技术已经广泛应用于肝脏、肾脏、甲状腺、乳腺等部位的良恶性肿瘤的治疗[5-6],其原理是通过射频或微波产生热量,致肿瘤组织发生凝固、坏死,具有定位准确、对周围正常组织损伤小、皮肤瘢痕少、恢复快等特点,在临床上取得了良好的效果。目前,前期的临床研究已证实射频消融可因迅速升温而使腺瘤细胞完全灭活[2],但射频消融属于原位消融,消融后病灶仍存留体内,患者难免会因此产生担心疑惑心理,比起消融后病灶被吞噬、吸收、消散的微观病理基础,直观的图像更具说服力。为了客观评价射频消融的疗效,学者们[7-9]分别利用超声造影、三维容积成像、弹性成像等超声新技术从消融后病灶的血供、体积及质地等不同方面评估,获得了较好的成效,为临床提供了可靠的影像数据,也证实了射频消融是一种安全有效的治疗甲状腺结节的方法。但在甲状腺结节射频消融治疗中,弹性超声多用来比较消融前与消融后即刻病灶的质地变化[3],虽证实了消融后病灶硬度增大,但对其后续的变化趋势却鲜有报道,因此本研究着手探讨射频消融后甲状腺结节随时间延长不同时间点的弹性(或硬度)变化趋势。
3.2 弹性成像的特点组织弹性因内部成分及其结构的区别而不尽相同,实时弹性超声成像可获取生物组织弹性信息、可直观的影像显示和定量计测组织的硬度。随着弹性设备的改良更新和临床技能的不断成熟,弹性超声成像已广泛应用于临床。但弹性图像的获得也存在各种影响因素, 如每次施压检测弹性时用力的不均衡、弹性彩色成像评分法完全依赖主观意识进行定量分析等;文献报道利用弹性SR量化组织硬度,可在一定程度上减少因个体差异造成的组织硬度差异的系统误差[10]。章建全等[4]利用弹性超声测得SR评价离体猪肝微波消融后的硬度变化,证实了其可行性,同时也指出消融后靶区硬度不均,应从靶区整体与局部多层次入手解析其弹性变化。因此本研究将消融靶区分为中心区和边缘区两部分对比分析,且通过1个月至1年的动态随访,观察SR的变化情况,旨在获得相对较准确的结果。
3.3 射频消融对甲状腺结节弹性的影响本研究显示,在彩色弹性图像上甲状腺结节靶区的色彩由消融前的黄绿色、绿色变成消融后的蓝色、深蓝色,表明射频消融致甲状腺结节弹性降低,质地变硬,推测其原因是因射频消融后靶区细胞凝固坏死、组织结构明显脱水而致组织变硬、丧失弹性,这与文献报道的微波消融致离体猪肝组织弹性降低的现象[11]一致;观察1个月至1年时间内的4次随访,中心区SR由26.95逐渐减小至3.38,表明靶区弹性随时间延长而逐渐升高,质地变软,理论上可解释为:射频消融导致靶区组织凝固坏死,随后机体产生免疫反应,大量吞噬细胞作用于坏死区,使其得以吸收,促使其内结构逐渐恢复,进而与周围正常组织相似,但这一推测仍需患者配合穿刺获得靶区组织病理来证实;而靶区边缘部分SR随时间延长差异无统计学意义,这一现象可能的解释为能量衰减效应,即射频消融仪发射的能量由中心向周边逐渐衰减,至消融边缘区已降到最低,与周边正常组织相似。另本研究还发现每一随访时间点靶区中心区域与边缘区域的SR均存在差异,表明甲状腺结节射频消融后由中心向外周弹性逐渐升高,质地硬度逐渐降低,这一结果与文献报道的离体猪肝微波消融后组织的弹性变化趋势相符[4]。
经皮射频消融治疗甲状腺结节具有定位准、创伤小、灭活完全、甲状腺功能受损小、颈部无瘢痕等优点,已逐渐被越来越多的患者选择[12]。经过学者们多年的探索实践,如今射频消融不仅可用于治疗甲状腺良性肿瘤,其在乳头状甲状腺癌和甲状腺癌术后颈部淋巴结转移灶的治疗方面也取得了良好的应用效果,此项技术逐步获得普遍认同,亦已步入广泛普及的上升通道[13]。
但不同于外科手术,射频消融属于原位消融,消融病灶仍存在体内,加之甲状腺属浅表器官,射频消融后组织变硬的程度很容易被患者本人感触,随之而来的可能是患者对硬变的不解以及何时能够变软的焦虑。因此,我们希望运用弹性超声测得组织SR反映甲状腺消融后病灶的弹性变化,缓解患者的焦虑心理。本研究发现弹性超声能够反映组织消融后弹性的改变,且表现为随时间延长弹性逐渐升高的趋势,对射频消融技术的发展有较好的指导作用和参考价值。
| [1] | 章建全, 马娜, 徐斌, 刘灿, 宋家琳, 刁宗平. 超声引导监测下经皮射频消融甲状腺腺瘤的方法学研究[J]. 中华超声影像学杂志, 2010, 19: 861–865. DOI: 10.3760/cma.j.issn.1004-4477.2010.10.011 |
| [2] |
王淑荣, 章建全, 徐庆玲, 于守君, 张永林, 王锡菊, 等. 甲状腺结节性病变经皮热消融治疗的近期疗效评价[J]. 第二军医大学学报, 2011, 12: 1316–1320.
WANG S R, ZHANG J Q, XU Q L, YU S J, ZHANG Y L, WANG X J, et al. Percutaneous thermal ablation for nodular thyroid diseases:an assessment of short-term effects[J]. Acad J Sec Mil Med Univ, 2011, 12: 1316–1320. |
| [3] | 纪莉, 吴凤林, 娄雪峰, 张世玉. 超声弹性成像评估甲状腺良性结节射频消融效果的价值探讨[J]. 中国超声医学杂志, 2014, 30: 1071–1073. |
| [4] | 章建全, 刁宗平, 卢峰, 盛建国. 离体猪肝微波消融区的弹性梯度与温度梯度研究[J]. 中华超声影像学杂志, 2012, 21: 799–802. DOI: 10.3760/cma.j.issn.1004-4477.2012.09.020 |
| [5] |
潘倩, 章建全, 赵璐璐, 张航. 甲状腺腺瘤与肝海绵状血管瘤同期联合微波消融治疗的初步尝试[J]. 第二军医大学学报, 2015, 36: 573–576.
PAN Q, ZHANG J Q, ZHAO L L, ZHANG H. Microwave ablation for simultaneous treatment of thyroid adenoma and liver cavernous hemangioma:a preliminary experience[J]. Acad J Sec Mil Med Univ, 2015, 36: 573–576. |
| [6] |
章建全, 仇明, 盛建国, 卢峰, 赵璐璐, 张航, 等. 超声引导下经皮穿刺热消融治疗甲状旁腺结节[J]. 第二军医大学学报, 2013, 34: 362–370.
ZHANG J Q, QIU M, SHENG J G, LU F, ZHAO L L, ZHANG H, et al. Ultrasound-guided percutaneous thermal ablation for benign parathyroid nodules[J]. Acad J Sec Mil Med Univ, 2013, 34: 362–370. |
| [7] | JEONG W K, BAEK J H, RHIM H, KIM Y S, KWAK M S, JEONG H J, et a1. Radiofrequency ablation of benign thyroid nodules:safety and imaging follow-up in 236 patients[J]. Eur Radiol, 2008, 18: 1244–1250. DOI: 10.1007/s00330-008-0880-6 |
| [8] | BAEK J H, KIM Y S, LEE D, HUH J Y, LEE J H. Benign predominantly solid thyroid nodules:prospective study of efficacy of sonographically guided radiofrequency ablation versus control condition[J]. AJR Am J Roentgenol, 2010, 94: 1137–1142. |
| [9] | MELONI M F, ANDREANO A, ZIMBARO F, LAVA M, LAZZARONI S, SIRONI S. Contrast enhanced ultrasound:roles in immediate post-procedural and 24 h evaluation of the effectiveness of thermal ablation of liver tumors[J]. J Ultrasound, 2012, 15: 207–214. DOI: 10.1016/j.jus.2012.09.001 |
| [10] | 安秀艳, 丛淑珍, 钱隽, 郭玉萍, 周立峰, 梁婷. 超声弹性成像应变率中的ROI A值与弹性评分诊断甲状腺结节的价值比较[J]. 南方医科大学学报, 2013, 33: 454–457. DOI: 10.3969/j.issn.1673-4254.2013.03.32 |
| [11] | 章建全, 刁宗平, 卢峰, 盛建国, 何金. 离体猪肝微波消融灶的弹性变化及其病理意义[J]. 中华超声影像学杂志, 2011, 20: 76–79. DOI: 10.3760/cma.j.issn.1004-4477.2011.01.025 |
| [12] |
闫磊, 章建全, 潘倩, 郑建明, 吕艳红. 热消融对甲状腺良性结节组织内HSP70表达的影响[J]. 第二军医大学学报, 2014, 35: 1215–1219.
YAN L, ZHANG J Q, PAN Q, ZHENG J M, LÜ Y H. Effect of thermal ablation on HSP70 expression in benign thyroid nodules[J]. Acad J Sec Mil Med Univ, 2014, 35: 1215–1219. |
| [13] | 章建全. 甲状腺结节微创治疗新理念[J]. 现代实用医学, 2015, 3: 279–282. DOI: 10.3969/j.issn.1671-0800.2015.03.002 |
 2017, Vol. 38
2017, Vol. 38



