虽然恶性肿瘤手术治疗不会引发肿瘤的生物抵抗性和全身不良反应,但对于一些特殊部位的肿瘤如胶质瘤、胰腺癌等,手术治疗风险高而成功率低,且易发生并发症[1-2]。化疗靶向性差,且大多数化疗药物水溶性差,导致临床疗效出现明显的剂量依赖性,各个器官组织发生明显的不良反应[3-4]。另外,肿瘤组织中约1/3的肿瘤细胞对放疗敏感性低,5%~10%的细胞具有乏氧性,20%~50%的细胞处于非增殖期的休止期等,这些肿瘤细胞对射线的低敏感性导致了肿瘤放疗的敏感性低[5]。随着生物技术的发展,生物治疗包括抗体治疗和细胞治疗得到了广泛应用,其具有靶向性好、毒副作用小的优点,但抗体分子作用温和[6-7],瘤内富集较差,治疗效果仍不理想。细胞治疗中的嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)[8-9]给肿瘤患者带来了新的希望,但由于其基因是通过病毒改造而来,低生物安全性限制了进一步的应用。因此,寻找安全性高、特异性强、靶点明确的治疗方法是抗肿瘤治疗研究的焦点。精准医学(precision medicine)的提出为早期肿瘤的精确诊断和精准治疗(precision therapy)提供了方向[10],而基于纳米技术的纳米医药(nanomedicine)可以安全有效地精准递送抗肿瘤药物[11-12],结合精准医学和纳米医药将会为临床抗肿瘤的精准治疗提供可靠方案。本文将结合精准医学的发展、纳米技术和纳米医药在抗肿瘤精准治疗中的优势,阐明精准医学和纳米医药在抗肿瘤精准治疗中的关系和意义。
1 精准医学为抗肿瘤治疗带来新的希望精准医学是根据患者的分子生物病理学特征和各种组学信息(基因组学、蛋白质组学和医学前沿技术)创建一个数据库,通过此数据库辅助和匹配疾病的相关信息进行预防及诊疗,以在临床治疗中获得最大的疗效、最小的毒副作用和更准确的预后判断[13-14]。如美国Javadi教授通过基因检测,结合联合疗法有效治疗了卵巢癌4期患者、胰腺癌患者、晚期肾转移癌患者和晚期食管癌患者[15]。另外,精准医学通过检测每个分子机制的关键生物标志物基因,可以克服肿瘤的耐药问题[16-17],因此基于精准医学治疗方案的提出需要将大数据和个体化医疗有机结合[18]。如美国的一位泌尿系统恶性肿瘤患者,在经过多年常规手术治疗、化疗和放疗后未取得成功,随后康奈尔医学院精准医学研究所对其肿瘤样本的基因序列进行分析,发现肿瘤呈现Her2 (ERBB2) 高表达,为此选择了一种针对Her2突变的靶向治疗药物——曲妥珠单抗(商品名:赫赛汀)治疗而使患者肿瘤得以有效控制[19];另一位乳腺癌患者,其BRCA基因呈阳性表达,通过精准治疗机构进一步基因测序证明该乳腺癌为三阴性,随后通过手术切除成功治愈[20]。基因组测序技术不仅可明确肿瘤患者对某一靶向药物的响应性,也可通过发现新的高频突变基因开发新的抗肿瘤靶向药物,例如,基于一种可导致4%的囊性纤维化的基因突变而开发出ivacaftor(alydeco)药物[21]。
精准医学在肿瘤的精准治疗中充当了“先遣部队和侦察兵”的角色,通过基因组学和蛋白质组学技术,结合各种疾病的大数据,从而精确寻找到发生疾病的原因和治疗靶点,并对一种疾病不同状态和过程进行精确分类分型,为肿瘤诊治和药物筛选提供有效依据。但是随着临床研究的深入,精准医学也面临很多问题:(1) 肿瘤样本的质量差异大,约20%的肿瘤组织样本没有足够的肿瘤细胞用于分析和检测;(2) 虽然肿瘤的基因序列分析可发现突变基因,但基于数据库有限,目前还没有建立一个良好的数据共享机制,导致肿瘤样本的海量基因数据不能得到有效使用;(3) 目前尚未建立一个健康人的数据库作为基础支撑;(4) 更为重要的是,经过复杂和大量筛查工作筛选出的个体化治疗药物,在临床治疗中仍然面临与传统治疗药物相似的毒副作用高以及体内不稳定、如何将其精确定量递送到治疗靶点等系列问题[22]。临床精准治疗中治疗药物对病灶部位的精准靶向递送,有望基于纳米技术的纳米医药完美解决,我们称其为肿瘤精准治疗中的“精准战略轰炸”。
2 纳米技术和纳米药物在抗肿瘤治疗中的优势纳米医药是将纳米技术应用到传统药物获得的新剂型,解决了传统药物分子在治疗中遇到的一系列体内、外问题。纳米医药载体主要有以下优势:(1) 通过高渗透和滞留(enhanced permeability and retention,EPR)效应有效增强药物的肿瘤富集[23];(2) 有效提高药物分子的体内稳定性,增加循环时间;(3) 可实现药物或基因的可控释放,提高和维持血药浓度;(4) 无免疫原性,安全高效;(5) 可有效克服肿瘤耐药问题[24]。目前正在开发的纳米药物有脂质体、共聚物胶束和纳米微粒等。脂质体是目前开发较为成熟的一种具有类细胞膜结构的非病毒纳米载体[25],相关研究显示脂质体进入体内后靶向网状内皮系统,从而改变被包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中蓄积,在一定程度上降低了药物的毒副作用[26]。目前,已经有十余种脂质体药物被美国食品药品管理局(FDA)批准上市,如长循环多柔比星制剂(Doxil®)、紫杉醇(PTX)制剂(Taxol®)及我国国家食品药品监督管理局(CFDA)批准的紫杉醇脂质体制剂等;约有30种脂质体抗肿瘤药物正在临床试验阶段或等待批准上市。但是,从动力学和热力学角度而言,脂质体热力学性质不稳定,而且控释效果不好,所以其作为治疗性纳米载体具有一定的局限性[27]。聚合物胶束是近年来开发的另一种纳米给药系统[28],通过两亲性脂类分子包裹小分子药物,其大小为20~50 nm,相关研究证实聚合物胶束解决了药物溶解度问题,也提高药物的生物利用度、降低机体的排斥反应[29]。杜克大学Bhattacharyya等[30]开发了一种新型靶向制剂,利用重组嵌合型多肽(CP)为载体,CP-PTX纳米粒的瘤内富集效应优于PTX-白蛋白纳米粒。聚乙二醇-聚丙交酯(PEG-PLA)嵌段共聚物因其良好的生物降解性和生物相容性被广泛用作药物传输载体[31],以其为载体的PTX胶束制剂Genexol® -PM于2007年在韩国上市,作为一线药物治疗复发性、转移性乳腺癌,并与顺铂联用治疗非小细胞肺癌。
虽然临床证实基于纳米技术的纳米医药在肿瘤精准治疗中具有非常好的效果,但当前纳米药物的发展进入一个“体外性能优异-体内表现差”的瓶颈期。为了克服这一瓶颈问题,目前大部分研究集中在针对临床问题及肿瘤微环境的特点设计构建新型智能纳米载体。纳米载体的组成、形态结构、大小、粒径分布、“核-壳”结构、表面链密度等均对其体内外性能有很大影响[32-34],纳米医药自身物理化学性能的提高对提升其体内外性能具有决定性的作用。为此,我们率先建立了小分子单体的组成与高分子纳米载体形态结构、负载药物效率、体内外稳定性之间的定量关系[35],有效调节了纳米药物的物理化学性能,增强了对肿瘤的被动靶向能力。另外,通过特异性细胞表面抗原的分子纳米药物(如抗体[36]、配体[37]和凝集素[38]等)可靶向肿瘤细胞,增强纳米药物的瘤内富集。纳米医药在体内的靶向性受到多元化、多层次因素的影响,因此如何解决纳米医药体内的精准靶向及胞内细胞器的靶向等是抗肿瘤精准治疗的关键。
3 基于纳米技术的抗肿瘤精准治疗基于纳米技术的新型靶向纳米药物可有效解决抗肿瘤药物的精准靶向递送问题,有望实现真正意义上从肿瘤分子分型到临床精准治疗[12]。其关键是如何对纳米载体进行设计和裁剪,赋予其主动靶向和被动靶向相结合的特性,从而实现药物的器官靶向、组织靶向、细胞靶向和亚细胞靶向(图 1)。
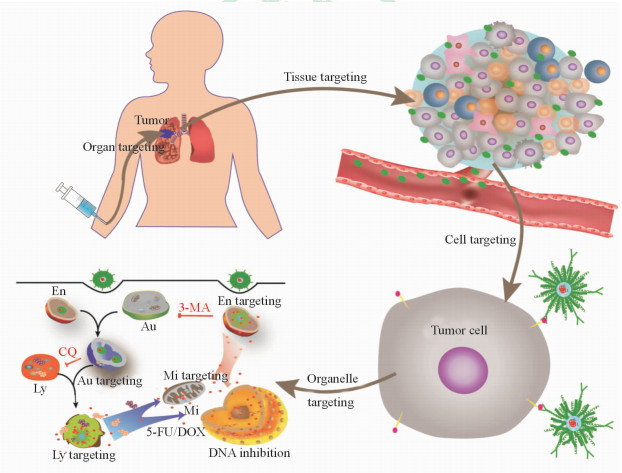
|
图 1 基于纳米技术的抗肿瘤精准治疗示意图 Fig 1 Sketch of precision anti-tumor therapy based on nanomedicine En: Endosome; Au: Autophagosome; Ly: Lysosome; Mi: Mitochondrion; 3-MA: 3-Methyladenine; CQ: Chloroquine; 5-FU: 5-Fluorouracil; DOX: Doxorubicin |
3.1 靶器官的精准递送
血液循环系统是一个动态的、高黏度、高流速、组分复杂的体系[39]。传统的脂质体和共聚物胶束药物的体内稳定性很差[40],利用聚乙二醇对脂质体和共聚物胶束纳米粒子进行表面修饰,增强了其稳定性、延长了体内循环时间、提高了药物的疗效[41]。Vader等[42]基于外泌体、微囊和凋亡小体膜结构的泡囊,将泡囊作为有效的药物运输载体。多糖,包括壳聚糖、透明质酸、葡聚糖及其衍生物具有良好的生物相容性,可降解,毒性低,被广泛用于纳米聚合物的构建[43]。Shaterabadi等[44]通过共沉淀法用葡聚糖对磁流体进行修饰以降低其生物毒性。水凝胶可增强纳米粒子的生物相容性,减少免疫细胞的清除以及组织器官的吸附和堆积[45]。研究表明嵌段共聚物具有很好的生物相容性,大大降低了网状内皮系统(reticulo-endothelial system, RES)的清除能力[46]。然而有研究表明,当纳米粒子处于体内血液的复杂环境时,与介质中的其他蛋白质相互作用形成一层“蛋白冠”,这种“蛋白冠”能掩蔽纳米粒子表面的靶向分子而不被相应受体识别,从而使纳米粒子的特异性消失[47]。如转铁蛋白偶联的纳米粒子会被介质中的蛋白质屏蔽,从而阻止转铁蛋白和细胞膜上或可溶性的转铁蛋白受体结合[48]。为此,基于EPR效应的被动靶向极大地依赖于载体的血清稳定性和粒径、结构等物理化学性质。这提示在今后的靶向修饰中,我们必须考虑载体体系表面靶向分子的密度和桥连键的长度,以更好地利用载体在体内循环时形成的“蛋白冠”。
3.2 靶组织的精准递送解决瘤内富集不足和胞内释放低等问题的关键是从肿瘤组织自身特性出发[49]寻找突破口。与正常组织相比,肿瘤组织有以下3个明显特性:肿瘤组织内部的pH低,pH约为5.0~6.0,远小于正常生理环境的pH≈7.2[50];肿瘤组织内部的温度高于正常生理环境的温度[51];肿瘤组织内部血管内皮细胞分布疏松,间隙约200~700 nm,远大于正常组织的2 nm[52-53]。针对这些特性可以设计温度、pH值、还原性、光热、超声、电荷、应力、抗体、激素、调节因子等不同性质刺激响应性的纳米载体。通过设计一系列智能响应性靶向递送系统,在受到相应的环境刺激时载体可迅速改变构象实现药物在肿瘤组织的特异靶向富集和释放。其中,针对肿瘤微环境中温度略高的特性,设计构建温度敏感型纳米载体,该载体在体液循环时处于稳定状态,保持对药物的装载和结构稳定,当到达肿瘤部位后,由于温度升高载体发生“亲水-疏水”转变,疏水性能的载体被肿瘤组织高浓度截留,实现温敏被动靶向功能,大大增强了药物的瘤内富集[35]。针对肿瘤微环境中呈现酸性的特性,构建pH敏感纳米载体,该载体在体液中循环的时候处于稳定状态,保持对药物的装载和结构稳定,当富集于肿瘤部位后,由于pH值降低载体链发生质子化或电性转变,实现对肿瘤组织的药物输送和富集[54]。另外,研究表明肿瘤组织中存在大量具有较强的还原性的谷胱甘肽,通过制备具有氧化-还原响应性的载体也能够有效实现药物靶向肿瘤组织[55]。
由于人体不同部位的肿瘤对纳米载体的截留很大程度上依赖于载体的粒径大小和病灶部位血管内皮细胞的间隙,因此,可以利用活性聚合,依据自组装理论和技术精细调节和裁剪载体的尺寸,通过肿瘤微环境时以EPR效应实现载体的被动靶向[54-56]。同时,还可通过选用不同的材料赋予纳米载体在肿瘤部位的药物缓释性能,将常规的化疗药物与各种纳米材料相耦合,结合靶向作用实现缓释,提高肿瘤内部药物的有效利用度,以药物的缓释延长药物的治疗窗口期,也可以使治疗部位的药物浓度逐步提高,同时降低毒副作用、减少药物用量、降低治疗费用、提高药物的安全性和有效性[57]。
3.3 靶细胞的精准递送目前可作为主动靶向的配体很多,如多克隆抗体或其功能片段多肽、转铁蛋白、叶酸、核酸适体(aptamer)和多糖等。虽然已有多肽等分子作为药物靶向配体研究成功的报道[58],但目前这些化合物的应用均存在难以克服的缺陷,例如,对纳米药物表面修饰后导致容易团聚,进而影响纳米材料的性能和制备[59]。叶酸、转铁蛋白等配体易于制备,但部分病变细胞没有足够的叶酸受体,而且正常细胞也存在叶酸受体,导致其靶向作用并不理想。所以筛选一个合适的靶向分子需要基因组学和蛋白质组学提供基础。一般肿瘤细胞表面会表达多种特异性抗原,通过抗原-抗体之间的免疫反应引导其趋向靶向组织中的肿瘤细胞,实现载体对肿瘤细胞的特异性靶向结合,从而提高对肿瘤的检测、分子成像、药物追踪等的效率[60]。随着分子生物学技术的发展,多种肿瘤细胞表面高表达的分子标志物被检测和分析。单克隆抗体是近年来研究最多、最具代表性的配体之一,可被连接在纳米载体表面,使纳米载体对肿瘤细胞具有主动靶向性,与靶细胞表面抗原分子有效地特异性结合。目前已上市的抗体药物达63种,在研抗体达617种(IMGT数据库),为纳米药物的应用提供了重要支撑[61]。我们前期将抗体片段连接到纳米载体表面,制备成靶向纳米载体,增强了纳米载体的特异靶向功能,并展现出药物在肿瘤部位更好的富集能力[62]。这预示着纳米载体可以携载多种药物,同时通过在纳米粒子表面修饰靶分子,使其进入患者体内主动靶向富集在肿瘤部位,发挥精准的抗肿瘤作用。因此,抗体与抗原的特异性结合使得抗体已成为纳米药物载体特异靶向分子的首选。例如,原癌基因Her2编码的Her2蛋白是一种具有酪氨酸激酶活性的跨膜糖蛋白,是人表皮生长因子受体(EGFR)家族成员之一。Her2在人类正常细胞不表达或低表达,但在约25%~30%的乳腺癌(SKBr3) 和胃癌(N87) 组织中过度表达[63]。因此,Her2单克隆抗体可作为乳腺癌(SKBr3) 或胃癌(N87) 基因治疗(siRNA)纳米载体的理想主动靶向分子[64]。针对肿瘤特异性高表达的抗原偶联抗体载体表面,是提高智能纳米药物特异性靶向的最有效的主动靶向治疗策略[26]。
肿瘤组织的组成成分非常复杂,除了肿瘤细胞、肿瘤干细胞,还包括成纤维细胞、内皮细胞、周细胞、巨噬细胞、T淋巴细胞、B淋巴细胞以及NK细胞等[65]。如何使环境内的免疫细胞发挥协同抗肿瘤作用是我们开展纳米药物研究的另一项重要内容。为了能够更好地发挥淋巴细胞杀伤肿瘤的能力,我们在纳米颗粒的内部包被免疫激动剂,如IL、IFN和Toll样受体(TLR)等,调节肿瘤免疫微环境,增强免疫细胞对肿瘤的杀伤能力,同时其表面修饰的抗体具有抗体依赖细胞介导的细胞毒性(ADCC)和补体依赖细胞毒性(CDC)功能,可进一步增强抗肿瘤治疗的效果[66]。最新研究报道,通过构建靶向体内T淋巴细胞的纳米载体,将嵌合抗原受体(chimeric antigen receptor, CAR)基因递送到T淋巴细胞内,可在体内实现CAR-T技术[67]。可见,新型靶向智能纳米免疫体系在发挥自身抗肿瘤作用的同时,可通过调节肿瘤免疫微环境、活化免疫细胞,发挥协同抗肿瘤作用,这对精准治疗中纳米药物的细胞靶向探索具有重要参考意义。
3.4 靶细胞器的精准递送多数化疗药物的作用靶点在细胞内,有些药物的靶点在细胞核内,而将药物精准递送到胞内细胞器对精准治疗至关重要,且被输送到胞内细胞器的药物能否被完全释放出来也是纳米药物发挥治疗作用的关键一步[68]。这些精准治疗的发展要求先进的光电等检测手段,并要求载体设计时能够被赋予相关细胞器靶向功能,以达到胞内药物的精准递送、适时释放。通常情况下,纳米粒子通过网格蛋白或网窝蛋白被肿瘤细胞吞噬后形成内涵体,随后形成自噬体,并最终被递送到自噬体和溶酶体[69]。溶酶体是一种由单层膜围绕的囊泡状细胞器,内含60多种酸性水解酶类,其主要功能是对胞内异物和废物(部分核酸、蛋白和多糖等)进行降解。相关研究表明肿瘤细胞中溶酶体酶呈高表达,溶酶体损伤与肿瘤细胞关系密切,为此溶酶体是治疗肿瘤的重要靶细胞器[70]。因此可将携载阳离子破膜分子的纳米载体通过胞吞作用靶向至溶酶体,该载体可被溶酶体酶降解而释放破膜药物,提高抗肿瘤的靶向治疗效果[71]。如果载体携带的是RNA、DNA等,则需要避免纳米粒子进入溶酶体以防降解。例如,通过pH敏感材料设计对内涵体(pH=6) 或自噬体(pH为5~6) 敏感、同时携载RNA和两性霉素B的纳米载体,其在内涵体pH的刺激下可有效释放两性霉素B,进而破坏内涵体膜,把药物(如RNA)释放到胞内[72]。或通过氯喹来抑制自噬体与溶酶体的融合促使纳米药物进入细胞质[73]。
另外,基于线粒体在调控细胞凋亡过程中的重要作用,其已成为当前抗肿瘤研究中的重要靶细胞器。虽然PTX、多柔比星、喜树碱等药物也会作用于线粒体,但其长期使用会引起肿瘤细胞产生耐药性。因此,设计载体同时负载该药物和抑制耐药的分子,这样就可使载体特异靶向线粒体,并可有效抑制耐药性。目前,常用靶向线粒体的分子有多肽、地氯喹铵、罗丹明类、聚羟基丁酸酯和三苯基磷阳离子[74],Durazo等[75]通过功能化纳米技术获得的聚合物能够有效递送药物到线粒体。内质网是合成蛋白质和脂类的重要场所,是由内膜构成的封闭的网状管道系统,Costin等[76]通过pH敏感脂质负载内质网N糖基化抑制剂N-丁基脱氧野尻霉素,成功抑制了小鼠黑素瘤细胞酪氨酸激酶活性,并且减少了药物的给药剂量。Seo等[77]通过构建的纳米药物有效靶向内质网,并通过干扰Ca2+通道有效促进卵巢癌细胞凋亡。这些研究表明,目前实现亚细胞水平的细胞器靶向仍在很大程度上依赖于纳米药物载体的精心设计、精细构建及系统的性能研究。
4 小结与展望综上所述,基于大数据、基因和蛋白测序筛查技术的发展,精准医学在恶性疾病的诊断、筛查和临床用药方面取得了巨大进步,为临床患者个体化治疗提供了技术支持和理论基础。但是,恶性肿瘤是由多基因控制的疾病,基于肿瘤细胞基因的不稳定性,同一患者的肿瘤组织中基因存在随时突变的可能,致使不同部位肿瘤细胞具有异质性。同时,如果没有相当规模的数据库,无法及时发现起主导作用的致癌靶点,也无法精确确定其类型,在用药方面也无法做到真正的精确化和个体化。这些都给肿瘤的精确诊断和药物筛查带来了巨大挑战。
经过复杂和大量筛查工作筛选出的个体化治疗药物,在临床治疗中仍然面临传统治疗中存在的问题,包括毒副作用大、体内药物不稳定、无法精确定量递送到治疗靶点等。而真正的精准医学和精准治疗无法回避,也不能不重视所筛选药物的精准递送问题,这应该是将来个体化治疗要解决的重要问题,而基于纳米技术的纳米医药能够通过器官靶向、组织靶向、细胞靶向和亚细胞靶向有效解决这一难题。
另外,我们认为,针对临床上肿瘤等重大疾病,治疗是围追堵截,能够发挥一定的抑制作用。但是,利用人体自身的免疫功能增强驯化或者平衡因外界因素而病变的细胞和宿主的负向调控因子,即免疫治疗应该是非常有效的手段。肿瘤微环境中存在大量处于失活状态下的免疫细胞,通过有效活化或调节免疫细胞使其恢复功能,进而发挥协同抗肿瘤作用,是未来纳米药物发展的重要方向。“纳米免疫治疗”在提高恶性肿瘤特异性治疗基础上,发展新一代高效、低毒的新型靶向纳米药物(图 2),它的应用将会极大地改善患者的生存状态和生存率,对实现抗肿瘤的精准治疗具有重大意义。
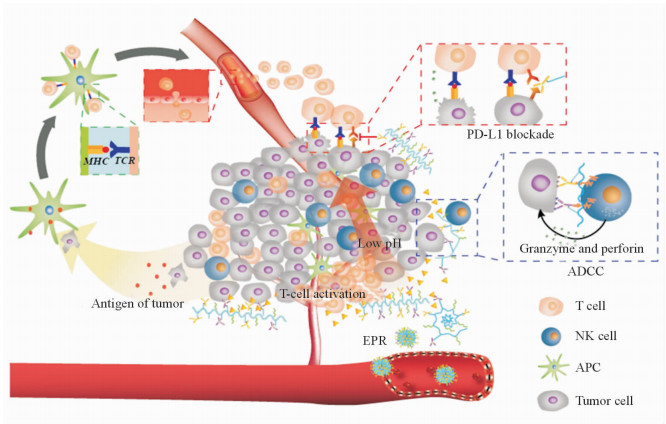
|
图 2 纳米免疫体系在精准治疗中的潜在应用示意图 Fig 2 Potential application of nanoimmunotherapy in precision therapy ADCC: Antibody-dependent cell-mediated cytotoxicity; NK cell: Natural killer cell; APC: Antigen presenting cell; MHC: Major histocompatibility complex; TCR: T cell receptor; PD-L1: Programmed cell death 1 ligand; EPR: Enhanced permeability and retention |
| [1] | LI W, FENG S, GUO Y. Tailoring polymeric micelles to optimize delivery to solid tumors[J]. Nanomedicine (Lond), 2012, 7: 1235–1252. DOI: 10.2217/nnm.12.88 |
| [2] | ARTINYAN A, ORCUTT S T, ANAYA D A, RICHARDSON P, CHEN G J, BERGER D H. Infectious postoperative complications decrease long-term survival in patients undergoing curative surgery for colorectal cancer a study of 12, 075 patients[J]. Ann Surg, 2015, 261: 497–505. DOI: 10.1097/SLA.0000000000000854 |
| [3] | CARROLL J P, PROTANI M M, NGUYEN L, CHENG M M, FAY M, SALEEM M, et al. Toxicity and tolerability of adjuvant breast cancer chemotherapy in obese women[J]. Med Oncol, 2014, 31: 881. DOI: 10.1007/s12032-014-0881-z |
| [4] | GAO J, XIA Y, CHEN H W, YU Y S, SONG J J, LI W, et al. Polymer-lipid hybrid nanoparticles conjugated with anti-EGF receptor antibody for targeted drug delivery to hepatocellular carcinoma[J]. Nanomedicine (Lond), 2014, 9: 279–293. DOI: 10.2217/nnm.13.20 |
| [5] | BOSE M V, RAJKUMAR T. Assessment of the radiation sensitivity of cervical cancer cell lines[J]. Methods Mol Biol, 2015, 1249: 351–362. DOI: 10.1007/978-1-4939-2013-6 |
| [6] | SCOTT A M, WOLCHOK J D, OLD L J. Antibody therapy of cancer[J]. Nat Rev Cancer, 2012, 4: 278–287. |
| [7] | ZHU X, SUN Y, CHEN D, LI J, DONG X, WANG J, et al. Mastocarcinoma therapy synergistically promoted by lysosome dependent apoptosis specifically evoked by 5-Fu@nanogel system with passive targeting and pH activatable dual function[J]. J Control Release, 2017, 254: 107–118. DOI: 10.1016/j.jconrel.2017.03.038 |
| [8] | LEE D W, KOCHENDERFER J N, STETLER-STEVENSON M, CUI Y Z, DELBROOK C, FELDMAN S A, et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial[J]. Lancet, 2015, 385: 517–528. DOI: 10.1016/S0140-6736(14)61403-3 |
| [9] | DAVILA M L, RIVIERE I, WANG X, BARTIDO S, PARK J, CURRAN K, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J]. Sci Transl Med, 2014, 6: 224–225. |
| [10] | FITZMAURICE C, DICKER D, PAIN A, HAMAVID H, MORADI-LAKEH M, MACLNTYRE M F, et al. The global burden of cancer 2013 global burden of disease cancer collaboration[J]. JAMA Oncol, 2015, 1: 505–527. DOI: 10.1001/jamaoncol.2015.0735 |
| [11] | LI W, WEI H, LI H, GAO J, FENG S, GUO Y. Cancer nanoimmunotherapy using advanced pharmaceutical nanotechnology[J]. Nanomedicine (Lond), 2014, 9: 2587–2605. DOI: 10.2217/nnm.14.127 |
| [12] | JIANG W, VON ROEMELIG C A, CHEN Y, QIE Y, LIU X, CHEN J, et al. Designing nanomedicine for immuno-oncology[J/OL]. Nat Biomed Eng, 2017: 0029. doi: 10.1038/s41551-017-0029. |
| [13] | FRIEDMAN A A, LETAI A, FISHER D E, FLAHERTY K T. Precision medicine for cancer with next-generation functional diagnostics[J]. Nat Rev Cancer, 2015, 15: 747–756. DOI: 10.1038/nrc4015 |
| [14] | GLIGORIJEVIĆV, MALOD-DONGNIN N, PRŽULJ N. Integrative methods for analyzing big data in precision medicine[J]. Proteomics, 2016, 16: 741–758. DOI: 10.1002/pmic.v16.5 |
| [15] | "精准医学"在癌症治疗上的成功案例(贾瓦迪的医学奇迹)[EB/OL]. (2015-02-15) [2017-05-13]. http://www.yigoonet.com/article/22512111.html. |
| [16] | AMABLE L. Cisplatin resistance and opportunities for precision medicine[J]. Pharmacol Res, 2016, 106: 27–36. DOI: 10.1016/j.phrs.2016.01.001 |
| [17] | WANG X. Gene mutation-based and specific therapies in precision medicine[J]. J Cell Mol Med, 2016, 20: 577–580. DOI: 10.1111/jcmm.2016.20.issue-4 |
| [18] | TAGLANG G, JACKSON D B. Use of "big data" in drug discovery and clinical trials[J]. Gynecol Oncol, 2016, 141: 17–23. |
| [19] | RUBIN M A. Health: make precision medicine work for cancer care[J]. Nature, 2015, 520: 290–291. DOI: 10.1038/520290a |
| [20] | HOLST L. 精准医疗成功案例分享[EB/OL]. 孙强, 译. (2015-02-15) [2017-05-13]. http://www.sanwen8.com/p/t3eokmdo.html. |
| [21] | CYRANOSKI D. China embraces precision medicine on a massive scale[J]. Nature, 2016, 529: 9–10. DOI: 10.1038/529009a |
| [22] | MODY R J, PRENSNER J R, EVERETT J, PARSONS D W, CHINNAIYAN A M. Precision medicine in pediatric oncology: lessons learned and next steps[J/OL]. Pediatr Blood Cancer, 2017, 64. doi: 10.1002/pbc.26288. |
| [23] | PEER D, KARP J M, HONG S, FAROKHZAD O C, MARGALIT R, LANGER R. Nanocarriers as an emerging platform for cancer therapy[J]. Nat Nanotechnol, 2007, 2: 751–760. DOI: 10.1038/nnano.2007.387 |
| [24] | XU X, HO W, ZHANG X, BERTRAND N, FAROKHZAD O. Cancer nanomedicine: from targeted delivery to combination therapy[J]. Trends Mol Med, 2015, 4: 223–232. |
| [25] | BOZZUTO G, MOLINARI A. Liposomes as nanomedical devices[J]. Int J Nanomedicine, 2015, 10: 975–999. |
| [26] | GAO J, LIU W, XIA Y, LI W, SUN J, CHEN H, et al. The promotion of siRNA delivery to breast cancer overexpressing epidermal growth factor receptor through anti-EGFR antibody conjugation by immunoliposomes[J]. Biomaterials, 2011, 32: 3459–3470. DOI: 10.1016/j.biomaterials.2011.01.034 |
| [27] | CHANG H I, YEH M K. Clinical development of liposome-based drugs: formulation, characterization, and therapeutic efficacy[J]. Int J Nanomedicine, 2012, 7: 49–60. |
| [28] | NASONGKLA N, BEY E, REN J, AI H, KHEMTONG C, GUTHI J S, et al. Multifunctional polymeric micelles as cancer-targeted, MRI-ultrasensitive drug delivery systems[J]. Nano Lett, 2006, 11: 2427–2430. |
| [29] | CABRAL H, MATSUMOTO Y, MIZUNO K, CHEN Q, MURAKAMI M, KIMURA M, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size[J]. Nat Nanotechnol, 2011, 12: 815–823. |
| [30] | BHATTACHARYYA J, BELLUCCI J J, WEITZHANDLER I, MCDANIEL J R, SPASOJEVIC I, LI X, et al. A paclitaxel-loaded recombinant polypeptide nanoparticle outperforms Abraxane in multiple murine cancer models[J]. Nat Commun, 2015, 6: 7939. DOI: 10.1038/ncomms8939 |
| [31] | XIAO R Z, ZENG Z W, ZHOU G L, WANG J J, LI F Z, WANG A M. Recent advances in PEG-PLA block copolymer nanoparticles[J]. Int J Nanomedicine, 2010, 5: 1057–1065. |
| [32] | LI J F, LI W, HUO H, LUO S Z, WU C. Reexamination of the slow mode in semidilute polymer solutions: the effect of solvent quality[J]. Macromolecules, 2008, 41: 901–911. DOI: 10.1021/ma071284b |
| [33] | LI W, MASAMICHI N, AKIMOTO J, OKANO T. Effect of block compositions of amphiphilic block copolymers on the physicochemical properties of polymeric micelles[J]. Polymer, 2011, 52: 3783–3790. DOI: 10.1016/j.polymer.2011.06.026 |
| [34] | LI W, LI J, GAO J, LI B, XIA Y, MENG Y, et al. The fine-tuning of thermosensitive and degradable polymer micelles for enhancing intracellular uptake and drug release in tumors[J]. Biomaterials, 2011, 15: 3832–3844. |
| [35] | LI W, ZHAO M, KE C, ZHANG G, ZHANG L, LI H, et al. Nano polymeric carrier fabrication technologies for advanced antitumor therapy[J]. Biomed Res Int, 2013, 2013: 305089. |
| [36] | LI W, FENG S S, GUO Y. Polymeric nanoparticulates for cancer immunotherapy[J]. Nanomedicine (Lond), 2013, 8: 679–682. DOI: 10.2217/nnm.13.28 |
| [37] | TOPORKIEWICZ M, MEISSNER J, MATUSEWICZ L, CZOGALLA A, SIKORSKI A F. Toward a magic or imaginary bullet? Ligands for drug targeting to cancer cells: principles, hopes, and challenges[J]. Int J Nanomedicine, 2015, 10: 1399–1414. |
| [38] | GABIUS H J, MANNING J C, KOPITZ J, ANDRÉS, KALTNER H. Sweet complementarity: the functional pairing of glycans with lectins[J]. Cell Mol Life Sci, 2016, 73: 1989–2016. DOI: 10.1007/s00018-016-2163-8 |
| [39] | BLANCO E, SHEN H, FERRARI M. Principles of nanoparticle design for overcoming biological barriers to drug delivery[J]. Nat Biotechnol, 2015, 33: 941–951. DOI: 10.1038/nbt.3330 |
| [40] | CARACCIOLO G. Liposome-protein corona in a physiological environment: challenges and opportunities for targeted delivery of nanomedicines[J]. Nanomedicine, 2015, 11: 543–557. DOI: 10.1016/j.nano.2014.11.003 |
| [41] | OWENS D E 3rd, PEPPAS N A. Opsonization, biodistribution, and pharmacokinetics of polymeric nanoparticles[J]. Int J Pharm, 2005, 307: 93–102. |
| [42] | VADER P, MOL E A, PASTERKAMP G, SCHIFFELERS R M. Extracellular vesicles for drug delivery[J]. Adv Drug Deliv Rev, 2016, 106: 148–156. DOI: 10.1016/j.addr.2016.02.006 |
| [43] | HUH M S, LEE E J, KOO H, YHEE J Y, OH K S, SON S, et al. Polysaccharide-based nanoparticles for gene delivery[J]. Top Curr Chem (J), 2017, 375: 31. DOI: 10.1007/s41061-017-0114-y |
| [44] | SHATERABADI Z, NABIYOUNI G, SOLEYMANI M. High impact of in situ dextran coating on biocompatibility, stability and magnetic properties of iron oxide nanoparticles[J]. Mater Sci Eng C Mater Biol Appl, 2017, 75: 947–956. DOI: 10.1016/j.msec.2017.02.143 |
| [45] | OLIVA N, CONDE J, WANG K, ARTZI N. Designing hydrogels for on-demand therapy[J]. Acc Chem Res, 2017, 50: 669–679. DOI: 10.1021/acs.accounts.6b00536 |
| [46] | CHO S J, SANG M J, KANG M, SHIN H S, JI H Y. Preparation of hydrophilic PCL nanofiber scaffolds via electrospinning of PCL/PVP-b-PCL block copolymers for enhanced cell biocompatibility[J]. Polymer, 2015, 69: 95–102. DOI: 10.1016/j.polymer.2015.05.037 |
| [47] | CEDERVALL T, LYNCH I, LINDMAN S, BERGGÅRD T, THULIN E, NILSSON H, et al. Understanding the nanoparticle-protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles[J]. Proc Natl Acad Sci USA, 2007, 104: 2050–2055. DOI: 10.1073/pnas.0608582104 |
| [48] | SALVATI A, PITEK A S, MONOPOLI M P, PRAPAINOP K, BOMBELLI F B, HRISTOV D R, et al. Transferrin-functionalized nanoparticles lose their targeting capabilities when a biomolecule corona adsorbs on the surface[J]. Nat Nanotechnol, 2013, 8: 137–143. DOI: 10.1038/nnano.2012.237 |
| [49] | PALUCKA A K, COUSSENS L M. The basis of oncoimmunology[J]. Cell, 2016, 164: 1233–1247. DOI: 10.1016/j.cell.2016.01.049 |
| [50] | RAPOPORT N. Physical stimuli-responsive polymeric micelles for anti-cancer drug delivery[J]. Prog Polym Sci, 2007, 32(8/9): 962–990. |
| [51] | REPASKY E A, EVANS S S, DEWHIRST M W. Temperature matters! And why it should matter to tumor immunologists[J]. Cancer Immunol Res, 2013, 1: 210–216. DOI: 10.1158/2326-6066.CIR-13-0118 |
| [52] | NICHOLS J W, BAE Y H. EPR: evidence and fallacy[J]. J Control Release, 2014, 190: 451–464. DOI: 10.1016/j.jconrel.2014.03.057 |
| [53] | MANTOVANI A, ALLAVENA P, SICA A, BALKWILL F. Cancer-related inflammation[J]. Nature, 2008, 454: 436–444. DOI: 10.1038/nature07205 |
| [54] | LI W, LI H, LI J, WANG H, ZHAO H, ZHANG L, et al. Self-assembled supramolecular nano vesicles for safe and highly efficient gene delivery to solid tumors[J]. Int J Nanomedicine, 2012, 7: 4661–4677. |
| [55] | LI W, GUO Q, ZHAO H, ZHANG L, LI J F, GAO J, et al. Novel dual-control poly(N-isopropylacrylamide-co-chlorophyllin) nanogels for improving drug release[J]. Nanomedicine (Lond), 2012, 7: 383–392. DOI: 10.2217/nnm.11.100 |
| [56] | SHEN Y, WANG J, LI Y, TIAN Y, SUN H, AMMAR O, et al. Co-delivery of siRNA and paclitaxel into cancer cells by hyaluronic acid modified redox-sensitive disulfide-crosslinked PLGA-PEI nanoparticles[J]. Rsc Advances, 2015, 5: 46464–46479. DOI: 10.1039/C5RA03085D |
| [57] | CHEN L, CHEN F, ZHAO M, ZHU X, KE C, YU J, et al. A redox-sensitive micelle-like nanoparticle self-assembled from amphiphilic adriamycin-human serum albumin conjugates for tumor targeted therapy[J]. Biomed Res Int, 2015, 2015: 987404. |
| [58] | LAO Y H, PHUA K K, LEONG K W. Aptamer nanomedicine for cancer therapeutics: barriers and potential for translation[J]. ACS Nano, 2015, 3: 2235–2254. |
| [59] | MOORE C J, MONTÓN H, O'KENNEDY R, WILLIAMS D E, NOGUÉS C, CREAN C, et al. Controlling colloidal stability of silica nanoparticles during bioconjugation reactions with proteins and improving their longer-term stability, handling and storage[J]. J Mater Chem B, 2015, 3: 2043–2055. |
| [60] | LI W, FENG S, GUO Y. Block copolymer micelles for nanomedicine[J]. Nanomedicine (Lond), 2012, 7: 169–172. DOI: 10.2217/nnm.11.182 |
| [61] | MAEDA H, BHARATE G Y, DARUWALLA J. Polymeric drugs for efficient tumor-targeted drug delivery based on EPR-effect[J]. Eur J Pharm Biopharm, 2009, 71: 409–419. DOI: 10.1016/j.ejpb.2008.11.010 |
| [62] | LI H F, SUN Y, CHEN D, ZHAO H, ZHAO M, ZHU X, et al. Synergistic anti-tumor therapy by a comb-like multifunctional antibody nanoarray with exceptionally potent activity[J]. Sci Rep, 2015, 5: 15712. DOI: 10.1038/srep15712 |
| [63] | KAWAI S, KATO S, IMAI H, OKADA Y, ISHIOKA C. Suppression of FUT1 attenuates cell proliferation in the HER2-overexpressing cancer cell line NCI-N87[J]. Oncol Rep, 2013, 29: 13–20. |
| [64] | LI W, ZHAO H, QIAN W, LI H, ZHANG L, YE Z, et al. Chemotherapy for gastric cancer by finely tailoring anti-Her2 anchored dual targeting immunomicelles[J]. Biomaterials, 2012, 33: 5349–5362. DOI: 10.1016/j.biomaterials.2012.04.016 |
| [65] | DOUGLAS H, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646–674. DOI: 10.1016/j.cell.2011.02.013 |
| [66] | LI H, ZHANG G, JIANG C, ZHANG F, KE C, ZHAO H, et al. Suppression of Rituximab-resistant B-cell lymphoma with a novel multi-component anti-CD20 mAb nanocluster[J]. Oncotarget, 2015, 6: 24192–24204. DOI: 10.18632/oncotarget |
| [67] | SMITH T T, STEPHAN S B, MOFFETT H F, MCKNIGHT L E, JI W, REIMAN D, et al. In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers[J/OL]. Nat Nanotechnol, 2017. doi: 10.1038/nnano.2017.57. |
| [68] | LI W, ZHANG F, ZHAO M, ZHU X, JIANG C, KE C, et al. Effects of intracellular process on the therapeutic activation of nanomedicine[J]. Pharm Anal Acta, 2015, 6: 5. |
| [69] | ZHANG F L, ZHU X D, GONG J, SUN Y, CHEN D, WANG J, et al. Lysosome-mitochondria-mediated apoptosis specifically evoked in cancer cells induced by gold nanorods[J]. Nanomedicine (Lond), 2016, 11: 1993–2006. DOI: 10.2217/nnm-2016-0139 |
| [70] | BOYA P, KROEMER G. Lysosomal membrane permeabilization in cell death[J]. Oncogene, 2008, 27: 6434–6451. DOI: 10.1038/onc.2008.310 |
| [71] | ZHANG F, CHEN D, WANG Y, ZHANG L, DONG W, DAI J, et al. Lysosome-dependent necrosis specifically evoked in cancer cells by gold nanorods[J/OL]. Nanomedicine (Lond), 2017. doi: 10.2217/nnm-2017-0126. |
| [72] | YU H J, WU H K, GAO J M. Non-viral siRNA vectors based on micellar nanoparticles with endosome pH-activatable core[J]. J Gene Med, 2014, 7: 231–232. |
| [73] | ZHANG X, DONG Y, ZENG X, LIANG X, LI X, TAO W, et al. The effect of autophagy inhibitors on drug delivery using biodegradable polymer nanoparticles in cancer treatment[J]. Biomaterials, 2014, 35: 1932–1943. DOI: 10.1016/j.biomaterials.2013.10.034 |
| [74] | CHEN Z P, LI M, ZHANG L J, HE J Y, WU L, XIAO Y Y, et al. Mitochondria-targeted drug delivery system for cancer treatment[J]. J Drug Target, 2016, 24: 492–502. DOI: 10.3109/1061186X.2015.1108325 |
| [75] | DURAZO S A, KOMPELLA U B. Functionalized nanosystems for targeted mitochondrial delivery[J]. Mitochondrion, 2012, 12: 190–201. DOI: 10.1016/j.mito.2011.11.001 |
| [76] | COSTIN G E, TRIF M, NICHITA N, DWEK R A, PETRESCU S M. pH-sensitive liposomes are efficient carriers for endoplasmic reticulum-targeted drugs in mouse melanoma cells[J]. Biochem Biophys Res Commun, 2002, 293: 918–923. DOI: 10.1016/S0006-291X(02)00317-0 |
| [77] | SEO J A, KIM B, DHANASEKARAN D N, TSANG B K, SONG Y S. Curcumin induces apoptosis by inhibiting sarco/endoplasmic reticulum Ca2+ ATPase activity in ovarian cancer cells[J]. Cancer Lett, 2016, 371: 30–37. DOI: 10.1016/j.canlet.2015.11.021 |
 2017, Vol. 38
2017, Vol. 38


