2. 清华大学深圳研究生院生命与健康学部基因与抗体治疗重点实验室, 深圳 518055;
3. 中山大学药学院(深圳)药剂学系, 广州 510275;
4. 新加坡国立大学工程学院化学与生物分子工程系, 新加坡 117576
2. Shenzhen Key Laboratory of Gene & Antibody, Division of Life and Health Sciences, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, Guangdong, China;
3. Department of Pharmaceutics, School of Pharmaceutical Sciences (Shenzhen), Sun Yat-sen University, Guangzhou 510275, Guangdong, China;
4. Department of Chemical & Biomolecular Engineering, National University of Singapore, 4 Engineering Drive 4, Singapore 117576, Singapore
近年来肿瘤纳米药物被广泛研究,其中连接主动靶向配体的纳米药物载体是一种可以实现精准靶向的给药系统[1]。这种给药系统能够在肿瘤病灶部位有效富集,通过靶向配体介导的内吞作用进入细胞,并通过控制药物释放实现对肿瘤细胞的杀伤,减少化疗药物的不良反应[2]。传统的靶向配体连接策略是直接在纳米粒子表面修饰以及预先制备聚合物-靶向分子共聚物。这些方法具有以下缺点:采用的偶联剂、催化剂等需要通过复杂的纯化过程予以剔除[3];复杂的反应机制大大增加了合成难度,降低了方法的通用性[4]。
聚多巴胺(polydopamine,PDA)是一种具有黏附性和良好生物相容性的大分子,温和条件下可以通过多巴胺(dopamine)氧化聚合而附着在多种材料表面[5]。PDA具有良好的生物学特性,在体外和体内都没有明显的毒性,作为一种表面改性剂可应用于多个领域[6]。近年来,PDA应用于纳米药物表面改性的研究逐渐增多[7-10]。Park等[9]采用PDA对载药纳米颗粒进行表面修饰并偶联靶向配体,结果表明PDA改性的纳米颗粒具备优异的生物相容性,并且对肿瘤细胞具有明显的靶向性。此外,PDA有良好的pH响应性,在pH中性环境(如血液、组织液等)中,PDA修饰膜可以保持稳定,而在肿瘤内部偏酸性环境中可被降解从而释放药物[11]。另外,最近研究发现PDA还具备优良的光热转换功能,可应用于肿瘤的光热治疗[12]。
叶酸受体介导的靶向给药主要是以叶酸受体为靶点,通过叶酸与肿瘤细胞表面过表达的叶酸受体特异性结合,进而将药物载体内吞进入细胞[13]。聚乙二醇(PEG)是一种无毒性、无刺激性、具有良好亲水性的聚合物,被广泛应用于药物载体修饰,能够增加药物载体的溶解度、渗透性、稳定性以及生物利用度[14]。本研究中采用的叶酸聚乙二醇氨基(NH2-PEG-FA)同时具备了上述两个方面的优点。本课题组前期研究发现,星型共聚物胆酸-聚乳酸-羟基乙酸共聚物(CA-PLGA)是一类良好的药物载体,具有粒径小、载药量大、包封率高等优点[15]。多烯紫杉醇(docetaxel,DTX)是一种临床抗肿瘤药物,广泛应用于多种实体瘤的化疗。因此本实验设计了一种负载DTX的纳米给药系统——叶酸和PDA修饰的CA-PLGA纳米粒子(CA-PLGA@PDA-PEG-FA/NPs),并借助主动靶向和pH响应机制增加其在肿瘤部位的富集与药物释放,从而改善DTX的化疗效果。
1 材料和方法 1.1 试剂与仪器多烯紫杉醇(docetaxel,DTX和泰素帝®(Taxotere®)购自上海金和生物技术有限公司,多巴胺盐酸盐(dopamine hydrochloride)、香豆素6(coumarin-6)、3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)、4’, 6-二脒基-2-苯基吲哚(DAPI)、乙腈(acetonitrile,色谱纯)和甲醇(methanol,色谱纯)购自美国Sigma-Aldrich公司,叶酸聚乙二醇氨基(NH2-PEG-FA和聚乙二醇氨基(NH2-PEG)购自上海炎怡生物科技有限公司,星型共聚物CA-PLGA按照文献[15]所述方法合成,人乳腺癌MCF-7细胞株购自美国ATCC公司。透射电镜(Tecnai G2 20,美国FEI公司),纳米粒度分析仪(Zetasizer Nano ZS90,英国马尔文仪器有限公司),X射线光电子能谱仪(XPS,日本ULVAC-PHI公司),高效液相色谱仪(HPLC,Agilent Technologies 1200series,美国安捷伦公司),激光扫描共聚焦显微镜(Olympus FV1000,日本奥林巴斯公司),流式细胞仪(美国BD公司)。
1.2 载药纳米粒子的制备采用优化的纳米沉淀法制备载药纳米粒子,称取100 mg CA-PLGA、10 mg DTX溶于8 mL丙酮中,在室温搅拌的条件下,将上述溶液逐滴加入到100 mL的0.03%(质量体积分数)的聚乙二醇维生素E琥珀酸酯(TPGS)水溶液中,继续室温搅拌过夜,充分挥发丙酮并载药,39 191×g离心15 min,弃上清液,沉淀用去离子水洗涤3次,得到载DTX的CA-PLGA的胆酸-聚乳酸-羟基乙酸共聚物纳米粒子(DTX-loaded CA-PLGA/NPs),冷冻干燥后备用。
1.3 PDA的修饰在弱碱性(pH为8.0~8.5) 条件下实现PDA的表面修饰,称取适量1.2项下制备的载药纳米粒子DTX-loaded CA-PLGA/NPs,按浓度1 mg/mL重悬于Tris缓冲液(10 mmol/L,pH=8.5),然后室温搅拌加入多巴胺盐酸盐,(多巴胺盐酸盐的终浓度为0.5 mg/mL),反应5 h后39 191×g离心15 min,弃上清液,取沉淀用去离子水洗涤3次,得到载DTX的PDA修饰的CA-PLGA胆酸-聚乳酸-羟基乙酸共聚物纳米粒子(DTX-loaded CA-PLGA@PDA/NPs),冷冻干燥后备用。
1.4 靶向配体的修饰在弱碱性(pH为8.0~8.5) 条件下实现靶向配体的修饰,按终浓度1 mg/mL称取适量1.3项下制备的纳米粒子DTX-loaded CA-PLGA@PDA/NPs重悬于Tris缓冲液(10 mmol/L,pH=8.5),然后室温搅拌加入NH2-PEG-FA,使终浓度为2 mg/mL,继续搅拌5 h,39 191×g离心15 min,弃上清液,沉淀用去离子水洗涤3次,得到载DTX的叶酸和PDA修饰的胆酸-聚乳酸-羟基乙酸共聚物CA-PLGA纳米粒子(DTX-loaded CA-PLGA@PDA-PEG-FA/NPs),冷冻干燥后备用。
按同样方法加入NH2-PEG合成载DTX的聚乙二醇和PDA修饰的胆酸-聚乳酸-羟基乙酸共聚物CA-PLGA纳米粒子(DTX-loaded CA-PLGA@PDA-PEG/NPs)。
按同样方法合成载香豆素6的聚乙二醇和PDA修饰的CA-PLGA纳米粒子(coumarin-6 loaded CA-PLGA@PDA-PEG/NPs)和载香豆素6的叶酸和PDA修饰的CA-PLGA纳米粒子(coumarin-6 loaded CA-PLGA@PDA-PEG-FA/NPs),只需将DTX替换为香豆素6。
1.5 纳米粒子的表征分析将上述制备的纳米粒子DTX-loaded CA-PLGA@PDA-PEG-FA/NPs重悬于去离子水超声分散后,用纳米粒度分析仪测定其粒径和zeta电位。将纳米粒子重悬于乙醇中超声分散后,滴加到碳膜铜网上晾干,用透射电镜观察其形貌。用XPS分析纳米粒子表面的元素组成。留存并过滤上述纳米粒子制备过程中的每一步反应前后的上清液,用HPLC分析残留药物浓度,按公式计算纳米粒子的载药量和包封率:载药量(%)=(纳米粒子药物含量/纳米粒子质量)×100%;包封率(%)=(纳米粒子药物含量/投药量)×100%。HPLC的参数为:色谱柱为反相C-18柱(150 mm×4.6 mm,5 μm,C18 AgilentTechnologies,CA,USA),流动相为乙腈:水(50:50,体积比),流速为1 mL/min,进样量20 μL,紫外检测波长为227 nm。
1.6 载药纳米粒子的体外释放检测采用透析法测定载药纳米粒子的体外释放曲线。称取5 mg载药纳米粒子分散于1 mL的释放介质PBST溶液(含质量体积分数为0.1%吐温-80的PBS溶液,pH 7.4),转移到透析袋(截留相对分子质量3 500,上海生工生物工程技术服务有限公司)中,封口,再浸于装有15 mL释放介质PBST溶液的50 mL离心管中,最后置于恒温水浴摇床37 ℃震荡。在14 d内每隔24 h从离心管中取出1 mL溶液用于分析,再补充等量的新鲜溶液。于取出的1 mL溶液中加入1 mL二乙醚萃取,弃去水相后通N2挥发二乙醚,待二乙醚完全挥发后,加入1 mL流动相乙腈:水(50:50,体积比)经超声分散并过滤后,取20 μL加入到HPLC进样孔中进行测量,测试条件同1.5项所示。根据DTX的标准曲线绘制体外释放曲线。
1.7 纳米粒子的细胞摄取实验将MCF-7细胞接种到玻底培养皿中,培养过夜并贴壁后,分别加入250 μg/mL的载香豆素6的纳米粒子coumarin-6 loaded CA-PLGA@PDA-PEG/NPs和纳米粒子coumarin-6 loaded CA-PLGA@PDA-PEG-FA/NPs,另外验证组加入载香豆素6的纳米粒子coumarin-6 loaded CA-PLGA@PDA-PEG-FA/NPs(125 μg/mL)和游离叶酸(125 μg/mL)。培养0.5 h和2 h后PBS洗涤3次,用4%多聚甲醛溶液固定15 min,PBS洗涤3次,然后用DAPI染细胞核10 min,PBS洗涤3次,采用荧光共聚焦显微镜观察细胞对纳米粒子的摄取情况,蓝色通道激发波长为340 nm,绿色通道激发波长为485 nm。进一步采用流式细胞仪定量研究细胞摄取,按1×106/孔的细胞密度将MCF-7细胞接种到6孔板上,培养过夜并贴壁后,分别加入250 μg/mL的载香豆素6的纳米粒子coumarin-6 loaded CA-PLGA@PDA-PEG/NPs和coumarin-6 loaded CA-PLGA@PDA-PEG-FA/NPs,另设不加入荧光纳米粒子作为对照。培养1 h后,小心消化细胞、PBS清洗后,重悬于PBS溶液中用流式细胞仪检测,激发波长和发射波长分别为488 nm和530 nm,每组检测约10 000个细胞。
1.8 载药纳米粒子的体外细胞毒性实验用MTT法测定纳米粒子在24 h和48 h对MCF-7细胞的细胞毒性。将MCF-7细胞以1×104/孔的密度接种到96孔板上,培养过夜并贴壁后,分别用纳米粒子CA-PLGA@PDA-PEG-FA/NPs(不载药)、泰素帝® (Taxotere®)、DTX-loaded CA-PLGA@PDA-PEG/NPs和DTX-loaded CA-PLGA@PDA-PEG-FA/NPs处理24 h和48 h,其中载药各组DTX的质量浓度分别为0.25、2.5、12.5、25 μg/mL,不载药纳米粒子的浓度与载药纳米粒子的浓度一致。之后,96孔板每孔加入20 μL 5 mg/mL的MTT溶液,继续培养4 h后弃去培养液,每孔加入150 μL二甲基亚砜,于摇床避光震荡30 min使得甲臜晶体完全溶解,最后用酶标仪测定490 nm的光密度(D)值。参照存活率为零的空白对照组和存活率为100%的对照组计算每组细胞的存活率。
1.9 统计学处理采用SPSS 22.0软件进行数据分析,实验数据以x±s表示,两组间比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 载药纳米粒子的表征如图 1A所示,本实验设计的主动靶向载药纳米粒子DTX-loaded CA-PLGA@PDA-PEG-FA/NPs为“核-壳”结构,包括作为核心载药的CA-PLGA/NPs以及作为壳结构的PDA和靶向配体。图 1B为主动靶向纳米粒子的透射电镜照片,纳米粒子均表现为尺寸大小均一的“核-壳”结构,说明PDA黏附在纳米粒子表面。如图 1C所示,采用纳米粒度仪测得水合粒径为(166.4±3.9) nm,这个粒径有助于纳米粒子在体内通过高渗透和滞留(EPR)效应在肿瘤部位富集并对肿瘤进行杀伤。另外测得的纳米粒子的粒径分布比较窄(多分散指数<0.15),有利于改善纳米粒子在体内的分布。根据透射电镜照片估计,纳米粒子的粒径较小(85 nm),这是因为透射电镜测得的粒径为干态的纳米粒子,纳米粒度仪测得的粒径为湿态的纳米粒子,纳米粒子在干燥过程中粒径有所收缩。图 1D为采用纳米粒度仪测得的纳米粒子的zeta电位(-11.7±3.8) mV,绝对值较大的负电位有助于纳米粒子在水溶液中稳定分散。

|
图 1 载DTX的叶酸和聚多巴胺修饰的CA-PLGA纳米粒子的表征 Fig 1 Characterization of DTX-loaded CA-PLGA@PDA-PEG-FA/NPs A: Schematic diagram; B: Transmission electron microscopy image; C: The size distribution by intensity; D: The zeta potential distribution. CA-PLGA@PDA-PEG-FA/NPs: CA-PLGA nanoparticles modified by folic acid (FA) and polydopamine (PDA); DTX: Docetaxel; CA-PLGA: Cholic acid-poly(lactide-co-glycolide); PEG: Polyethylene glycol |
2.2 纳米粒子的XPS分析结果
为了进一步对纳米粒子的结构进行验证,我们采用XPS对不载药的4种纳米粒子CA-PLGA/NPs、CA-PLGA@PDA/NPs、CA-PLGA@PDA-PEG/NPs、CA-PLGA@PDA-PEG-FA/NPs进行了表面元素分析,结果如图 2所示。图 2A中的C1s峰和O1s峰来自CA-PLGA/NPs,图 2B中出现的N1s峰证明了PDA的表面修饰,图 2C和2D中增强的N1s峰分别说明了NH2-PEG和NH2-PEG-FA的修饰。结合上述电镜照片,确认纳米粒子核心为CA-PLGA/NPs,壳结构为PDA和NH2-PEG-FA。
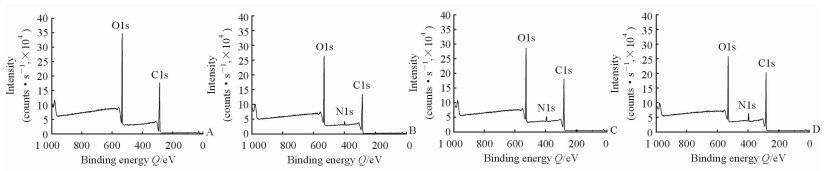
|
图 2 未载药纳米粒子的XPS谱图 Fig 2 XPS spectra of drug-free nanoparticles A: CA-PLGA nanoparticles (CA-PLGA/NPs); B: CA-PLGA nanoparticles modified by polydopamine (PDA) (CA-PLGA@PDA/NPs); C: CA-PLGA nanoparticles modified by polyethylene glycol (PEG) and PDA (CA-PLGA@PDA-PEG/NPs); D: CA-PLGA nanoparticles modified by folic acid (FA) and PDA (CA-PLGA@PDA-PEG-FA/NPs). CA-PLGA: Cholic acid-poly(lactide-co-glycolide); XPS: X-ray photoelectron spectroscopy |
2.3 载药纳米粒子的体外释放
纳米粒子的载药量、包封率以及药物缓释均对其化疗效果有重要影响。表 1为测得的4种载药纳米粒子的载药量以及包封率,载药量均约为10%,表明纳米粒子的表面功能化几乎不影响其载药能力。分别在pH 7.4和pH 5.0的释放介质中进行药物体外释放实验,结果如图 3所示,载药纳米粒子展现两相释放特征。第一阶段的突释可以归因于吸附在纳米粒子表面的药物,并且可以快速释放出来,前2 d大约释放50%。随后的缓释主要是由于药物缓慢从纳米粒子的核层渗透出来,14 d时可以释放约80%。通过对比发现,在pH 5.0的释放介质中,药物释放较快,这是由于在酸性条件下PDA分解促进药物释放。
|
|
表 1 载DTX纳米粒子的表征 Tab 1 Characterization of DTX-loaded nanoparticles |
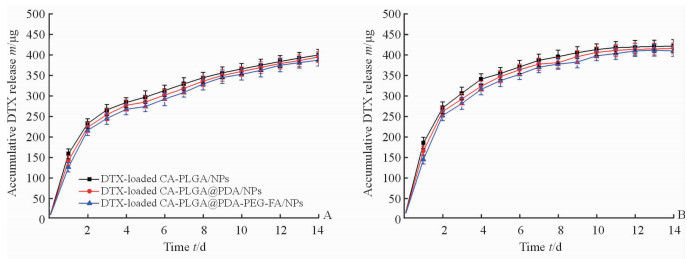
|
图 3 载DTX纳米粒子的药物释放曲线 Fig 3 In vitro drug release profiles of DTX-loaded nanoparticles A: pH 7.4; B: pH 5.0. CA-PLGA/NPs: CA-PLGA nanoparticles; CA-PLGA@PDA/NPs: CA-PLGA nanoparticles modified by polydopamine (PDA); CA-PLGA@PDA-PEG-FA/NPs: CA-PLGA nanoparticles modified by folic acid (FA) and PDA; CA-PLGA: Cholic acid-poly(lactide-co-glycolide); DTX: Docetaxel. n=3, x±s |
2.4 纳米粒子的体外细胞摄取
肿瘤细胞对纳米粒子的摄取直接影响药物进入细胞,进而影响化疗效果。分别采用定性和定量的方法研究纳米粒子的体外细胞摄取,图 4A为用激光扫描共聚焦显微镜观察MCF-7细胞对载香豆素6的纳米粒子的摄取结果,由图可见,绿色的纳米粒子大多处于细胞质中,且紧紧围绕在蓝色的细胞核周围,培养时间从0.5 h延长到2 h时,细胞摄取的纳米粒子的荧光增强,其中细胞摄取载香豆素6的CA-PLGA@PDA-PEG-FA/NPs的荧光强度均明显强于载香豆素6的CA-PLGA@PDA-PEG/NPs;另外,加入游离叶酸组的荧光强度明显减弱,证明叶酸介导了的纳米粒子主动靶向作用。图 4B和4C为用流式细胞仪定量研究MCF-7细胞对纳米粒子的摄取,结果与上述定性分析一致,提示叶酸介导的细胞内吞作用明显增加了MCF-7细胞对纳米粒子的摄取(P<0.01)。

|
图 4 MCF-7细胞对载香豆素6(C6) 纳米粒子的摄取 Fig 4 Cellular uptake of coumarin-6 (C6) loaded nanoparticles A: Laser scanning confocal microscope images of MCF-7 cells after incubation with nanoparticles for 0.5 h and 2 h. 1, 2, and 3 represent C6 loaded CA-PLGA@PDA-PEG/NPs, C6 loaded CA-PLGA@PDA-PEG-FA/NPs and C6 loaded CA-PLGA@PDA-PEG-FA/NPs with free FA, respectively; B: Graphic demonstration of flow cytometry (FCM) analysis of MCF-7 cells after 1 h-incubation with nanoparticles; C: Quantitative FCM histogram (t-test, **P < 0.01). CA-PLGA@PDA-PEG/NPs: CA-PLGA nanoparticles modified by polyethylene glycol (PEG) and polydopamine (PDA); CA-PLGA@PDA-PEG-FA/NPs: CA-PLGA nanoparticles modified by folic acid (FA) and PDA; DAPI: 4', 6-diamidino-2-phenylindole. n=3, x±s |
2.5 载药纳米粒子的体外细胞毒性
体外细胞毒性实验直接反映载药纳米粒子对于肿瘤细胞的杀伤效果,本研究采用MTT法测定了纳米粒子在培养24 h和48 h后对MCF-7细胞的细胞毒性。如图 5所示,CA-PLGA@PDA-PEG-FA/NPs(不载药)在各个浓度均没有表现出细胞毒性,排除了药物载体的细胞毒性;其余DTX配方均表现出细胞毒性,其中2种载药纳米粒子的细胞毒性均大于临床用的DTX制剂泰素帝®;随着浓度和时间的增加,两种载药纳米粒子均表现出细胞毒性增加的趋势;载药纳米粒子CA-PLGA@PDA-PEG-FA/NPs表现出最强的细胞毒性。

|
图 5 纳米粒子培养24 h (A)和48 h (B)对MCF-7的细胞毒性实验结果 Fig 5 Viability of MCF-7 cells cultured with DTX-loaded nanoparticles (NPs) in comparison with Taxotere® at same DTX dose and drug-free NPs with same amount of NPs for 24 h (A) and 48 h (B) CA-PLGA@PDA-PEG/NPs: CA-PLGA nanoparticles modified by polyethylene glycol (PEG) and polydopamine (PDA); CA-PLGA@PDA-PEG-FA/NPs: CA-PLGA nanoparticles modified by folic acid (FA) and PDA; DTX: Docetaxel. t-test, *P < 0.05, **P < 0.01. n=5, x±s |
3 讨论
本研究首先采用优化的纳米沉淀法制备负载疏水性药物的聚合物纳米粒子,接着在纳米粒子表面修饰一层PDA分子,最后通过迈克尔加成反应(Michael addition)或席夫碱反应(Schiff base reaction)在PDA修饰层上连接具有氨基或巯基的配体[9],从而实现载药纳米粒子的主动靶向和体内长效循环。相对于传统的配体连接方式,即直接在缺乏活性基团的纳米粒子表面连接配体和预先制备聚合物-配体共聚物,基于PDA的表面修饰具有以下优点:(1) PDA分子可方便地黏附在多种材料表面,如聚合物纳米粒子[7]、金纳米粒子[16]、介孔二氧化硅纳米粒子[11]等;(2) 可以连接多种具有氨基或巯基的配体,如半乳糖胺[7]、核酸适体-巯基[17]、叶酸[9]等;(3) PDA具有pH敏感性,在中性环境(正常组织)中保持结构稳定,在酸性环境(如肿瘤组织)中被降解,有利于改善药物的可控释放。
采用的聚合物为文献中合成的星型共聚物CA-PLGA,疏水性药物为传统抗肿瘤药物DTX,制备的载药纳米粒子DTX-loaded CA-PLGA@PDA-PEG-FA/NPs具有合适的粒径和zeta电位,有利于避免纳米粒子在体内循环时被网状内皮系统清除[14],更多地通过EPR效应富集在肿瘤部位。通过体外细胞摄取实验可以发现,连接了主动靶向配体叶酸的纳米粒子更容易被MCF-7细胞摄取,从而使富集在肿瘤部位的载药纳米粒子更容易通过叶酸受体介导的内吞作用进入肿瘤细胞,为之后的肿瘤杀伤作用奠定基础。此外,基于PDA pH响应性的药物控制释放有利于减少药物提前泄漏,更多地被递送到肿瘤细胞。体外抗肿瘤效果可以通过体外细胞存活实验检测,比较24 h和48 h的细胞存活率,抗肿瘤效果依次为DTX-loaded CA-PLGA@PDA-PEG-FA/NPs>DTX-loaded CA-PLGA@PDA-PEG/NPs>泰素帝®,说明主动靶向以及pH响应机制能够显著提高DTX的抗肿瘤效果。
本研究构建的主动靶向乳腺癌的pH响应的载药纳米粒子能够有效负载疏水性抗肿瘤药物,结合主动靶向和pH响应机制,有望实现纳米粒子在肿瘤部位的有效富集和摄取,并通过控制药物释放提高肿瘤抑制率,同时减少对正常细胞的毒性,从而改善传统抗肿瘤药物的化疗效果,为临床用药提供一种新剂型、新思路。另外,考虑到PDA良好的光热性能,未来还可以基于本研究联合光热治疗和化疗,进一步提高对肿瘤的有效杀伤。
| [1] | BERTRAND N, WU J, XU X, KAMALY N, FAROKHZAD O C. Cancer nanotechnology: the impact of passive and active targeting in the era of modern cancer biology. Adv Drug Deliv Rev, 2014, 66: 2-25. doi: 10.1016/j.addr.2013.11.009. |
| [2] | ULBRICH K, HOL K, UBR V, BAKANDRITSOS A, TUC ˇ EK J, ZBOR ˇ IL R. Targeted drug delivery with polymers and magnetic nanoparticles: covalent and noncovalent approaches, release control, and clinical studies. Chem Rev, 2016, 116: 5338-5431. doi: 10.1021/acs.chemrev.5b00589. |
| [3] | TAKAHASHI M, YOSHINO T, MATSUNAGA T. Surface modification of magnetic nanoparticles using asparagines-serine polypeptide designed to control interactions with cell surfaces. Biomaterials, 2010, 31: 4952-4957. doi: 10.1016/j.biomaterials.2010.02.048. |
| [4] | GULLOTTI E, YEO Y. Beyond the imaging: limitations of cellular uptake study in the evaluation of nanoparticles. J Control Release, 2012, 164: 170-176. doi: 10.1016/j.jconrel.2012.04.042. |
| [5] | LEE H, DELLATORE S M, MILLER W M, MESSERSMITH P B. Mussel-inspired surface chemistry for multifunctional coatings[J]. Science, 2007, 318: 426–430. DOI: 10.1126/science.1147241 |
| [6] | SCOTT A R. Polymers: secrets from the deep sea[J]. Nature, 2015, 519: S12–S13. DOI: 10.1038/519S12a |
| [7] | ZHU D, TAO W, ZHANG H, LIU G, WANG T, ZHANG L, et al. Docetaxel (DTX)-loaded polydopamine-modified TPGS-PLA nanoparticles as a targeted drug delivery system fore the treatment of liver cancer. Acta Biomater, 2016, 30: 144-154. doi: 10.1016/j.actbio.2015.11.031. |
| [8] | SHI Y, LIU M, WANG K, DENG F, WAN Q, HUANG Q, et al. Bioinspired preparation of thermo-responsive graphene oxide nanocomposites in an aqueous solution[J]. Polym Chem UK, 2015, 6: 5876–5883. DOI: 10.1039/C5PY00844A |
| [9] | PARK J, BRUST T F, LEE H J, LEE S C, WATTS V J, YEO Y. Polydopamine-based simple and versatile surface modification of polymeric nano drug carriers. ACS Nano, 2014, 8: 3347-3356. doi: 10.1021/nn405809c. |
| [10] | ZHANG L, SU H, CAI J, CHENG D, MA Y, ZHANG J, et al. A multifunctional platform for tumor angiogenesis-targeted chemo-thermal therapy using polydopamine-coated gold nanorods. ACS Nano, 2016, 10: 10404-10417. doi: 10.1021/acsnano.6b06267. |
| [11] | CHANG D F, GAO Y F, WANG L J, LIU G, CHEN Y H, WANG T, et al. Polydopamine-based surface modification of mesoporous silica nanoparticles as pH-sensitive drug delivery vehicles for cancer therapy. J Colloid Interface Sci, 2016, 463: 279-287. doi: 10.1016/j.jcis.2015.11.001. |
| [12] | DING X, LIU J, LI J, WANG F, WANG Y, SONG S, et al. Polydopamine coated manganese oxide nanoparticles with ultrahigh relaxivity as nanotheranostic agents for magnetic resonance imaging guided synergetic chemo-/photothermal therapy. Chem Sci, 2016, 7: 6695-6700. doi: 10.1039/c6sc01320a. |
| [13] | PULIGUJJA P, BALKUNDI S S, KENDRICK L M, BALDRIDGE H M, HILAIRE J R, BADE A N, et al. Pharmacodynamics of long-acting folic acid-receptor targeted ritonavir-boosted atazanavir nanoformulations. Biomaterials, 2015, 41: 141-150. doi: 10.1016/j.biomaterials.2014.11.012. |
| [14] | MEI L, ZHANG Z, ZHAO L, HUANG L, YANG X L, TANG J, et al. Pharmaceutical nanotechnology for oral delivery of anticancer drugs. Adv Drug Deliv Rev, 2013, 65: 880-890. doi: 10.1016/j.addr.2012.11.005. |
| [15] | ZENG X W, TAO W, MEI L, HUANG L G, TAN C Y, FENG S S. Cholic acid-functionalized nanoparticles of star-shaped PLGA-vitamin E TPGS copolymer for docetaxel delivery to cervical cancer. Biomaterials, 2013, 34: 6058-6067. doi: 10.1016/j.biomaterials.2013.04.052. |
| [16] | LIU X S, CAO J M, LI H, LI J Y, JIN Q, REN K F, et al. Mussel-inspired polydopamine: a biocompatible and ultrastable coating for nanoparticles in vivo. ACS Nano, 2013, 7: 9384-9395. doi: 10.1021/nn404117j. |
| [17] | TAO W, ZENG X W, WU J, ZHU X, YU X H, ZHANG X D, et al. Polydopamine-based surface modification of novel nanoparticle-aptamer bioconjugates for in vivo breast cancer targeting and enhanced therapeutic effects. Theranostics, 2016, 6: 470-484. doi: 10.7150/thno.14184.eCollection2016. |
 2017, Vol. 38
2017, Vol. 38



