2. 维克森林大学医学院病理系, 温斯顿-塞勒姆 NC28780;
3. 辛辛那提大学工程与应用科学学院机械与材料工程系, 辛辛那提 OH45221-0012
2. Department of Pathology, Wake Forest University School of Medicine, Winston-Salem NC28780, USA;
3. Materials Science and Engineering Program, Department of Mechanical and Materials Engineering, College of Engineering and Applied Science, University of Cincinnati, Cincinnati OH45221-0012, USA
恶性肿瘤是威胁人类健康的一大杀手[1-3]。大量的临床研究和数据表明,通过某些先进医疗手段实现肿瘤的早发现、早诊断并进行科学有效的干预,可使患者的5年生存率及生活质量都有一定程度的提高[4]。为实现肿瘤的早筛早检,在血液中寻找到带有特异性肿瘤标志物的循环肿瘤细胞(circulating tumor cell,CTC)不失为一种安全有效的方法[5]。近年来,纳米技术在肿瘤早期诊断中,尤其是CTC检测中应用广泛。纳米材料的优化(结构可控、表面功能化),以及微流控技术和纳米器件方面的突破,大大提高了CTC的富集率和检测灵敏度。2013年,Nature杂志将CTC纳米检测列为最具创新性和转化潜力的肿瘤诊断新方法[6]。然而传统纳米技术的难点在于难以寻找到高特异性的肿瘤标志物,且纳米标志物普遍缺少对肿瘤细胞的靶向驱动能力,针对某种肿瘤标志物的特异性又与针对不同肿瘤广谱性的特征相矛盾[7]。此外,以往的纳米靶向功能通过基于纳米材料构建肿瘤细胞的特异性抗体实现,然而这些抗体的表达会在肿瘤细胞转移过程中发生变化,从而造成CTC检测结果假阴性[8]。因此,我们试图寻找一种新的纳米靶向方法,设计出兼具靶向驱动能力和普适性的纳米探针进行肿瘤细胞的早期检测。崔征等[9-11]在实验中偶然发现一只抗肿瘤小鼠,通过对其抗肿瘤机制的研究发现粒细胞对肿瘤病灶具有极强的主动趋向能力。利用粒细胞的这一特性,我们将其作为纳米荧光标志物的活性载体,设计新型磁性-荧光纳米异质结构用于标记粒细胞,使纳米探针发挥自动生物导航功能,从而实现对痕量肿瘤细胞的识别、磁富集和定量、可视化分析。
1 材料和方法 1.1 试剂与仪器氯化高铁(FeCl3·6H2O)、氨水(NH3·H2O)、浓盐酸(HCl,37%)、无水乙醇购自国药集团化学试剂有限公司;乙二醇、乙酸钠(NaAc)、正硅酸乙酯(TEOS)、3-氨丙基三乙氧基硅烷(APTES)和异硫氰酸罗丹明(RITC)购自Sigma-Aldrich公司;实验过程中的二次水(DIW,18.2 MΩ·cm)由实验室Thermo Easypure Ⅱ UF System自制。
电子分析天平(BS 124 S,Sartorius德国),超纯水仪(Easypure Ⅱ UF,Thermo美国),超声波清洗器(KQ-400KDE,昆山市超生仪器有限公司),电动搅拌器(D2010W,上海梅颖浦仪器仪表制造有限公司),远红外干燥器(WS70-1,上海华连医疗器械有限公司),高温烘箱(ST-120B2,上海爱佩斯克环境设备有限公司),恒温水浴锅(501型,上海荣丰有限公司),透射电子显微镜(JEM-2100,JEOL日本),荧光/磷光/发光分光光度计(LS-55,Perkin Elmer美国)。
1.2 磁性-荧光复合纳米材料的制备本实验采用的纳米材料为磁性-荧光复合材料,以Fe3O4为核,表面包被SiO2和RITC,形成具有磁性且携带红色荧光的纳米探针。相关材料的合成方法见文献[12]。
1.2.1 超顺磁性Fe3O4的制备将0.81 g FeCl3 · 6H2O、2.56 g NaAc溶解于30 mL乙二醇,磁力搅拌30 min混匀后,将该混合溶液转移至高温高压反应釜中,放入200 ℃烘箱恒温反应8 h,从反应釜取出,流水快速冷却至室温,磁铁辅助分离,去掉反应液,分别用乙醇和二次水各洗涤3次,得到超顺磁性Fe3O4。
1.2.2 Fe3O4@SiO2的合成在圆底烧瓶中加入1.5 mL制得的超顺磁性Fe3O4和0.15 mol/L浓盐酸,超声搅拌处理10 min后,磁铁辅助分离,二次水洗6次以上,至上清液pH中性;三口烧瓶中加入适量乙醇、二次水及上述经处理的Fe3O4,超声机械搅拌15 min后,氨水调节pH至9.5左右,加入TEOS乙醇溶液,超声机械搅拌12 h,然后磁铁辅助分离,去掉反应液,分别用乙醇和二次水各洗涤3次,得到Fe3O4@SiO2。
1.2.3 磁性-荧光复合纳米材料的荧光包覆在圆底烧瓶中将45 mL无水乙醇、5 mL二次水、1.3 mL氨水机械搅拌混匀,加入100 mg Fe3O4@SiO2后超声机械搅拌30 min;将TEOS乙醇溶液缓慢逐滴加入反应体系中。15 min后,将制备好的APTES-RITC溶液(10 μL APTES与1 mg RITC在2 mL乙醇溶液中混合过夜)快速加入上述反应体系中,避光条件下继续超声机械搅拌4 h,停止超声,单纯机械搅拌18 h,然后磁铁辅助分离,去掉反应液,分别用乙醇和二次水各洗涤3次,得到本实验采用的磁性-荧光复合纳米材料。
1.3 细胞材料的获取本实验采用的前列腺癌PC3细胞株来源于第二军医大学长海医院泌尿外科。
本实验所使用的粒细胞取自健康人(已通过同济大学医学院伦理委员会审批),具体提取方法:取静脉血4 mL至肝素管中,混匀防止血凝块。将血液与PBS缓冲液(HyClone公司)等量混合,取适量混合血液加入5层分离液,1 600×g离心20 min分层,取粒细胞层细胞备用。
1.4 磁性-荧光复合纳米材料对粒细胞的毒性检测于96孔板每孔加入5×104粒细胞,使粒细胞分别与磁性-荧光复合纳米材料结合0、0.25、0.5、1.0、1.5、2.0、2.5 h,每组磁性-荧光复合纳米材料结合量分别为0、1、2、3、4、5 μg/mL。最后一组材料结合完成(即结合2.5 h)后,加入10 μL CCK-8,遮光静置1 h,测定其光密度(D)值,与0 h组比较分析结合磁性-荧光复合纳米材料后粒细胞的活性。
1.5 体外结合制备粒细胞靶向介导的磁性-荧光纳米探针24孔板每孔接种5×105粒细胞,设置3组,分别加入5、10、20 μg磁性-荧光复合纳米材料,然后于摇床培养0.25、0.5、1、1.5、2和2.5 h时,荧光显微镜下观察粒细胞与磁性-荧光纳米材料结合情况并拍摄照片。
1.6 体外检测粒细胞靶向介导的磁性-荧光纳米探针对PC3细胞的靶向作用24孔板每孔接种5×105粒细胞,设置6组,均加入20 μg磁性-荧光纳米材料摇床培养15 min后,前4组分别加入5×104、1×105、2×105、5×105 PC3细胞,第5组加入由1.6×105 PC3细胞和1.7×105全血细胞混合而成的模拟血样,第6组加入3.5×105全血细胞,静置培养1 h,荧光显微镜下观察粒细胞靶向介导的磁性-荧光纳米材料靶向PC3细胞情况并拍摄照片。
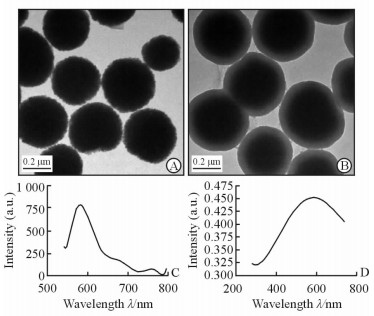
2 结果 2.1 设计并成功制备磁性-荧光复合纳米材料图 1A为合成的Fe3O4内核的透射电镜图,内核为直径300~400 nm的球型颗粒;图 1B为Fe3O4内核包覆SiO2后的透射电镜图,可见Fe3O4外层包覆一层均匀的SiO2,厚度约50 nm。包覆SiO2有利于提高材料的生物相容性,同时也有利于纳米材料的进一步修饰。图 1C所示为负载荧光染料后复合纳米材料的荧光光谱,有典型荧光染料的近红外荧光;图 1D所示为负载荧光染料后的复合纳米材料的紫外-可见吸收光谱,可见其与荧光染料的吸收光谱一致。
|
图 1 磁性-荧光复合纳米材料的特征检测结果 Fig 1 Physical characteristics of magnetic-fluorescent compound nanometer materials A: Transmission electron microscope (TEM) image of Fe3O4; B: TEM image of Fe3O4 coated by SiO2; C: Fluorescence spectrum of the compound nanometer materials; D: Ultraviolet-visible absorption spectrum of the compound nanometer materials |
2.2 磁性-荧光复合纳米材料对粒细胞存活率的影响
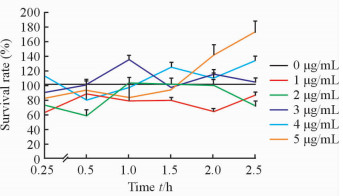
图 2所示为所加磁性-荧光复合纳米材料浓度分别为0、1、2、3、4、5 μg/mL,粒细胞密度为5×104/孔,由此建立的纳米材料与粒细胞存活率的时间、浓度关系;在0.25、0.5、1.0、1.5、2.0、2.5 h时测每一纳米材料浓度下粒细胞的存活率,即可得到与时间梯度相关的结果。在每一时间点、每一浓度下,对比实验组和对照组中粒细胞的存活率,发现结果显示各时间点及浓度下,粒细胞的存活率(排除极值)均在60%以上,表明纳米材料对粒细胞没有明显的毒性作用。
|
图 2 磁性-荧光复合纳米材料对粒细胞存活率的影响 Fig 2 Influence of magnetic-fluorescent compound nanometer materials on survival rate of granulocytes n=36, x±s |
2.3 成功制备粒细胞靶向介导的磁性-荧光纳米探针
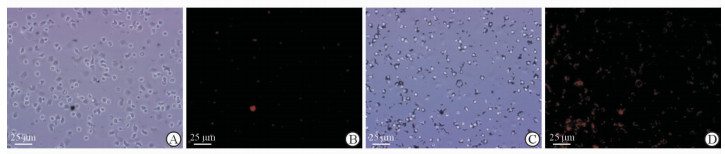
如图 3所示,磁性-荧光复合纳米材料刚加入粒细胞体系中时,可见视野中纳米材料与粒细胞并未结合;磁性-荧光复合纳米材料20 μg与5×105粒细胞37 ℃体外结合15 min后,合成的粒细胞靶向介导的磁性-荧光纳米探针效果最好,此时视野中大部分粒细胞周围都有纳米与之结合。结果表明粒细胞靶向介导的磁性-荧光纳米探针合成成功。
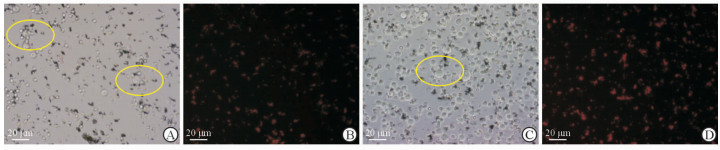
2.4 粒细胞靶向介导的磁性-荧光纳米探针功能的体外检测 2.4.1 纳米探针与PC3细胞体外结合结果如图 4所示,磁性-荧光纳米探针质量与PC3细胞数目的比例为4:1 (纳米材料20 μg,粒细胞5×105,PC3细胞5×104),体外孵育1 h时可见视野中有探针聚集到PC3细胞周围形成“花瓣样”结构;磁性-荧光纳米探针质量与PC3细胞数目的比例为4:7 (纳米材料20 μg,粒细胞5×105,PC3细胞3.5×105),体外孵育1 h时可见视野中同样有探针聚集到PC3细胞周围形成“花瓣样”结构。由此可见,在体外纳米探针与PC3细胞的结合效率很高,二者间的比例差异对“花瓣”结构的形成并无较大影响。
|
图 3 磁性-荧光复合纳米材料与粒细胞的体外结合情况 Fig 3 A, B: 0 min; C, D: 15 min. A, C: Bright field image; B, D: Fluorescence image |
|
图 4 粒细胞靶向介导的磁性-荧光纳米探针与PC3细胞的体外结合情况 Fig 4 In vitro binding of magnetic-fluorescent nanoprobes mediated-targeting by granulocyts with PC3 cells The bright field image (A) and fluorescence image (B) of the "petal-like" structure when the nanoprobes combining with prostate cancer cells in vitro at the ratio of 4:1 (nanometer materials 20 μg, granulocytes 5×105, and PC3 cells 5×104). The bright field image (C) and fluorescence image (D) of the "petal-like" structure when the nanoprobes combining with tumor cells in vitro at the ratio of 4:7 (nanometer materials 20 μg, granulocytes 5×105, and PC3 cells 3.5×105) |
2.4.2 纳米探针在体外与模拟血样及全血结合的结果
将PC3细胞(1.6×105)与全血细胞(1.7×105)混合当做模拟血样,加入磁性-荧光纳米探针(纳米材料20 μg,粒细胞5×105),使得纳米探针质量与模拟血样细胞数目的比例为4:7,上述纳米探针与模拟血样共同孵育1 h时,由镜下照片(图 5A)和荧光照片(图 5B)可见,视野中PC3细胞周围有纳米探针与之结合并形成“花瓣样”结构;同时,为了对照,我们将纳米探针(纳米材料20 μg,粒细胞5×105)加入只有全血细胞的体系中(全血细胞3.5×105)孵育1 h,由图 5C、5D可见,视野中的血细胞周围并未见探针与之结合。由此说明,在同一体系中,此纳米探针能准确地找到肿瘤细胞并与之结合,形成“花瓣样”结构,却不会结合到肿瘤细胞以外的其他细胞,可见此纳米探针的靶向功能具有一定的特异性。
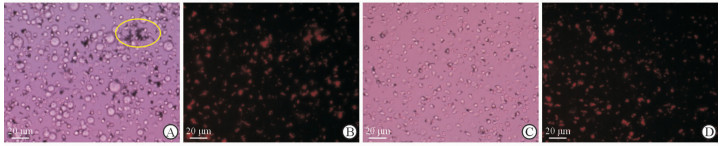
|
图 5 粒细胞靶向介导的磁性-荧光纳米探针与模拟血样及全血的体外结合情况 Fig 5 In vitro binding of magnetic-fluorescent nanoprobes mediated-targeting by granulocytes with simulative and whole blood samples A, B: The bright field image (A) and fluorescence image (B) of the nanoprobes combining with simulative blood samples; C, D: The bright field image (C) and fluorescence image (D) of the nanoprobes combining with whole blood samples |
3 讨论
本实验采用的纳米材料为磁性-荧光复合材料,以Fe3O4为内核,表面包被SiO2和RITC,形成具有磁性且带有红色荧光的纳米探针,这种非对称结构及表面特性的磁性-荧光纳米异质结构具有以下优点:(1) 利用非对称结构的优势,将荧光物质与磁性物质有效分离,避免各功能组分之间相互干扰,真正实现多功能纳米集成系统;(2) 将核磁共振与荧光量子点成像有机融合,多模态成像较单一的分子成像可明显提高检测灵敏度,实现肿瘤早期中痕量肿瘤细胞的检测,利于肿瘤的早期诊断;(3) 容易通过调节荧光量子点的用量,使每一个纳米材料结构内部包覆多个荧光量子点,通过荧光信号的放大进一步提高对早期前列腺癌的检测能力。
本实验最大的创新点在于使用了新型纳米探针靶向方法,即将纳米材料靶向到粒细胞上,借助粒细胞本身对肿瘤细胞的趋化作用,实现探针对肿瘤细胞的检测。粒细胞之所以能够富集到肿瘤细胞周围,是因为肿瘤细胞生长快、代谢率高,其所获得的氧与营养物质通常无法满足肿瘤的生长需求,因此在肿瘤病灶周围常伴有因细胞坏死裂解出的形成浓度梯度的蛋白碎片,这会趋化粒细胞向病灶运动[13-17]。又因为粒细胞表面带正电荷,而肿瘤周围带有负电荷,这一特性可使得粒细胞与靶细胞紧密接触,形成镜下的“花瓣样”结构。也正是利用了粒细胞表面带正电荷这一性质,我们设计出了以Fe3O4为内核、表面包被SiO2和RITC、整体带负电荷的磁性-荧光复合纳米材料,使二者能在电性作用下迅速结合,形成具有磁性且携带红色荧光的生物纳米探针,最终实现对肿瘤细胞的体外检测。
综上,我们所设计的粒细胞靶向介导的磁性-荧光纳米探针带有生物自动导航功能,能够在体外准确地识别并结合到肿瘤细胞周围,并形成“花瓣样”结构,在同一环境中该探针具有对肿瘤细胞识别的特异性,不会结合肿瘤细胞之外的其他细胞;由于纳米异质结构兼具磁性与荧光特性,可以对微小信号进行捕捉和放大,使得探针具有较高的灵敏度。该探针有生物安全性,通过后期的深入探究有望将其应用于临床,实现肿瘤的早期检测与诊断。
| [1] | NORWOOD W D, FUQUA P A, MANCUSO T F. Asbestosan enviromental health hazard[J]. Northwest Med, 1967, 66: 821–828. |
| [2] | POONTHANANIWATKUL B, HOWARD R L, WILLIAMSON E M, LIM R H. Cancer patients taking herbal medicines: a review of clinical purposes, associated factors, and perceptions of benefit or harm[J]. J Ethnopharmacol, 2015, 175: 58–66. DOI: 10.1016/j.jep.2015.08.052 |
| [3] | NYGAARD I. Balancing innovation and harm[J]. Am J Obstet Gynecol, 2014, 210: 383–384. DOI: 10.1016/j.ajog.2014.03.036 |
| [4] | SCHIFFMAN J D, FISHER P G, GIBBS P. Early detection of cancer: past, present, and future[J]. Am Soc Clin Oncol Educ Book, 2015: 57–65. |
| [5] | 王雷, 胡志远. 循环肿瘤细胞纳米检测技术用于肿瘤早期诊断的探索[J]. 中国肿瘤生物治疗杂志, 2016, 23: 595–600. DOI: 10.3872/j.issn.1007-385X.2016.05.002 |
| [6] | MARX V. Tracking metastasis and tricking cancer[J]. Nature, 2013, 494: 131–136. |
| [7] | LA THANGUE N B, KERR D J. Predictive biomarkers: a paradigm shift towards personalized cancer medicine[J]. Nat Rev Clin Oncol, 2011, 8: 587–596. DOI: 10.1038/nrclinonc.2011.121 |
| [8] | 白林灵, 杨延莲, 王琛. 循环肿瘤细胞富集和检测的纳米技术[J]. 生物化学与生物物理进展, 2013, 40: 955–962. |
| [9] | CUI Z, WILLINGHAM M C, HICKS A M, ALEXANDER-MILLER M A, HOWARD T D, HAWKINS G A, et al. Spontaneous regression of advanced cancer: identification of a unique genetically determined, age-dependent trait in mice[J]. Proc Natl Acad Sci USA, 2003, 100: 6682–6687. DOI: 10.1073/pnas.1031601100 |
| [10] | HICKS A M, RIEDLINGER G, WILLINGHAM M C, ALEXANDER-MILLER M A, VON KAP-HERR C, PETTENATI M J, et al. Transferable anticancer innate immunity in spontaneous regression/complete resistance mice[J]. Proc Natl Acad Sci USA, 2006, 103: 7753–7758. DOI: 10.1073/pnas.0602382103 |
| [11] | 崔征. 粒细胞抗癌疗法[M]. 北京: 清华大学出版社, 2011: 24-30. |
| [12] | CHEN B, LE W, WANG Y, LI Z, WANG D, REN L, et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes[J]. Theranostics, 2016, 6: 1887–1898. DOI: 10.7150/thno.16358 |
| [13] | 周雪, 韩俊, 吴一凡, 陈炳地. 纳米技术在肿瘤靶向诊疗中的应用研究进展[J]. 转化医学电子杂志, 2017, 4: 10–15. |
| [14] | LEHRER R I, GANZ T, SZKLAREK D, SELSTED M E. Modulation of the in vitro candidacidal activity of human neutrophil defensins by target cell metabolism and divalent cations[J]. J Clin Invest, 1988, 81: 1829–1835. DOI: 10.1172/JCI113527 |
| [15] | BARTRONS R, CARO J. Hypoxia, glucose metabolism and the Warburg's effect[J]. J Bioenerg Biomembr, 2007, 39: 223–229. DOI: 10.1007/s10863-007-9080-3 |
| [16] | NICKELSEN K. Otto Warburg's first approach to photosynthesis[J]. Photosynth Res, 2007, 92: 109–120. DOI: 10.1007/s11120-007-9163-3 |
| [17] | HÖCKEL M, VAUPEL P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects[J]. Natl Cancer Inst, 2001, 93: 266–276. DOI: 10.1093/jnci/93.4.266 |
 2017, Vol. 38
2017, Vol. 38


