肿瘤的基因治疗正日益受到科学家的普遍关注和重视,如何将基因精准高效地投递到靶细胞进行靶向基因修改就成为制约其应用的关键瓶颈之一[1-3]。传统的方法转染效率较高,但是对技术和设备要求很高,并且只能在皮肤、肌肉等有限的组织中应用,对靶细胞或靶组织也有一定损害,无法在体内进行;病毒载体也存在靶向性差、高免疫原性等缺陷,而且病毒载体的安全性问题也备受争议;以阳离子脂质体(liposome)为代表的非病毒载体克服了病毒载体安全性等问题,但是其血清稳定性差、载体体系组成复杂、结构尺寸分布宽,导致其转染效率偏低,也降低了其临床应用价值。随着近年来纳米技术与生物医学的结合和发展,设计并制备结构简单、形态可控、体内外稳定、转染效率高、特异性靶向的新型非病毒纳米载体投递基因有望实现基因治疗的精准靶向给药[4-6]。
针对肿瘤微环境局部温度偏高的特点[7-8],我们参考文献[9]的方法设计了以温度敏感型高分子聚N-异丙基丙烯酰胺[poly(N-isopropylacrylamide),PNIPAM]为材料,通过与聚乙烯亚胺(polyethyleneimine,PEI)反应形成侧链生长出温敏聚合物的接枝共聚物,然后聚合物在高温条件下自组装为具有“核-壳”结构的PNIPAM/PEI聚阳离子温度敏感型纳米凝胶。纳米凝胶是一类直径为1 nm~1 μm的水凝胶纳米粒子,由于纳米凝胶粒径小、高渗透和滞留(enhanced permeability and retention,EPR)效应强,可以有效地逃避脾滤过,并且可穿过生物膜屏障到达传统药物无法到达的部位;纳米凝胶药物递送系统还可以延长血液循环时间、增加靶组织的累积,从而实现基因的有效递送,并可根据在生物体中所处的环境实现可控释放。同时由于纳米凝胶表面效应大,可通过装载目的基因实现基因的靶向传送与表达。
利用肿瘤细胞表面的特异性高表达分子,通过抗体特异识别抗原的原理,将抗体偶联到纳米载体上是提高肿瘤靶向治疗的一个很好的策略。考虑到人表皮生长因子受体2(human epidermal growth factor receptor-2,Her2) 基因可在约15%~30%的乳腺癌和10%~30%的胃/食管癌扩增或过表达[10-11],且Her2过度表达还可见于卵巢癌、子宫内膜癌、膀胱癌、肺癌、结肠癌等[12-14],我们拟设计在上述温度敏感性的纳米凝胶偶联上针对Her2的抗体,以实现对Her2阳性表达的肿瘤细胞进行主动靶向识别。
本研究中我们利用制备的纳米凝胶作为药物递送系统,递送的目的基因是核糖核苷酸还原酶小亚基M2(ribonucleotide reductase subunit M2,RRM2) 的siRNA(RRM2-siRNA)。RRM2参与调控DNA合成和修复,对细胞分裂、增殖及分化具有重要作用,为肿瘤细胞增殖所必需[15]。肿瘤大数据库分析和临床样本检测表明,RRM2在多种肿瘤中高表达[16],且RRM2表达水平与患者预后呈负相关[17]。因此,RRM2是治疗肿瘤的一个重要靶点。本实验将具有“核-壳”结构的PNIPAM/PEI聚阳离子温度敏感型纳米凝胶通过电荷相互作用与RRM2-siRNA形成PNIPAM/PEI-siRNA纳米凝胶复合体,进一步通过偶联抗-Her2抗体,借助抗体的主动靶向作用和温度敏感性的被动靶向,实现对Her2阳性肿瘤细胞的精准双靶向给药,以提供一种增强抗肿瘤基因治疗效果的纳米靶向治疗策略。
1 材料和方法 1.1 主要试剂和细胞株聚乙烯亚胺(PEI,相对分子质量25 000,美国Sigma-Aldrich公司);N-异丙基丙烯酰胺(NIPAM)、叔丁基过氧化氢(TBHP)和N, N’-亚甲基双丙烯酰胺;正己烷(上海安谱科学仪器有限公司);甲醇、盐酸等(国药集团化学试剂有限公司);异硫氰酸荧光素(FITC,美国Sigma-Aldrich公司);胎牛血清和DMEM培养基(美国Gibco公司);CCK-8试剂盒(日本Dojin化学研究所);巯基化的抗-Her2抗体本研究所自制。人胃癌细胞株NCI-N87购自美国ATCC。
1.2 主要仪器IKA®C-MAG MS7搅拌器(德国IKA公司);精密天平(日本SHIMADZU公司);Confocal(德国Leica公司);Zeta sizer 3000HS激光粒度分析仪(英国Malvern公司);流式细胞仪(美国Becton Dickinson公司);Olympus Ⅸ71荧光显微镜(日本Olympus公司);IVIS®Lumina Ⅱ小动物活体成像仪(美国Caliper公司);Leica CM1850冷冻切片机(德国Leica公司)。
1.3 纳米凝胶的制备PNIPAM/PEI聚阳离子温度敏感型纳米凝胶的制备工艺采用活性自由基聚合(RAFT)和开环聚合(ROP)法。精密称取0.8 g PEI和0.6 g NIPAM晶体溶解到50 mL PBS,用盐酸调pH至7并搅拌混匀;向体系中加入TBHP封闭环境下继续反应4 h;收集制备的凝胶,于37 ℃用高速冷冻离心机纯化凝胶,15 000×g离心15 min;取30 mL MilliQ-water重新溶解凝胶沉淀,即得PNIPAM/PEI聚阳离子纳米凝胶。
1.4 纳米凝胶表征的测定 1.4.1 凝胶的形态分析采用透射电子显微镜(TEM)观察纳米凝胶的形态。TEM样品准备:在铜网上面滴1滴纳米凝胶溶液,然后用2%磷钨酸(PTA)染色,待干。用Hitachi H-600 TEM(加压到75 kV)检测并拍照。
1.4.2 粒径分布及电位测定采用激光粒度分析仪考察纳米凝胶的粒径分布及电位大小。将新制备的纳米凝胶溶液加入适量的水稀释。由于纳米凝胶的浓度对粒径的测定结果有一定影响,稀释倍数以1 mg/mL为准计算,稀释后取80 μL置于样品池中进行粒径分布及电位测定。
1.4.3 纳米凝胶的生物相容性用CCK-8试剂盒检测PNIPAM/PEI纳米凝胶对细胞增殖的影响,评价纳米凝胶载体的生物相容性。选取对数生长期的NCI-N87细胞株以每孔5 000个细胞在96孔板铺板过夜培养,用含10 %胎牛血清的细胞培养液分别稀释PNIPAM/PEI纳米凝胶、PNIPAM、PEI至不同浓度,然后每孔100 μL加入96孔板,继续培养24 h后吸弃原培养液,PBS洗2次,加入新配制的CCK-8检测液,孵育2 h后使用酶标仪在450 nm处分别读取样品孔和对照孔的光密度(D)值,计算细胞存活率。
1.5 PNIPAM/PEI-siRNA纳米凝胶复合体的制备 1.5.1 PNIPAM/PEI纳米凝胶包裹siRNA形成凝胶复合体将PNIPAM/PEI纳米凝胶用去离子水稀释,分别与RRM2-siRNA按N/P(聚阳离子纳米凝胶中氨基与质粒DNA中磷酸基的摩尔比)为5、15、30、60、75和120混合均匀,室温静置4 h,得到PNIPAM/PEI-siRNA纳米凝胶复合体。
1.5.2 电泳分析PNIPAM/PEI-siRNA纳米凝胶复合体用琼脂糖凝胶电泳阻滞实验对制备出的不同N/P(5、15、30、60、75、120) 的PNIPAM/PEI-siRNA纳米凝胶复合体,点样电泳,确定最佳包裹比例。然后根据最佳的包裹比例,进行RNase诱导的解聚稳定性测试:取凝胶复合体N/P为75、60、30的样品,加入RNase 37 ℃酶切5 min,70 ℃终止酶切,将样品均分为2份,一份为RNase酶切样品,另外一份加入肝素钠解聚,点样电泳。
1.6 纳米凝胶复合体的靶向抗体修饰将PNIPAM/PEI-siRNA纳米凝胶复合体与巯基化的抗-Her2抗体混匀,室温静置6 h后,将溶液置于相对分子质量为300 000的透析膜透析以除去游离抗体,实现纳米凝胶复合体靶向抗体的修饰。同时制备用小牛血清白蛋白(BSA)修饰包裹siRNA的非靶向纳米凝胶复合体,方法同上。
1.7 靶向纳米凝胶复合体的细胞内吞实验用包裹荧光素FAM标记siRNA(FAM-siRNA)的靶向纳米凝胶复合体转染NCI-N87细胞,用荧光显微镜定性观察转染情况;流式细胞术定量检测细胞对纳米凝胶内吞情况,并验证其温度敏感性。以每孔为5×104个NCI-N87细胞在48孔板铺板过夜培养。然后用包裹500 nmol/L FAM-siRNA的靶向纳米凝胶复合体(FAB-nanogel组)转染细胞24 h,分别置于37 ℃、42 ℃孵箱孵育。设置对照组为连接BSA的包裹FAM-siRNA的非靶向纳米凝胶复合体(BSA-nanogel组)。然后吸弃细胞培养液,用胰酶消化,流式洗脱液处理后,用流式细胞术定量检测平均荧光强度。
1.8 qPCR检测靶向纳米凝胶复合体对RRM2基因沉默的影响选取对数生长期的NCI-N87细胞株以每孔1×105个细胞在24孔板铺板过夜培养,分别用包裹RRM2-siRNA的靶向纳米凝胶复合体(FAB-nanogel-RRM2-siRNA组)、包裹有随机阴性对照siRNA序列(Neg-siRNA)的靶向纳米凝胶复合体(FAB-nanogel-neg-siRNA组)、连接BSA蛋白的包裹RRM2-siRNA的非靶向纳米凝胶复合体(BSA-nanogel-RRM2-siRNA组)、连接BSA蛋白的包裹Neg-siRNA的非靶向纳米凝胶复合体(BSA-nanogel-neg-siRNA组)转染细胞,分别置于37 ℃、42 ℃孵箱孵育。用TRIzol法提取总RNA,并反转录成cDNA,进行qPCR反应,并以GAPDH基因作为内参,检测RRM2基因的表达情况。引物序列:RRM2 Forward 5′-GAU UUA GCC AAG AAG UUC AGA-3′、Reverse 5′-UGA ACU UCU UGG CUA AAU CGC-3′,GAPDH Forward 5′-AAG GTG AAT CGG AGT CAA-3′、Reverse 5′-AAT GAA GGG GTC ATT GAT GG-3′。
1.9 Transwell实验观察靶向纳米凝胶复合体对肿瘤细胞迁移的影响选取对数生长期的NCI-N87细胞株,消化重悬。在24孔板下室加入600 μL的细胞培养液。Transwell小室加入250 μL含细胞培养液稀释的包裹有50 nmol/L RRM2-siRNA的靶向纳米凝胶复合体(FAB-nanogel-RRM2-siRNA组)或连接BSA蛋白的包裹FAM-siRNA的非靶向纳米凝胶复合体(BSA-nanogel组)的细胞悬液,分别置于37 ℃、42 ℃孵箱培养。转染24 h后,取出Transwell小室,弃去孔中培养液,用PBS洗2次,甲醇固定30 min,将小室适当风干。用龙胆紫染色,并轻轻用棉签擦去上层未迁移的细胞,再用PBS洗2次。用显微镜观察细胞迁移的情况。
1.10 统计学处理采用Excel进行数据处理,实验数据以x±s表示,两样本均数比较采用t检验。检验水准(α)为0.05。
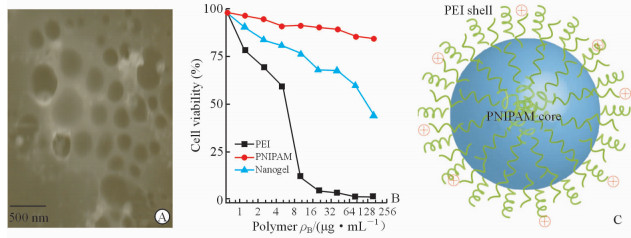
2 结果 2.1 纳米凝胶的表征 2.1.1 纳米凝胶的形态分析及生物相容性如图 1A TEM图片所示,本实验制备的PNIPAM/PEI聚阳离子纳米凝胶为“核-壳”结构,呈规整的球形,无粘连,分散性好,分布均一,大小较为均匀。由图 1B可见,PNIPAM/PEI聚阳离子纳米凝胶具有良好的生物相容性,低毒,具备良好载体的特征。图 1C所示为PNIPAM/PEI聚阳离子纳米凝胶示意图:PNIPAM为内核、PEI为壳的“核-壳”结构。
|
图 1 纳米凝胶透射电镜图(A)、生物相容性(B)和“核-壳”结构示意图(C) Fig 1 Transmission electron microscope image (A), biocompatibility (B) and core-shell structure diagram (C) of nanogel A: Morphology of temperature-responsive and polycationic PNIPAM/PEI nanogel by transmission electron microscope (TEM); B: Viability of NCI-N87 cells cultured with PNIPAM/PEI nanogel; C: Schematic diagram of the core-shell structure. PEI: Polyethyleneimine; PNIPAM: Poly(N-isopropyl acrylamide) |
2.1.2 粒径分布及电位
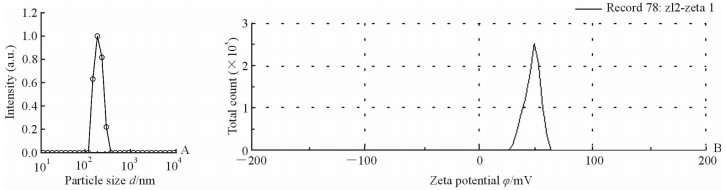
如图 2A所示,采用纳米粒度仪测得粒径为359.8 nm,粒径较小,分散性良好,有助于以纳米级别在体内通过EPR效应在肿瘤部位富集。图 2B为采用纳米粒度仪测得的纳米粒子的zeta电位呈正电,为21.4 mV, 利于与siRNA结合形成稳定的“凝胶-siRNA”复合体,更好地保护siRNA不受机体血浆或组织细胞中各种补体或其他酶类的攻击而被降解,从而有利于目的基因进入靶细胞后能更高效、更稳定地发挥作用。
|
图 2 纳米凝胶的粒径分布(A)及电位大小(B) Fig 2 Particle size distribution (A) and zeta potential (B) of nanogel |
2.2 纳米凝胶PNIPAM/PEI包裹siRNA形成PNIPAM/PEI-siRNA复合体
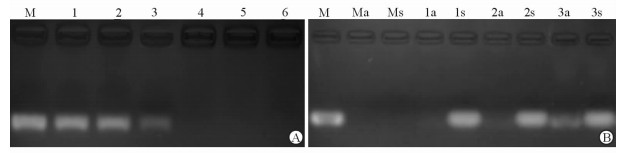
如图 3A所示,不同N/P(5、15、30、60、75、120) 纳米凝胶PNIPAM/PEI-siRNA复合体对siRNA的包裹效果不同,随着N/P的增加凝胶结合siRNA的比例也相应增加,当N/P达60时,siRNA几乎完全结合到纳米凝胶上。如图 3B所示,取凝胶复合体N/P为75、60的样品加入RNase酶切,由于纳米凝胶对siRNA有保护作用,故1a、2a泳道未见siRNA的渗漏,仍保持完整性;在肝素钠解聚后,则在1s、2s泳道重新出现条带,说明该纳米载体能够较好地释放。
|
图 3 不同N/P的包裹siRNA聚阳离子纳米凝胶的电泳结果(A)和酶切保护与释放结果(B) Fig 3 Electrophoresis (A) and protection and release (B) results of siRNAs packed in nanogels with different N/P ratios In Fig 3A, M: Naked siRNA control; 1: N/P=5; 2: N/P=15; 3: N/P=30; 4: N/P=60; 5: N/P=75; 6: N/P=120. In Fig 3B, M: Naked siRNA control; 1: N/P=75; 2: N/P=60; 3: N/P=30; a: Samples treated with RNase; s: Samples treated with heparin. N/P: Ratio of nitrogen-from-polycationic nanogel to phosphate-from-DNA of plasmid |
2.3 靶向纳米凝胶复合体的细胞内吞结果
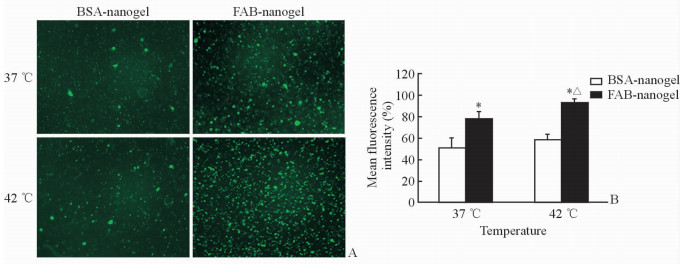
采用定性和定量的方法研究纳米粒子的体外细胞摄取,图 4A为荧光显微镜观察NCI-N87细胞对靶向纳米凝胶复合体的内吞结果,由图可见,FAB-nanogel组随着培养温度的增加细胞内吞的靶向纳米凝胶复合体的荧光增强,高于BSA-nanogel组。图 4B为用流式细胞仪定量研究NCI-N87细胞对纳米粒子的摄取,结果与上述定性分析保持一致,这说明抗-Her2介导的主动靶向性促进了肿瘤细胞的内吞,而且纳米凝胶呈现较好的温度响应性。
|
图 4 靶向纳米凝胶复合体转染细胞具有抗体靶向性及温度敏感性 Fig 4 Antibody targeting and temperature sensitive transfection of siRNA by our designed nanogel A: Immunofluorescence pictures, siRNAs were labeled by FAM; B: Statistical results of transfection efficiency by cytoflowmetry. *P < 0.05 vs BSA-nanogel group at the same temperature; △P < 0.05 vs FAB-nanogel group at 37 ℃. Original magnification: ×200 (A). n=3, x±s |
2.4 靶向纳米凝胶复合体对靶基因RRM2表达的影响
以GAPDH基因作为内参,采用qPCR方法检测RRM2基因的表达。由图 5可以看出,包裹RRM2-siRNA的非靶向纳米凝胶复合体(BSA-nanogel-RRM2-siRNA组)在37 ℃使RRM2基因表达下调到BSA-nanogel-neg-siRNA组的79.45%,42 ℃下调到该组的52.89%,差异均有统计学意义(P<0.05);包裹RRM2-siRNA的靶向组纳米凝胶复合体(FAB-nanogel-RRM2-siRNA组)在37 ℃使RRM2基因表达下调到FAB-nanogel-neg-siRNA组的45.72%,42 ℃下调到该组的27.63%,差异均有统计学意义(P<0.05)。由此可见,包裹RRM2-siRNA的靶向纳米凝胶复合体可以使RRM2基因表达降低,且具有温度响应性(在42 ℃时下调较37 ℃更明显,P<0.05)。
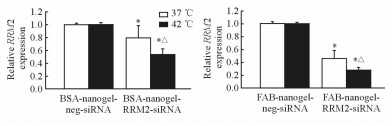
|
图 5 体外实验检测RRM2沉默效率 Fig 5 Efficiency of RRM2 interference by nanogel-siRNA complex in NCI-N87 cells A, B: 37 ℃; C, D: 42 ℃. RRM2: Ribonucleotide reductase subunit M2. *P < 0.05 vs neg-siRNA group; △P < 0.05 vs 37 ℃. n=3, x±s |
2.5 靶向纳米凝胶复合体对NCI-N87细胞迁移的影响
如图 6所示,包裹siRNA的靶向纳米凝胶复合体可以降低肿瘤细胞的迁移能力,且相对于正常体温环境的37 ℃,在42 ℃肿瘤模拟环境中纳米凝胶复合体对NCI-N87细胞迁移的抑制作用更加明显,说明该复合体具有温度响应性。同时该纳米凝胶复合体的抗肿瘤迁移效应也具有抗体靶向性,因为相对于没有偶联抗体的纳米凝胶(偶联BSA,BSA-nanogel),偶联了抗体的纳米凝胶复合体(FAB-nanogel-RRM2-siRNA)更有效地抑制了NCI-N87细胞的迁移。
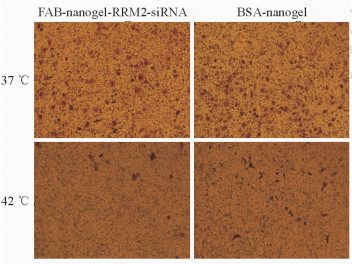
|
图 6 包裹RRM2-siRNA纳米凝胶对NCI-N87细胞迁移的抑制作用 Fig 6 Tumor migration suppressing effect of the nanogel complex by RRM2 interference in NCI-N87 cells RRM2: Ribonucleotide reductase subunit M2. Original magnification: ×200 |
3 讨论
本研究采用自由基接枝共聚合反应的方法制备具有“核-壳”结构的PNIPAM/PEI聚阳离子温度敏感型纳米凝胶,并测得粒径为359.8 nm,粒径较小,有助于在纳米级别通过EPR效应在肿瘤部位富集,具备良好的生物相容性,可以作为递送载体;zeta电位21.4 mV,呈正电,利于与siRNA结合,通过电荷作用可以包裹RRM2-siRNA,形成稳定的“凝胶-siRNA”复合体,更好地保护siRNA不受机体血浆或组织细胞中各种补体以及其他酶类的攻击而降解,从而有利于目的基因进入靶细胞后能更高效、更稳定地发挥作用。细胞膜表面呈负电,带正电的纳米凝胶的细胞内吞明显加快,表现出纳米凝胶良好的被动靶向性。该纳米凝胶通过抗体的主动靶向修饰,形成具有抗体主动靶向性的纳米凝胶复合体;通过定性和定量分析了该复合体不同温度下(37 ℃和42 ℃)的细胞内吞,可见该纳米凝胶复合体具有良好的抗体主动靶向性和温度响应性。并且该靶向性的纳米凝胶复合体还可以通过siRNA发挥基因治疗的作用,通过体外实验发现其可以下调靶基因RRM2的表达和抑制Her2表达阳性的肿瘤细胞(NCI-N87细胞)的迁移。在后续实验中,我们将对其体内抗肿瘤活性进一步的探究。
纳米凝胶复合体由于EPR效应在肿瘤部位富集,并通过抗体介导的内吞作用靶向性地进入肿瘤细胞,到达溶酶体后,由于胞内溶酶体的pH低于6,强酸性条件引起了纳米凝胶复合体表面PEI的质子化,导致链伸展。质子化后的PEI外壳对核酸药物的物理包覆能力减弱,并促使溶酶体膜破裂,释放包裹的siRNA发挥靶向基因治疗作用。其具体的作用机制如图 7所示,通过主、被动靶向协同作用的纳米凝胶递送系统可以有效地提高药物运输效率并增强治疗效果。所以,基于纳米颗粒的药物投递系统可以提高肿瘤治疗的效率[18],有如下几个方面优势:(1) 位点特异性地投递药物或基因等;(2) 具有更好的体外和体内稳定性;(3) 减少不良反应及具有对药物释放的可控性。而且,随着纳米载体工程技术的发展,纳米载体的结构可被很好地修饰,如抗体修饰纳米颗粒可以实现主动靶向的目的。综上所述,本研究所制备的具有温度响应性和抗体靶向的“核-壳”结构纳米凝胶具有主、被动协同靶向性能,可以通过包裹、共价连接或吸附化疗药物或者核酸药物,实现靶向特异输送核酸药物到达肿瘤细胞和肿瘤组织,减少不良反应的发生,是良好的肿瘤基因治疗给药递送载体,具有良好的临床基因治疗应用价值。

|
图 7 纳米凝胶复合体作用机制示意图 Fig 7 Schematic diagram of mechanism of nanogel complex Her2: Human epidermal growth factor receptor-2; RRM2: Ribonucleotide reductase subunit M2; RISC: RNA-induced silencing complex |
| [1] | NALDINI L. Gene therapy returns to centre stage[J]. Nature, 2015, 526: 351–360. DOI: 10.1038/nature15818 |
| [2] | BRENNER M K, GOTTSCHALK S, LEEN A M, VERA J F. Is cancer gene therapy an empty suit?[J]. Lancet Oncol, 2013, 14: 447–456. DOI: 10.1016/S1470-2045(13)70124-4 |
| [3] | CONG L, ZHANG F. Genome engineering using CRISPR-Cas9 system[M]//Chromosomal mutagenesis. Springer New York, 2015: 197-217. |
| [4] | ROY P, NOAD R. Virus-like particles as a vaccine delivery system: myths and facts[J]. Adv Exp Med Biol, 2009, 655: 145–158. DOI: 10.1007/978-1-4419-1132-2 |
| [5] | LI W, ZHANG L, ZHANG G, WEI H, ZHAO M, LI H, et al. The finely regulating well-defined functional polymeric nanocarriers for anti-tumor immunotherapy[J]. Mini Rev Med Chem, 2013, 13: 643–652. DOI: 10.2174/1389557511313050003 |
| [6] | LI W, GUO Q, ZHAO H, ZHANG L, LI J, GAO J, et al. Novel dual-control poly(N-isopropylacrylamide-co-chlorophyllin) nanogels for improving drug release[J]. Nanomedicine (Lond), 2012, 7: 383–392. DOI: 10.2217/nnm.11.100 |
| [7] | ZHANG C, NI D, LIU Y, YAO H, BU W, SHI J. Magnesium silicide nanoparticles as a deoxygenation agent for cancer starvation therapy[J]. Nat Nanotechnol, 2017, 12: 378–386. DOI: 10.1038/nnano.2016.280 |
| [8] | AL-AHMADY Z, KOSTARELOS K. Chemical components for the design of temperature-responsive vesicles as cancer therapeutics[J]. Chem Rev, 2016, 116: 3883–3918. DOI: 10.1021/acs.chemrev.5b00578 |
| [9] | MA M, ZHANG Q, DOU J, ZHANG H, GENG W, YIN D, et al. Fabrication of 1D Fe3O4/P(NIPAM-MBA) thermosensitive nanochains by magnetic-field-induced precipitation polymerization[J]. Colloid Polym Sci, 2012, 290: 1207–1213. DOI: 10.1007/s00396-012-2696-9 |
| [10] | HARPER K L, SOSA M S, ENTENBERG D, HOSSEINI H, CHEUNG J F, NOBRE R, et al. Mechanism of early dissemination and metastasis in Her2+ mammary cancer. Nature, 2016. doi: 10.1038/nature20609.. |
| [11] | BARTLEY A N, WASHINGTON M K, COLASACCO C, VENTURA C B, ISMAILA N, BENSON A B 3rd, et al. HER2 testing and clinical decision making in gastroesophageal adenocarcinoma: guideline from the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology[J]. J Clin Oncol, 2017, 35: 446–464. |
| [12] | SANOFF H K. Targeting HER2 beyond progression in gastroesophageal cancer[J]. Lancet Oncol, 2017, 18: 562–564. DOI: 10.1016/S1470-2045(17)30102-X |
| [13] | BOKU N. HER2-positive gastric cancer[J]. Gastric Cancer, 2014, 17: 1–12. DOI: 10.1007/s10120-013-0252-z |
| [14] | LEEHOEFLICH S T, CROCKER L, YAO E, PHAM T, MUNROE X, HOEFLICH K P, et al. A central role for HER3 in HER2-amplified breast cancer: implications for targeted therapy[J]. Cancer Res, 2008, 68: 5878–5887. DOI: 10.1158/0008-5472.CAN-08-0380 |
| [15] | PFISTER S X, MARKKANEN E, JIANG Y, SARKAR S, WOODCOCK M, ORLANDO G, et al. Inhibiting WEE1 selectively kills histone H3K36me3-deficient cancers by dNTP starvation[J]. Cancer Cell, 2015, 28: 557–568. DOI: 10.1016/j.ccell.2015.09.015 |
| [16] | DUXBURY M S, WHANG E E. RRM2 induces NF-κB-dependent MMP-9 activation and enhances cellular invasiveness[J]. Biochem Biophys Res Commun, 2007, 354: 190–196. DOI: 10.1016/j.bbrc.2006.12.177 |
| [17] | RASMUSSEN R D, GAJJAR M K, TUCKOVA L, JENSEN K E, MAYA-MENDOZA A, HOLST C B, et al. BRCA1-regulated RRM2 expression protects glioblastoma cells from endogenous replication stress and promotes tumorigenicity[J]. Nat Commun, 2016, 7: 13398. DOI: 10.1038/ncomms13398 |
| [18] | ZOLNIK B S, GONZAÁLEZ-FERNAÁNDEZ Á, SADRIEH N, DOBROVOLSKAIA M A. Nanoparticles and the immune system[J]. Endocrinology, 2010, 151: 458–465. DOI: 10.1210/en.2009-1082 |
 2017, Vol. 38
2017, Vol. 38


