2. 上海交通大学药学院药物分析实验室, 上海 200240;
3. 上海中医药大学中医方证与系统生物学研究中心, 上海 201203;
4. 第二军医大学东方肝胆外科医院肝外一科, 上海 200438;
5. 第二军医大学东方肝胆外科医院分子肿瘤实验室, 上海 200438
2. Laboratory of Pharmaceutical Analysis, School of Pharmacy, Shanghai Jiaotong University, Shanghai 200240, China;
3. Center for Traditional Chinese Medicine and Systems Biology, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
4. Department of Hepatic Surgery (Ⅰ), Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
5. Molecular Oncology Laboratory, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
淫羊藿(Epimedium brevicornu Maxim.)来源于小檗科淫羊藿属的多种植物,药用历史悠久,《本草纲目》称其有“益精气,坚筋骨,补腰膝,强心力”之功效。目前我国有40多种淫羊藿属植物,资源丰富,占全球总量一半以上,主要分布在四川、贵州、湖北和辽宁等地[1]。黄酮类物质和多糖是淫羊藿最主要的活性成分[2],其中某些产地的淫羊藿总黄酮含量已超过10%[3]。淫羊藿素(icaritin)是由淫羊藿中提取的黄酮类单体化合物, 相对分子质量为368。已被证实具有抗骨质疏松[4-5]、抗肿瘤[6-7]、类雌激素[8-9]及调控细胞增殖分化[10-11]等作用,近年来在其抗氧化功效的研究方面也取得了一些进展[12-13]。
本研究通过建立大鼠70%肝脏缺血再灌注(ischemia/reperfusion, I/R)损伤模型并制备淫羊藿素脂质体,采用损伤前药物预处理的实验方式,探讨淫羊藿素对于大鼠肝脏I/R损伤的保护作用及相关机制,为把淫羊藿素脂质体开发成新型有效的防治肝脏I/R损伤的药物提供实验依据。
1 材料和方法 1.1 实验对象及试剂健康雄性SD大鼠,体质量250~280 g,购自第二军医大学实验动物中心,动物生产许可证号:SCXK(沪)2007-0003。手术前12 h禁食,不禁水。淫羊藿素粉剂(纯度≥98%)购自上海友思生物科技有限公司,大豆磷脂(S80,纯度≥97%)购自上海太伟制药有限公司,胆固醇(纯度≥95%)购自河南省平顶山市东珠生物制品有限公司,α-生育酚(纯度≥90%,生物效价≥1 400 IU/g)购自浙江新昌制药股份有限公司。其余试剂为国产分析纯。TUNEL检测试剂盒(KGA-701) 购自Roche公司,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide, NO)、一氧化氮合酶(nitric oxide synthase, NOS)及髓过氧化物酶(myeloperoxidase, MPO)试剂盒均购自南京建成生物研究所。
1.2 淫羊藿素脂质体的制备采用薄膜分散法[14]制备淫羊藿素脂质体。对磷脂用量、胆固醇用量、有机相种类、药物与磷脂质量比、磷酸盐缓冲液pH值及浓度和α-生育酚用量等处方内容进行单因素考察;为获得最佳的包封率和最高的载药量,对影响脂质体性状的工艺条件进行单因素考察,主要内容包括茄形瓶斜度、旋转速度、有机溶剂挥发速度、超声、剪切时间及循环次数。根据以上考察结果,筛选出优化处方如下:淫羊藿素10 mg,大豆卵磷脂200 mg,胆固醇25 mg,α-生育酚10 mg,0.05 mol/L PBS (pH 5.0)。3批样品测定结果(标示量)分别为102.1%、100.6%、98.2%,相对标准偏差(RSD)分别为0.69%、0.41%、1.28%,淫羊藿素脂质体的药物包封率为88.56%。
1.3 实验分组及标本采集SD大鼠120只,随机分成淫羊藿素脂质体+I/R损伤(ICT+I/R)组、空白脂质体+I/R损伤(LIP+I/R)组、单纯I/R损伤(I/R)组和假手术(Sham)组,每组30只。各组再随机分成2 h和6 h两个亚组,每亚组15只。所有大鼠均用10%水合氯醛0.3 g/kg腹腔注射,麻醉成功后,腹部正中切口进腹。参考Tsung等[15]的方法建立大鼠肝脏I/R损伤模型,用无损伤血管夹夹闭肝左叶和肝中叶入肝血管阻断血流(70%肝脏缺血)60 min,然后松开血管夹恢复血流。阻断血流前10 min,ICT+I/R组由门静脉注射淫羊藿素脂质体1.5 mg/kg,LIP+I/R组注射等体积的空白脂质体。I/R组仅建立大鼠肝脏I/R损伤模型,Sham组仅游离肝门而不阻断血流,两组均不进行药物预处理。
血流恢复2 h和6 h后,打开腹腔,进行以下操作:(1) 经由下腔静脉抽取静脉血1 mL,用于检测血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)水平;(2) 取肝左外叶,液氮处理后放入-80 ℃冰箱保存,用于检测MDA、NO含量及SOD、NOS、诱导型NOS(iNOS)、内皮型NOS(eNOS)、MPO活性;(3) 剪下肝中叶,置于10%的中性甲醛溶液中固定24 h,按常规操作进行脱水、透明、浸蜡及包埋等处理,制成石蜡组织切片,用于组织形态学观察和细胞凋亡检测。血液及肝组织标本采集完毕后,剪开下腔静脉和腹主动脉,放血处死大鼠。
1.4 血清标本检测血样抽取后的24 h内以7600全自动生化分析仪(Hitachi公司)测定血清ALT、AST。
1.5 肝组织标本检测取肝组织0.2 g在4 ℃0.86%的生理盐水中漂洗,除去血液,干净的滤纸拭干,称量,置于9倍体积的预冷匀浆介质(0.86%生理盐水)中,剪碎肝组织,进行冰浴匀浆。按照南京建成生物工程研究所提供的试剂盒说明书,采用比色法对肝组织样本中SOD、MDA、NO、NOS、iNOS、eNOS以及MPO含量进行检测。
1.6 组织形态学观察使用苏木精-伊红(H-E)染色法对石蜡组织切片进行染色,并在200倍显微镜(奥林巴斯BX41) 下进行组织形态学观察。
1.7 肝细胞凋亡观察及凋亡指数(apoptosis index, AI)测定采用TUNEL法对肝组织石蜡切片进行染色,镜下观察,细胞核棕色的为阳性细胞(凋亡细胞)。每张切片观察10个400倍视野,每个视野选取100个细胞,其中阳性细胞占总细胞的比值即为AI。
1.8 统计学处理应用SPSS 16.0软件进行统计分析,数据以x±s表示,组间差异的比较采用双因素方差分析,两两比较采用Dunnet-t检验。检验水准(α)为0.05。
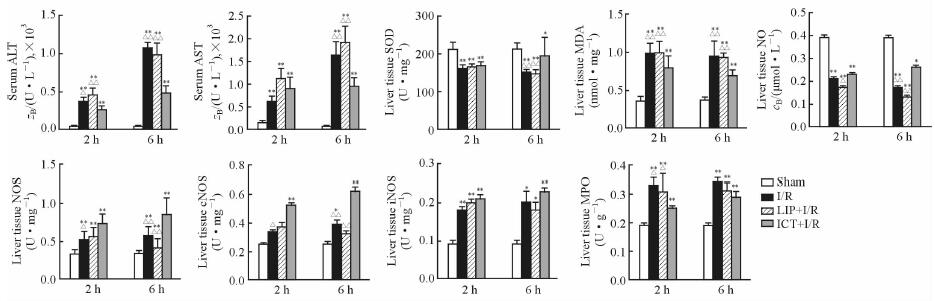
2 结果 2.1 淫羊藿素脂质体对大鼠肝脏I/R损伤后血清ALT、AST的影响由图 1可见,造模后,I/R、LIP+I/R、ICT+I/R各组血清ALT、AST水平均明显上升,与Sham组比较差异有统计学意义(P<0.01)。说明大鼠肝脏I/R损伤后肝细胞受到损伤。ICT+I/R组血清ALT水平在再灌注2 h和6 h均较LIP+I/R组、I/R组下降(P<0.05,P<0.01),ICT+I/R组的血清AST水平在再灌注2 h时与LIP+I/R组、I/R组比较差异无统计学意义,但在再灌注6 h时较LIP+I/R组、I/R组明显下降(P<0.01)。说明给予淫羊藿素脂质体能够减轻大鼠肝脏I/R后肝细胞损伤。
|
图 1 各组大鼠再灌注2 h和6 h血清ALT、AST和肝组织中氧化应激指标的变化 Fig 1 Serum ALT and AST levels and liver tissue oxidative indices at 2 h and 6 h of reperfusion in rats of each group ALT: Alanine aminotransferase; AST: Aspartate aminotransferase; SOD: Superoxide dismutase; MDA: Malondialdehyde; NO: Nitric oxide; NOS: Nitric oxide synthase; iNOS: Inducible NOS; eNOS: Endothelial NOS; MPO: Myeloperoxidase; I/R: Ischemia/reperfusion; ICT: Icaritin liposome; LIP: Vechicle liposome. *P < 0.05, **P < 0.01 vs Sham group; △P < 0.05, △△P < 0.01 vs ICT+I/R group. n=15, x±s |
2.2 淫羊藿素脂质体对大鼠肝脏I/R损伤后肝组织中氧化应激指标的影响
由图 1可见,造模后,I/R、LIP+I/R、ICT+I/R各组肝组织中MDA含量及NOS、iNOS、MPO活性均明显上升,SOD活性、NO含量明显下降,与Sham组比较差异均有统计学意义(P<0.05,P<0.01)。再灌注2 h后ICT+I/R和再灌注6 h后I/R组、ICT+I/R组eNOS活性与Sham组相比差异有统计学意义(P<0.05,P<0.01)。
ICT+I/R组肝组织SOD活性在再灌注2 h时与LIP+I/R组、I/R组比较差异无统计学意义,在再灌注6 h时高于LIP+I/R组和I/R组(P<0.01)。ICT+I/R组肝组织MDA含量在再灌注2 h和6 h时较LIP+I/R组、I/R组均下降(P<0.01)。再灌注2 h时,ICT+I/R组肝组织NO含量较LIP+I/R组上升(P<0.05),但和I/R组相比差异无统计学意义(P>0.05);再灌注6 h时,ICT+I/R组NO含量高于LIP+I/R组和I/R组(P<0.01)。
再灌注2 h时,ICT+I/R组的NOS活性较I/R组增加(P<0.05),但与LIP+I/R组比较差异无统计学意义;ICT+I/R组iNOS活性与LIP+I/R组和I/R组相比差异无统计学意义。再灌注6 h时,ICT+I/R组肝组织NOS和eNOS活性高于LIP+I/R组、I/R组(P<0.01),而iNOS活性在3组之间差异无统计学意义。
再灌注2 h时,ICT+I/R组的肝组织MPO活性较LIP+I/R组、I/R组均减少(P<0.05);再灌注6 h时,3个损伤组之间MPO活性差异均无统计学意义。
以上结果说明大鼠肝脏缺血再灌注损伤后肝组织受到氧化应激损伤,抗氧化能力减弱,而给予淫羊藿素脂质体对大鼠肝脏缺血再灌注损伤后肝组织氧化应激损伤具有一定的抵抗作用。
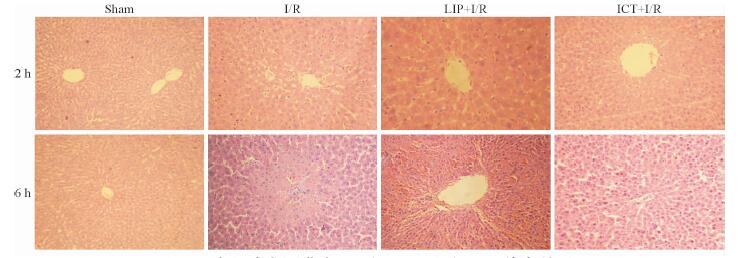
2.3 淫羊藿素脂质体对大鼠肝脏I/R损伤后肝组织病理形态学的影响由图 2可见,Sham组大鼠肝脏无病理损伤表现。I/R组再灌注2 h时,镜下基本无肝小叶结构,可见肝细胞片状坏死和明显的炎症细胞浸润;再灌注6 h时,可见被破坏的肝小叶结构、残缺的肝细胞索和多个片状坏死区。LIP+I/R组再灌注2 h时,镜下可见模糊的肝小叶结构,中心静脉、肝血窦内可见充血,大量空泡形成,有较明显的炎症细胞浸润;再灌注6 h时,镜下见较明显的肝窦充血,炎症细胞浸润广泛,局部出现嗜酸性染色较深的肝细胞。ICT+I/R组再灌注2 h时,镜下有完整的肝小叶结构,局部可见少量空泡形成,肝血窦内有炎症细胞浸润;再灌注6 h时,肝小叶结构模糊,可见明显充血的中心静脉,呈现中等程度的炎症细胞浸润。以上结果说明给予淫羊藿素脂质体后,大鼠肝组织损伤明显减轻。
|
图 2 各组大鼠再灌注2 h和6 h肝组织H-E染色结果 Fig 2 H-E staining at 2 h and 6 h of reperfusion in rat liver of each group I/R: Ischemia/reperfusion; ICT: Icaritin liposome; LIP: Vechicle liposome. Original magnification: ×200 |
2.4 淫羊藿素脂质体对大鼠肝脏I/R损伤后肝细胞凋亡的影响
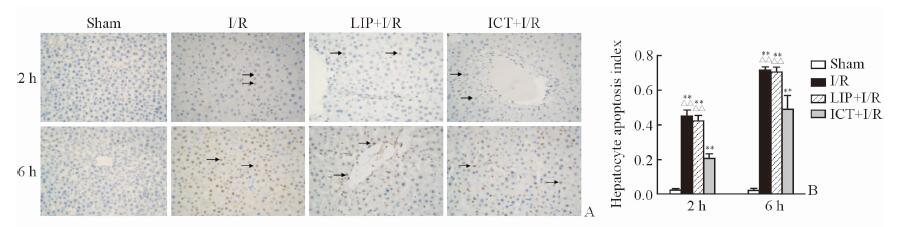
由图 3可见,大鼠肝脏缺血再灌注2 h、6 h,I/R、LIP+I/R、ICT+I/R组肝组织中均出现较明显的凋亡细胞。ICT+I/R组的肝细胞AI较LIP+I/R组、I/R组均降低,差异有统计学意义(P<0.01)。说明给予淫羊藿素脂质体能减少大鼠肝脏I/R损伤后肝细胞凋亡。
|
图 3 各组大鼠再灌注2 h和6 h肝脏组织TUNEL染色结果(A)及凋亡指数(B) Fig 3 TUNEL staining (A) and apoptosis index (B) at 2 h and 6 h of reperfusion in rat liver of each group IR: Ischemia/reperfusion; ICT: Icaritin liposome; LIP: Vechicle liposome. Arrows indicate apoptotic cells. Original magnification: ×400 (A). **P < 0.01 vs Sham group; △△P < 0.01 vs ICT+I/R group. n=15, x±s |
3 讨论
本研究发现,淫羊藿素脂质体能够降低大鼠肝脏I/R损伤后ALT和AST水平,减轻肝损伤并减少肝细胞凋亡,证实淫羊藿素脂质体预处理能够明显减轻大鼠肝脏I/R损伤。Eum等[16]认为肝脏I/R损伤后可直接破坏细胞膜,ALT、AST等一些胞质内成分被释放入血。他们进一步发现,这一过程存在规律性:I/R损伤一旦发生,血清ALT将随之显现出迅速增加的趋势。复流后的前2 h,血清的ALT水平将逐渐升高,其释放的最高峰出现在复流后6 h。本研究结果显示:经血流再灌注2 h和6 h后,ICT+I/R组的大鼠血清ALT水平均明显低于LIP+I/R组以及I/R组;而血清AST水平在再灌注2 h时与LIP+I/R组和I/R组比较差异无统计学意义,但在再灌注6 h时较LIP+I/R组和I/R组明显下降。由此我们认为在I/R损伤的急性期(0~2 h)和中晚期(≥6 h),淫羊藿素脂质体能够有效降低血清ALT的水平,在中晚期还可同时降低AST水平,减少了肝细胞的损伤,这在一定程度上反映了淫羊藿素脂质体在肝脏I/R损伤中发挥肝脏保护作用。该结果得到组织病理学和细胞凋亡结果的进一步证实。
我们主要从抗氧化应激角度探讨了淫羊藿素脂质体对肝脏的保护机制。早在2000年已有学者对淫羊藿素的抗氧化应激作用进行了初步探讨,他们通过建立体外人脐静脉内皮细胞的缺氧/复氧损伤模型,证实淫羊藿素能够明显减轻细胞的氧化损伤,且认为其可能具有抑制PTK通路活化的作用[17]。近年来,相关研究更趋深入。Liu等[12]认为淫羊藿素的类雌激素作用能够上调Bcl-2/Bax比例,促使肝细胞内肝型脂肪酸结合蛋白(L-FABP)与过氧化物酶体增殖物激活受体α(RPAR-α)蛋白表达增强,由此减轻CCl4诱导产生的急性肝细胞氧化损伤。Zhang等[13]的体内实验也发现淫羊藿素具有增强大鼠心肌组织SOD活性、减少MDA生成的作用,其机制可能与促进PI3K/Akt信号通路活化相关。然而就肝脏器官而言,淫羊藿素是否能在体内发挥同样功效,却鲜有文献提及。从我们的实验结果来看,在I/R损伤的早期或中晚期,淫羊藿素脂质体预处理组大鼠肝组织MDA含量均高于两个损伤对照组,表明淫羊藿素脂质体在I/R损伤中能够有效减少肝脏细胞的氧化应激损伤,显现出其抗脂质过氧化作用。然而在复流早期(2 h),3个损伤组SOD活性之间均未显示明显差异,直到复流的中晚期(6 h),淫羊藿素脂质体预处理组的SOD活性才显现出高于其他两个损伤对照组的变化。由此,我们推测淫羊藿素脂质体有可能是通过两种截然不同的方式发挥作用的,即:淫羊藿素脂质体可促进SOD活性升高,间接发挥了清除氧自由基作用;另外,其作为非内源性的氧自由基清除剂,与SOD活性的变化无关,可直接清除此时间段产生的氧自由基,以降低脂质过氧化物的生成。然而具体机制有待于下一步深入研究。
I/R损伤后,机体可释放大量的细胞因子,并触发炎症介质的瀑布样级联反应,最终导致炎症反应。在炎症发生部位大量吞噬细胞被聚集、激活,通过富有NADPH氧化酶以及NADH氧化酶的中性粒细胞介导,可使其所摄取的大部分氧分子接受电子而转变成活性氧(reactive oxygen species,ROS)。由此引起的呼吸爆发将引发血管内皮细胞的损伤、血小板的激活,进而导致微循环阻塞、缺血,终将损伤组织器官[18]。另一方面,中性粒细胞被毛细血管黏附后,封闭的微环境将在其与血管内皮细胞之间形成,致使周围的抗氧化剂及抗蛋白酶无法进入。这种微环境中势必产生大量的ROS,从而加重血管内皮组织损伤[18]。近年来对淫羊藿素在某些器官组织中的抗炎作用已有报道。Lai等[19]通过体外培养腹膜巨噬细胞,并经LPS诱导活化,发现淫羊藿素能够明显减少IL-6、IL-10、单核细胞趋化因子1(MCP-1) 以及TNF等细胞因子的分泌,其机制可能与其诱导MAPK调节P38、JNK信号通路有关。随后,Zhang等[13]在动物实验中也获得了相似的结果。虽然上述两项研究所阐释的具体机制有所不同,但共同揭示了淫羊藿素具有明确的抗炎作用。众所周知,巨噬细胞的抗炎作用强大并且具有多样性,但相较中性粒细胞起效更慢。淫羊藿素是否会在氧化应激损伤发生的急性期对中性粒细胞产生影响,现有的研究较少。我们通过测定MPO活性,着重观察中性粒细胞在肝脏I/R损伤过程中的变化趋势。结果显示:在肝脏I/R损伤的急性期(≤2 h),与两个损伤对照组相比,淫羊藿素脂质体能够明显降低大鼠肝组织中MPO活性。由此表明,淫羊藿素具有抑制中性粒细胞向肝脏组织浸润从而减少肝细胞凋亡的作用。
在正常生理状态下,肝脏中只存在eNOS,且表达水平很低,只产生少量NO,而在一些病理情况下,肝脏中iNOS表达上调,并产生大量NO[20]。值得注意的是,针对NO在肝脏I/R损伤中究竟发挥保护作用还是损伤作用,目前仍存在许多争议。为绝大部分学者所普遍接受的观点是:NO的来源不同,是其发挥何种作用效应的关键[21]。就肝脏本身而言,经eNOS表达产生的NO在I/R损伤中发挥保护作用[22]。而iNOS诱导产生的NO是否同样具有保护作用,取决于缺血时间、复流时间以及具体的实验模型[23]。本研究结果显示:肝脏I/R损伤恢复血流6 h后,淫羊藿素脂质体预处理的大鼠肝组织中NOS、eNOS活性较两个损伤对照组均增高,NO生成也随之增加。同时,各组间iNOS的表达并未显现出明显差异。可以认为淫羊藿素脂质体通过促进eNOS的表达上调,致使NO含量增加,以发挥其对I/R损伤后肝脏的保护作用。
在现代肝脏外科手术中,阻断第一肝门能在很大程度上减少术中出血,提高手术成功率。但该手法却容易引起严重的I/R损伤,导致术后肝功能不全[24]、原发性肝移植物无功能[25]的发生。如何在保证手术安全的同时减轻I/R损伤,促进术后肝功能恢复,是目前临床亟待解决的问题。本研究发现,淫羊藿素脂质体能够通过增加SOD活性、减少MDA的生成,促进eNOS的表达升高、增加NO的含量以及抑制MPO的聚集、减少肝细胞凋亡等多途径发挥其对大鼠肝脏I/R损伤的保护作用。基于上述研究结果,我们将继续在细胞、分子等层面对淫羊藿素脂质体的保护作用进行深入研究,并且考虑选用临床中具有明确肝脏保护作用的非脂质体制剂作为对照,以比较淫羊藿素脂质体的作用效价。同时,对淫羊藿素脂质体的理化稳定性以及质量做出更为系统的评价。期望淫羊藿素脂质体可以作为改善肝脏I/R损伤的新型药物,早日应用于临床。
| [1] | 王可可, 龚其海. 淫羊藿化学成分及药理作用的研究进展[J]. 中国民族民间医药, 2015, 19: 16–18. |
| [2] | 刘凯杰, 李超. 淫羊藿药理研究进展(综述)[J]. 亚热带植物科学, 2014, 43: 183–186. DOI: 10.3969/j.issn.1009-7791.2014.02.021 |
| [3] | 付亮, 袁璟亚, 丁春邦, 张中华. 四川不同产地淫羊藿总黄酮及淫羊藿苷含量的分析测定[J]. 现代中药研究与实践, 2015, 29: 27–31. |
| [4] | JIANG J, LI J, JIA X. The antiosteoporotic activity of central-icaritin (CIT) on bone metabolism of ovariectomized rats[J]. Molecules, 2014, 19: 18690–18704. DOI: 10.3390/molecules191118690 |
| [5] | TAN E M, LI L, INDRAN I R, CHEW N, YONG E L. TRAF6 mediates suppression of osteoclastogenesis and prevention of ovariectomy-induced bone loss by a novel prenylflavonoid[J]. J Bone Miner Res, 2017, 32: 846–860. DOI: 10.1002/jbmr.v32.4 |
| [6] | ZHAO H, GUO Y, LI S, HAN R, YING J, ZHU H, et al. A novel anti-cancer agent icaritin suppresses hepatocellular carcinoma initiation and malignant growth through the IL-6/Jak2/Stat3 pathway[J]. Oncotarget, 2015, 6: 31927–31943. |
| [7] | SUN L, PENG Q, QU L, GONG L, SI J. Anticancer agent icaritin induces apoptosis through caspase-dependent pathways in human hepatocellular carcinoma cells[J]. Mol Med Rep, 2015, 11: 3094–3100. |
| [8] | KANG H K, CHOI Y H, KWON H, LEE S B, KIM D H, SUNG C K, et al. Estrogenic/antiestrogenic activities of a epimedium koreanum extract and its major components: in vitro and in vivo studies[J]. Food Chem Toxicol, 2012, 50: 2751–2759. DOI: 10.1016/j.fct.2012.05.017 |
| [9] | XU F, DING Y, GUO Y, LIU B, KOU Z, XIAO W, et al. Anti-osteoporosis effect of epimedium via an estrogen-like mechanism based on a system-level approach[J]. J Ethnopharmacol, 2016, 177: 148–160. DOI: 10.1016/j.jep.2015.11.007 |
| [10] | MA H R, WANG J, CHEN Y F, CHEN H, WANG W S, AISA H A. Icariin and icaritin stimulate the proliferation of SKBr3 cells through the GPER1-mediated modulation of the EGFR-MAPK signaling pathway[J]. Int J Mol Med, 2014, 33: 1627–1634. |
| [11] | TSANG W P, ZHANG F, HE Q, CAI W, HUANG J, CHAN W Y, et al. Icaritin enhances mESC self-renewal through upregulating core pluripotency transcription factors mediated by ERα[J]. Sci Rep, 2017, 7: 40894. DOI: 10.1038/srep40894 |
| [12] | LIU P, JIN X, LÜ H, LI J, XU W, QIAN H H, et al. Icaritin ameliorates carbon tetrachloride-induced acute liver injury mainly because of the antioxidative function through estrogen-like effects[J]. In Vitr Cell Dev Biol Anim, 2014, 50: 899–908. DOI: 10.1007/s11626-014-9792-8 |
| [13] | ZHANG W, XING B, YANG L, SHI J, ZHOU X. Icaritin attenuates myocardial ischemia and reperfusion injury via anti-inflammatory and anti-oxidative stress effects in rats[J]. Am J Chin Med, 2015, 43: 1083–1097. DOI: 10.1142/S0192415X15500627 |
| [14] | BANGHAM A D, STANDISH M M, WATKINS J C. Diffusion of univalent ions across the lamellae of swollen phospholipids[J]. J Mol Biol, 1965, 13: 238–252. DOI: 10.1016/S0022-2836(65)80093-6 |
| [15] | TSUNG A, SAHAI R, TANAKA H, NAKAO A, FINK M P, LOTZE M T, et al. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion[J]. J Exp Med, 2005, 201: 1135–1143. DOI: 10.1084/jem.20042614 |
| [16] | EUM H A, CHA Y N, LEE S M. Necrosis and apoptosis: sequence of liver damage following reperfusion after 60 min ischemia in rats[J]. Biochem Biophys Res Commun, 2007, 358: 500–505. DOI: 10.1016/j.bbrc.2007.04.153 |
| [17] | ZHANG Y W, MORITA I, SHAO G, YAO X S, MUROTA S. Screening of anti-hypoxia/reoxygenation agents by an in vitro model. Part 1: natural inhibitors for protein tyrosine kinase activated by hypoxia/reoxygenation in cultured human umbilical vein endothelial cells[J]. Planta Med, 2000, 66: 114–118. DOI: 10.1055/s-2000-11128 |
| [18] | 海春旭. 自由基医学[M]. 西安: 第四军医大学出版社, 2006: 77-82. |
| [19] | LAI X, YE Y, SUN C, HUANG X, TANG X, ZENG X, et al. Icaritin exhibits anti-inflammatory effects in the mouse peritoneal macrophages and peritonitis model[J]. Int Immunopharmacol, 2013, 16: 41–49. DOI: 10.1016/j.intimp.2013.03.025 |
| [20] | SHEN S Q, ZHANG Y, XIONG C L. The protective effects of 17 β-estradiol on hepatic ischemia-reperfusion injury in rat model, associated with regulation of heat-shock protein expression[J]. J Surg Res, 2007, 140: 67–76. DOI: 10.1016/j.jss.2006.10.022 |
| [21] | CASILLAS-RAMÍREZ A, MOSBAH I B, RAMALHO F, ROSELLÓ-CATAFAU J, PERALTA C. Past and future approaches to ischemia-reperfusion lesion associated with liver transplantation[J]. Life Sci, 2006, 79: 1881–1894. DOI: 10.1016/j.lfs.2006.06.024 |
| [22] | ZHANG B, LIU Q H, ZHOU C J, HU M Z, QIAN H X. Protective effect of eNOS overexpression against ischemia/reperfusion injury in small-for-size liver transplantation[J]. Exp Ther Med, 2016, 12: 3181–3188. |
| [23] | ABU-AMARA M, YANG S Y, SEIFALIAN A, DAVIDSON B, FULLER B. The nitric oxide pathway-evidence and mechanisms for protection against liver ischaemia reperfusion injury[J]. Liver Int, 2012, 32: 531–543. DOI: 10.1111/liv.2012.32.issue-4 |
| [24] | BELGHITI J, DI CARLO I, SAUVANET A, URIBE M, FEKETE F. A ten-year experience with hepatic resection in 338 patients: evolutions in indications and of operative mortality[J]. Eur J Surg, 1994, 160: 277–282. |
| [25] | STRASBERG S M, HOWARD T K, MOLMENTI E P, HERTL M. Selecting the donor liver: risk factors for poor function after orthotopic liver transplantation[J]. Hepatology, 1994, 20(4 Pt 1): 829–838. |
 2017, Vol. 38
2017, Vol. 38


