眼附属器淋巴瘤是临床比较常见的一种眼眶恶性肿瘤。原发于眼附属器的淋巴瘤90%以上是惰性的小B细胞来源肿瘤,以黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MALT)淋巴瘤最为常见[1-2]。有证据表明MALT淋巴瘤的发病机制可能与慢性病原微生物(如细菌、病毒)或自身免疫反应的刺激有关[3],但目前对MALT淋巴瘤的发病机制尚不是十分清楚。
微小RNA(microRNA, miRNA)是一类普遍存在于动植物中、长度约为22个核苷酸的内源性非编码小分子RNA,通过转录后调控mRNA参与细胞增殖、分化、凋亡和胚胎发育等一系列重要生命进程[4]。MiR-150定位于人类染色体19q13.33,对B细胞和T细胞的成熟、胚胎发育以及干细胞分化等具有重要作用[5]。我们前期研究表明,miR-150在MALT淋巴瘤中表达异常[6],提示miR-150可能参与MALT淋巴瘤的发生和发展。Cbl家族是重要的E3泛素连接酶,其成员Cbl-b具有抑制肿瘤发生、发展的作用,且该作用与miRNA有关,如Cbl-b可通过调控ZEB2和miR-200c抑制胃癌细胞中胰岛素样生长因子1(insulin-like growth factor 1,IGF-1) 诱导的上皮间质转化[7],还可作为miR-891b的下游靶点抑制胰腺癌细胞的增殖[8]。本研究旨在探讨miR-150是否参与结膜MALT淋巴瘤的发生、发展,以及Cbl-b是否作为miR-150下游分子在结膜MALT淋巴瘤的增殖、迁移和侵袭过程中发挥调控作用,为进一步了解MALT淋巴瘤的发生机制及寻找潜在的治疗靶点提供依据。
1 材料和方法 1.1 标本来源及Cbl-b、miR-150检测 1.1.1 标本来源本研究中3例眼附属器结膜MALT淋巴瘤样本均采集于第二军医大学长征医院眼科2016年7月至10月收治的结膜MALT淋巴瘤患者。患者均为男性,年龄40~70岁,发病时间3个月至6年。采集患者行前路经皮开眶取瘤术所获取的MALT淋巴瘤,以及少量瘤旁组织。所有患者除患有结膜MALT淋巴瘤外无其他疾病。本研究经第二军医大学长征医院伦理委员会审批通过。所有患者均签署知情同意书。
1.1.2 qPCR检测Cbl-b、miR-150表达用TRIzol试剂(Invitrogen)抽提MALT淋巴瘤组织及其瘤旁组织的总RNA,通过PrimeScrip反转录试剂盒将1 μg总RNA转录成单链cDNA。于8联管中配制qPCR体系:JumpStar Taq ReadyMix (Sigma) 10 μL,Evagreen dye荧光染料(Biotium) 1 μL,cDNA 25 ng,引物混合物(各5 μmol/L)0.8 μL,加灭菌水至20 μL。qPCR仪为Roche公司产品。qPCR程序如下:95 ℃ 5 min;95 ℃30 s、60 ℃ 30 s、72 ℃ 30 s,共43个循环;95 ℃ 30 s;65 ℃ 2 min;然后按照0.11 ℃/s升温至95 ℃,在升温过程每升高0.2 ℃采集一次荧光值;最后降温至20 ℃结束反应。qPCR引物序列见表 1。
|
|
表 1 qPCR引物序列 Tab 1 Primer sequence for qPCR |
1.2 细胞培养及相关检测 1.2.1 试剂和仪器
MiR-150抑制物序列(5′-CAC UGG UAC AAG GGU UGG GAG A-3′)、模拟物序列(sense 5′-UCU CCC AAC CCU UGU ACC AGU G-3′, antisense 5′-CUG GUA CAA GGG UUG GGA GAU U-3′)和阴性对照(货号B04005) 由上海吉玛制药技术有限公司代为合成,CCK-8试剂盒(日本同仁化学研究所),胎牛血清(FBS)。RPMI 1640培养基(Gibco),Matrigel基质胶(Biocate),Hoechst 33342 (Sigma),DMRIE-C转染试剂(Invitrogen),Lipofectamine 3000转染试剂、Opti-MEM培养液(Thermo),兔抗-Cbl-b、小鼠抗-GAPDH (Santa Cruz)。酶标仪(Thermo),Transwell板(Corning),高内涵成像(Perkin Elmer),流式细胞仪(Beckman),离心机(湖南湘仪离心机仪器有限公司)。
1.2.2 RPMI 8226细胞培养人多发性骨髓瘤细胞RPMI 8226购于中国科学院上海生命科学研究院细胞库。细胞为悬浮细胞,常规培养于含10%FBS的RPMI 1640培养液中,细胞每4 d按照1:3比例传代。
1.2.3 RPMI 8226细胞转染消化收集对数生长期的RPMI 8226细胞,PBS重悬、血细胞计数板计数,弃上清,用Opti-MEM培养液重悬细胞;以每孔3×105的细胞密度接种于24孔板。待贴壁后使用Lipofectamine 3000和DMRIE-C转染试剂将miR-150抑制物转染至细胞,转染24、48 h后确定转染效率。
1.2.4 细胞增殖实验收集对数生长期的细胞,以每孔5×104的细胞密度接种于96孔板,设置4复孔,37 ℃、5% CO2条件下培养24 h。将miR-150抑制物和阴性对照分别转染至细胞,处理24、48、72、96、120 h后,加入CCK-8溶液10 μL,于37 ℃、5% CO2细胞培养箱内继续孵育4 h,酶标仪检测(波长450 nm),绘制生长曲线,并计算细胞相对增殖率[实验组光密度(D)值/空白对照组D值×100%]。
1.2.5 细胞凋亡实验取对数生长期的RPMI 8226细胞,将miR-150抑制物和阴性对照分别转染至细胞,转染72 h后,收集细胞,112×g离心5 min,用预冷的PBS缓冲液洗2次;加入100 μL结合缓冲液,加入7-AAD和PE各5 μL,室温避光孵育30 min;加入400 μL结合缓冲液上流式细胞仪检测。
1.2.6 细胞侵袭和迁移实验细胞侵袭实验:在Transwell板上室底部中央垂直加入100 μL Matrigel基质胶,37 ℃温育30 min。取对数生长期的RPMI 8226细胞,转染miR-150抑制物和阴性对照。转染72 h后,112×g离心3 min,弃上清;用PBS重悬细胞,离心弃上清;用Opti-MEM重悬、调整细胞密度为3×105/mL,在Transwell板下室加入600 μL含20% FBS的培养液,上室加入150 μL细胞悬液,37 ℃、5% CO2、饱和湿度条件下继续培养24 h。后吸去上室细胞悬液,取出上室,棉签轻轻擦去上室贴壁细胞,将上室放入Hoechst 33342染液中室温染色5 min,重新放入新的Transwell板中,于20倍镜下随机选取10个视野拍照并分析。
细胞迁移实验:除Transwell板上室底部不加Matrigel基质胶外,其余步骤同细胞侵袭实验。
1.2.7 蛋白质印迹检测RPMI 8226细胞分别转染miR-150模拟物、miR-150抑制物和阴性对照72 h后, 离心收集细胞并置于RIPA裂解液中,研磨后,12 000×g 4 ℃离心15 min, 取上清。用BCA试剂盒测定蛋白浓度。取等量的蛋白样品行SDS聚丙烯酰胺凝胶电泳,然后转移至PVDF膜上。将PVDF膜用5%脱脂奶粉室温封闭2 h,随后4 ℃标记一抗(小鼠抗-Cbl-b, 1:300;小鼠抗-GAPDH, 1:5 000) 24 h;然后TBST清洗3次,每次10 min;再于二抗中室温孵育2 h。TBST清洗3次后,使用ECL试剂盒显色。蛋白条带灰度值使用ImageJ软件进行分析。
1.3 统计学处理采用GraphPad Prism 5.0软件进行统计学分析。数据以x±sx表示,瘤旁和肿瘤组织两组间均数的比较采用配对t检验,其余实验两组间均数比较采用Student’s t检验,两组以上均数比较采用单因素方差分析(one-way ANOVA),增殖率的比较采用双因素方差分析(two-way ANOVA)。检验水准(α)为0.05。
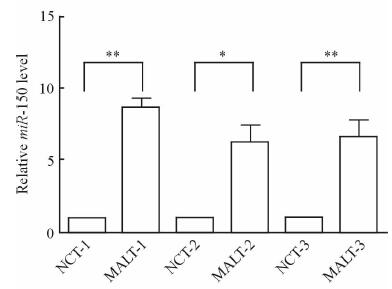
2 结果 2.1 MiR-150在眼附属器结膜MALT淋巴瘤组织中的表达结果显示,与瘤旁组织相比,3例患者淋巴瘤组织中miR-150的表达水平均上调(P<0.05,图 1)。
|
图 1 qPCR检测MALT淋巴瘤中miR-150的表达 Fig 1 MiR-150 levels in MALT lymphoma tissues by qPCR MALT: Mucosa-associated lymphoid tissue; NCT: Negative adjacent control tissue; 1, 2 and 3 indicate the first, second and third patients, respectively. n=3,x±sx. *P < 0.05, **P < 0.01 |
2.2 miR-150抑制物转染效率测定
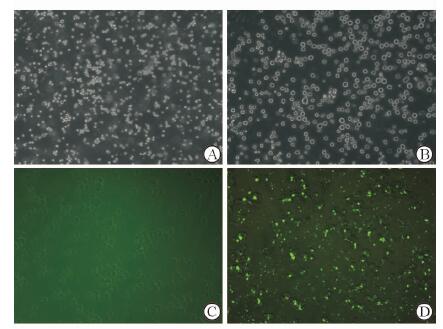
RPMI 8226细胞培养于含10% FBS的RPMI 1640培养液中,为悬浮细胞,圆形,状态较好(图 2A、2B)。转染48 h后,荧光显微镜观察Lipofectamine 3000和DMRIE-C转染miRNA-FAM的表达情况。结果显示,Lipofectamine 3000转染组细胞内未见FAM标记的mi-RNA信号(图 2C); 而DMRIE-C转染组中,DMRIE-C 1.5 μL、miRNA 2 μL、无血清的转染效果最好(图 2D)。
|
图 2 RPMI 8226细胞形态及miR-150抑制物的转染效率 Fig 2 Morphology of RPMI 8226 cells and transfection efficiency of miR-150 inhibitor A, B: Cultured RPMI 8226 cells; C: RPMI 8226 cells tansfected with Lipofectamine 3000 and miRNA-FAM; D: RPMI 8226 cells transfected with DMRIE-C and miRNA-FAM. Original magnification: ×40 (A), ×80 (B-D) |
2.3 抑制miR-150对RPMI 8226细胞增殖的影响
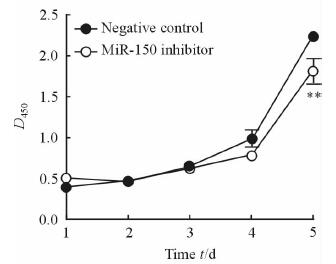
与阴性对照组相比,转染miR-150抑制物可以抑制RPMI 8226细胞的增殖,在120 h时差异有统计学意义(P<0.01,图 3)。相对于阴性对照组,转染miR-150抑制物24、48、72、96、120 h后,细胞相对增殖率分别为121.4%、103.6%、100.7%、87.5%、85.8%。
|
图 3 转染miR-150抑制剂后RPMI 8226细胞的增殖曲线 Fig 3 The proliferation curve of RPMI 8226 cells transfected with MiR-150 inhibitor **P < 0.01 vs negative control. n=4,x±sx |
2.4 抑制miR-150对RPMI 8226细胞迁移与侵袭的影响
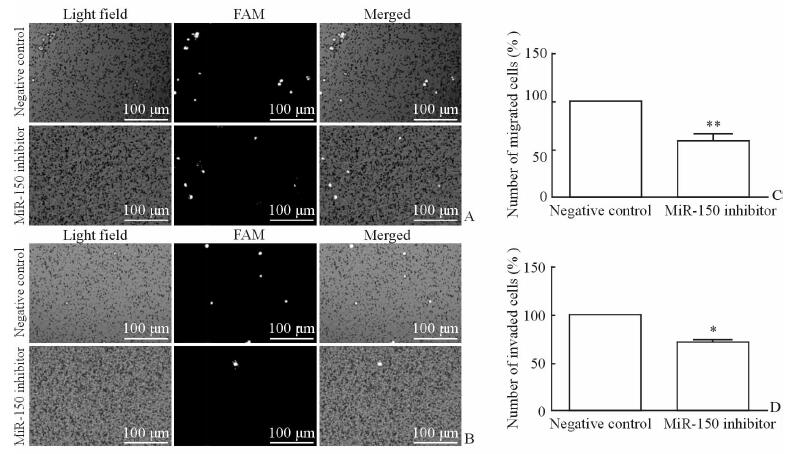
通过Transwell实验检测抑制miR-150对RPMI 8226细胞迁移的影响。结果显示,转染72 h后,miR-150抑制物组穿膜细胞数仅为阴性对照组的(57.7±7.8)%,两组间差异有统计学意义(P<0.01,图 4A、4C)。通过在Transwell板上室底部中央铺Matrigel基质胶,检测抑制miR-150对RPMI 8226细胞侵袭的影响。结果显示,转染72 h后,miR-150抑制剂组穿膜细胞数仅为阴性对照组的(69.7±1.7)%,两组间差异有统计学意义(P<0.05,图 4B、4D)。说明抑制miR-150对RPMI 8226细胞的迁移与侵袭均具有抑制作用。
|
图 4 转染miR-150抑制物对RPMI 8226细胞迁移和侵袭的影响 Fig 4 Effect of miR-150 inhibitor on the migration and invasion of RPMI 8226 cells A, C: Results of migration by Transwell assay; B, D: Results of invasion by Transwell assay. *P < 0.05, **P < 0.01 vs negative control. n=3, x±sx |
2.5 抑制miR-150对RPMI 8226细胞凋亡的影响
通过流式细胞术检测抑制miR-150对RPMI 8226细胞凋亡的影响。结果显示,正常组细胞凋亡率为(0.07±0.01)%,阴性对照组凋亡率为(6.35±0.64)%,而miR-150抑制物组凋亡率为(17.1±0.42)%。与正常组和阴性对照组相比,miR-150抑制物组细胞凋亡增加,差异有统计学意义(P<0.01,图 5)。
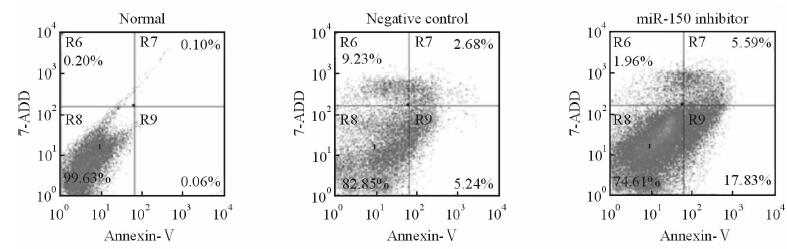
|
图 5 转染miR-150抑制物对RPMI 8226细胞凋亡的影响 Fig 5 Apoptosis in RPMI 8226 cells after treatment with miR-150 inhibitor |
2.6 Cbl-b在结膜MALT淋巴瘤组织中的表达以及miR-150对Cbl-b的调控作用
通过qPCR检测3例结膜MALT淋巴瘤患者肿瘤组织中Cbl-b的表达情况。结果显示,与瘤旁组织相比,3例患者MALT淋巴瘤中Cbl-b mRNA的表达水平分别下调了约76%、80%和86% (P<0.01,图 6)。为了进一步研究miR-150对Cbl-b的调控作用,通过蛋白质印法迹检测抑制和过表达miR-150后RPMI 8226细胞中Cbl-b蛋白的表达。结果显示,与阴性对照组相比,RPMI 8226细胞转染miR-150模拟物后Cbl-b蛋白的表达呈下调趋势但差异无统计学意义(P>0.05),而转染miR-150抑制物后Cbl-b蛋白表达上调(P<0.01)。
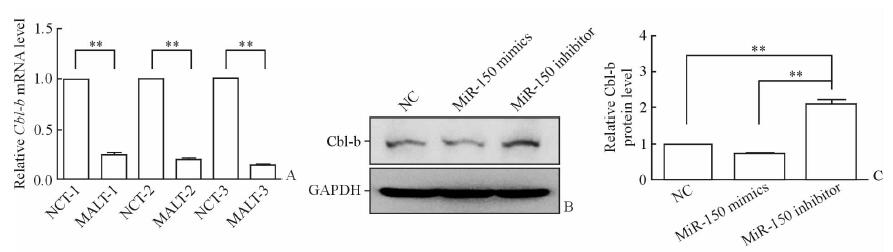
|
图 6 MALT淋巴瘤组织中Cbl-b mRNA的表达以及miR-150对RPMI 8226细胞中Cbl-b蛋白表达的影响 Fig 6 Cbl-b mRNA expression in MALT lymphoma tissues and effect of miR-150 on Cbl-b protein expression in RPMI 8226 cells A: The expression of Cbl-b mRNA realted to NCT by qPCR; B, C: Western blotting results of the expression of Cbl-b protein. MALT: Mucosa-associated lymphoid tissue; NCT: Negative adjacent control tissue; NC: Normal Control. 1, 2 and 3 indicate the first, second and third patients, respectively. **P < 0.01. n=3, x±sx |
3 讨论
作为一种在进化过程中高度保守的内源性非编码小RNA,miRNA主要通过转录后的基因沉默调控细胞的生长、增殖、分化、凋亡等生物学过程[9]。目前研究发现多个miRNA的异常表达参与了淋巴瘤的发生和发展,如miR-15a-16-1的下调或缺失能诱发慢性淋巴细胞白血病;miR-17-92的过表达能加快淋巴瘤的发展;miR-21过表达能诱发前B细胞淋巴瘤,抑制miR-21则导致肿瘤消退[4, 9-10]。我们前期研究发现,MALT淋巴瘤中miR-200a、miR-200b、miR-200c表达下调,并通过上调cyclin E2参与MALT淋巴瘤的发生、发展[6]。通常认为miR-150是一种在造血系统中具有肿瘤抑制作用的小片段RNA,研究发现慢性淋巴细胞白血病、大B细胞淋巴瘤、套细胞淋巴瘤和自然杀伤细胞淋巴瘤等低表达miR-150,而过表达miR-150能抑制这些淋巴瘤细胞的生长[9, 11-12]。但是,miR-150在滤泡性淋巴瘤中表达上调[12]。
为了探讨miR-150在MALT淋巴瘤中的作用及机制,我们首先通过qPCR方法检测本院收治的3例结膜MALT淋巴瘤组织中miR-150的表达。结果表明,与瘤旁组织相比,MALT淋巴瘤组织中miR-150表达均存在不同程度的上调。这一结果与我们的前期研究[6]以及Gebauer等[13]的研究结果一致。此外,Thorns等[4]发现miR-150在胃黏膜相关淋巴组织结外边缘区B细胞淋巴瘤中也具有较高水平的表达。上述研究提示miR-150可能是一种潜在的检测MALT淋巴瘤的肿瘤标志物。由于临床上结膜MALT淋巴瘤常被误诊为慢性结膜炎或过敏性结膜炎,该结果有望为临床上对结膜MALT淋巴瘤的诊断提供依据。
MiR-150对不同的肿瘤细胞具有不同的细胞生物学功能,如miR-150对直肠癌肿瘤细胞的侵袭和迁移具有抑制作用[14],而对肺癌细胞的增殖和迁移却具有促进作用[5]。在MALT淋巴瘤中上调的miR-150的细胞生物学功能尚不清楚。MALT淋巴瘤是一种发生于结外边缘区的B细胞淋巴瘤,其主要细胞类型有滤泡性、套细胞、弥漫性大B细胞和小淋巴细胞性淋巴瘤。RPMI 8226细胞是一种常用的人源性B细胞淋巴瘤细胞系,在本研究中用于探讨眼附属器MALT淋巴瘤的发生机制。通过在RPMI 8226细胞中转染miR-150抑制物研究miR-150对肿瘤细胞的调控机制,结果显示,与阴性对照组相比,抑制miR-150可以抑制RMPI 8226细胞的增殖、促进凋亡,并且抑制RPMI 8226细胞的迁移和侵袭。表明miR-150对RPMI 8226细胞的迁移和侵袭均具有促进作用。以上结果提示,miR-150表达上调能够促进RPMI 8226细胞增殖、迁移和侵袭,从而抑制细胞的凋亡,进而促进MALT淋巴瘤的发生、发展。
既往研究表明,miR-150通过调控下游靶基因参与T细胞和B细胞的发育[15]。Ghisi等[16]发现,miR-150调控Notch3的3′UTR抑制T细胞的发育。我们前期通过targetscan程序发现结膜MALT淋巴瘤中miR-150的靶点蛋白包括Cbl-b等信号分子。Cbl-b属于E3泛素连接酶,包含N末端酪氨酸激酶结合(TKB)结构域、E3泛素化(RING)结构域、C末端的脯氨酸富集区和泛素相关结合域(UBA)[17]。研究表明,Cbl-b通过TKB结合磷酸化的表皮生长因子受体(EGFR)、血管内皮生长因子受体2(VEGFR2) 或血小板源性生长因子受体(PDGFR)胞内段,泛素化并促进这些受体内吞至溶酶体降解或回收利用,防止细胞增殖信号过度活化从而抑制肿瘤发生[18]。本研究发现,3例MALT淋巴瘤患者肿瘤组织中Cbl-b mRNA的表达下调。我们推测Cbl-b的下调可能是由于miR-150的上调所致,Cbl-b的下调参与到MALT淋巴瘤的发生和发展过程。细胞实验结果进一步验证了我们的推测,抑制miR-150可以显著上调Cbl-b蛋白,而给予miR-150模拟物则部分抑制了Cbl-b蛋白的表达。
本研究结果表明,miR-150在结膜MALT淋巴瘤中高表达,并对RPMI 8226细胞的增殖、迁移和侵袭具有促进作用,对细胞凋亡具有抑制作用,miR-150下游分子Cbl-b的表达在结膜MALT淋巴瘤中显著下调。以上研究表明miR-150在结膜MALT淋巴瘤的发生、发展过程中具有促进作用,为将miR-150作为一个肿瘤标志物用于结膜MALT淋巴瘤的临床诊断提供了理论依据,并提示miR-150可能成为治疗结膜MALT淋巴瘤的一个潜在靶点。
| [1] | DEMIRCI H, SHIELDS C L, KARATZA E C, SHIELDS J A. Orbital lymphoproliferative tumors: analysis of clinical features and systemic involvement in 160 cases[J]. Ophthalmology, 2008, 115: 1626–1631. DOI: 10.1016/j.ophtha.2008.02.004 |
| [2] | STACY R C, JAKOBIEC F A, HERWIG M C, SCHOENFIELD L, SINGH A, GROSSNIKLAUS H E. Diffuse large B-cell lymphoma of the orbit: clinicopathologic, immunohistochemical, and prognostic features of 20 cases[J]. Am J Ophthalmol, 2012, 154: 87–98. DOI: 10.1016/j.ajo.2012.01.021 |
| [3] | KELLEY S R. Mucosa-associated lymphoid tissue (MALT) variant of primary rectal lymphoma: a review of the English literature[J]. Int J Colorectal Dis, 2017, 32: 295–304. DOI: 10.1007/s00384-016-2734-z |
| [4] | THORNS C, KUBA J, BERNARD V, SENFT A, SZYMCZAK S, FELLER A C, et al. Deregulation of a distinct set of microRNAs is associated with transformation of gastritis into MALT lymphoma[J]. Virchows Arch, 2012, 460: 371–377. DOI: 10.1007/s00428-012-1215-1 |
| [5] | CAO M, HOU D, LIANG H, GONG F, WANG Y, YAN X, et al. miR-150 promotes the proliferation and migration of lung cancer cells by targeting SRC kinase signalling inhibitor 1[J]. Eur J Cancer, 2014, 50: 1013–1024. DOI: 10.1016/j.ejca.2013.12.024 |
| [6] | CAI J, LIU X, CHENG J, LI Y, HUANG X, LI Y, et al. MicroRNA-200 is commonly repressed in conjunctival MALT lymphoma, and targets cyclin E2[J]. Graefes Arch Clin Exp Ophthalmol, 2012, 250: 523–531. DOI: 10.1007/s00417-011-1885-4 |
| [7] | LI H, XU L, LI C, ZHAO L, MA Y, ZHENG H, et al. Ubiquitin ligase Cbl-b represses IGF-1-induced epithelial mesenchymal transition via ZEB2 and microRNA-200c regulation in gastric cancer cells[J]. Mol Cancer, 2014, 13: 136. DOI: 10.1186/1476-4598-13-136 |
| [8] | DONG Q, LI C, CHE X, QU J, FAN Y, LI X, et al. MicroRNA-891b is an independent prognostic factor of pancreatic cancer by targeting Cbl-b to suppress the growth of pancreatic cancer cells[J]. Oncotarget, 2016, 7: 82338–82353. |
| [9] | HOTHER C, RASMUSSEN P K, JOSHI T, REKER D, RALFKIÆR U, WORKMAN C T, et al. MicroRNA profiling in ocular adnexal lymphoma: a role for MYC and NFKB1 mediated dysregulation of microRNA expression in aggressive disease[J]. Invest Ophthalmol Vis Sci, 2013, 54: 5169–5175. DOI: 10.1167/iovs.13-12272 |
| [10] | ARRIBAS A J, CAMPOS-MARTÍN Y, GÓMEZ-ABAD C, ALGARA P, SÁNCHEZ-BEATO M, RODRIGUEZ-PINILLA M S, et al. Nodal marginal zone lymphoma: gene expression and miRNA profiling identify diagnostic markers and potential therapeutic targets[J/OL]. Blood, 2012, 119: e9-e21. doi: 10.1182/blood-2011-02-339556. |
| [11] | ZHAO J J, LIN J, LWIN T, YANG H, GUO J, KONG W, et al. MicroRNA expression profile and identification of miR-29 as a prognostic marker and pathogenetic factor by targeting CDK6 in mantle cell lymphoma[J]. Blood, 2010, 115: 2630–2639. DOI: 10.1182/blood-2009-09-243147 |
| [12] | FERREIRA B I, GARCÍA J F, SUELA J, MOLLEJO M, CAMACHO F I, CARRO A, et al. Comparative genome profiling across subtypes of low-grade B-cell lymphoma identifies type-specific and common aberrations that target genes with a role in B-cell neoplasia[J]. Haematologica, 2008, 93: 670–679. DOI: 10.3324/haematol.12221 |
| [13] | GEBAUER N, KUBA J, SENFT A, SCHILLERT A, BERNARD V, THORNS C. MicroRNA-150 is up-regulated in extranodal marginal zone lymphoma of MALT type[J]. Cancer Genomics Proteomics, 2014, 11: 51–56. |
| [14] | MA Y, ZHANG P, WANG F, ZHANG H, YANG J, PENG J, et al. miR-150 as a potential biomarker associated with prognosis and therapeutic outcome in colorectal cancer[J]. Gut, 2012, 61: 1447–1453. DOI: 10.1136/gutjnl-2011-301122 |
| [15] | ZHOU B, WANG S, MAYR C, BARTEL D P, LODISH H F. miR-150, a microRNA expressed in mature B and T cells, blocks early B cell development when expressed prematurely[J]. Proc Natl Acad Sci USA, 2007, 104: 7080–7085. DOI: 10.1073/pnas.0702409104 |
| [16] | GHISI M, CORRADIN A, BASSO K, FRASSON C, SERAFIN V, MUKHERJEE S, et al. Modulation of microRNA expression in human T-cell development: targeting of NOTCH3 by miR-150[J]. Blood, 2011, 117: 7053–7062. DOI: 10.1182/blood-2010-12-326629 |
| [17] | ZHANG J, LIU Q, LANGDON W Y. Cbl-b: roles in T cell tolerance, proallergic T cell development, and cancer immunity[J]. Inflamm Cell Signal, 2014, 1. DOI: 10.14800/ics.146 |
| [18] | RAO N, DODGE I, BAND H. The Cbl family of ubiquitin ligases: critical negative regulators of tyrosine kinase signaling in the immune system[J]. J Leukoc Biol, 2002, 71: 753–763. |
 2017, Vol. 38
2017, Vol. 38



